Química del agua 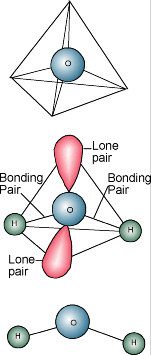 Probablemente sabes que la descripción química del agua es H2O. Una molécula de agua está formada por un átomo de oxígeno unido a dos átomos de hidrógeno. Los átomos de hidrógeno están «unidos» a un lado del átomo de oxígeno, lo que hace que la molécula de agua tenga una carga positiva en el lado donde están los átomos de hidrógeno y una carga negativa en el otro lado, donde está el átomo de oxígeno. Como las cargas eléctricas opuestas se atraen, las moléculas de agua tienden a atraerse entre sí, lo que hace que el agua sea algo «pegajosa». El lado con los átomos de hidrógeno (carga positiva) atrae el lado del oxígeno (carga negativa) de otra molécula de agua.
Probablemente sabes que la descripción química del agua es H2O. Una molécula de agua está formada por un átomo de oxígeno unido a dos átomos de hidrógeno. Los átomos de hidrógeno están «unidos» a un lado del átomo de oxígeno, lo que hace que la molécula de agua tenga una carga positiva en el lado donde están los átomos de hidrógeno y una carga negativa en el otro lado, donde está el átomo de oxígeno. Como las cargas eléctricas opuestas se atraen, las moléculas de agua tienden a atraerse entre sí, lo que hace que el agua sea algo «pegajosa». El lado con los átomos de hidrógeno (carga positiva) atrae el lado del oxígeno (carga negativa) de otra molécula de agua.
Todas estas moléculas de agua que se atraen unas a otras significan que tienden a agruparse. Por eso las gotas de agua son, de hecho, gotas. Si no fuera por algunas de las fuerzas de la Tierra, como la gravedad, una gota de agua tendría forma de bola, una esfera perfecta. Aunque no forme una esfera perfecta en la Tierra, deberíamos alegrarnos de que el agua sea pegajosa.
El agua se llama el «disolvente universal» porque disuelve más sustancias que cualquier otro líquido. Esto significa que allá donde va el agua, ya sea a través de la tierra o de nuestro cuerpo, se lleva consigo valiosas sustancias químicas, minerales y nutrientes.
El agua pura tiene un pH neutro. El agua pura tiene un pH de aproximadamente 7, que no es ni ácido ni básico.
Propiedades físicas del agua:
El agua es única en el sentido de que es la única sustancia natural que se encuentra en los tres estados -líquido, sólido (hielo) y gaseoso (vapor)- a las temperaturas habituales de la Tierra. El agua de la Tierra está en constante interacción, cambio y movimiento.
 El agua se congela a 32° Fahrenheit (F) y hierve a 212° F. De hecho, los puntos de congelación y ebullición del agua son la referencia con la que se mide la temperatura: 0° en la escala Celsius es el punto de congelación del agua, y 100° es el punto de ebullición del agua. El agua tiene la particularidad de que su forma sólida, el hielo, es menos densa que su forma líquida, por lo que el hielo flota.
El agua se congela a 32° Fahrenheit (F) y hierve a 212° F. De hecho, los puntos de congelación y ebullición del agua son la referencia con la que se mide la temperatura: 0° en la escala Celsius es el punto de congelación del agua, y 100° es el punto de ebullición del agua. El agua tiene la particularidad de que su forma sólida, el hielo, es menos densa que su forma líquida, por lo que el hielo flota.
El agua tiene un alto índice de calor específico. Esto significa que el agua puede absorber mucho calor antes de empezar a calentarse. Por eso el agua es valiosa para las industrias y en el radiador de tu coche como refrigerante. El alto índice de calor específico del agua también ayuda a regular la velocidad a la que el aire cambia de temperatura, por lo que el cambio de temperatura entre estaciones es gradual y no repentino, especialmente cerca de los océanos.
El agua tiene una tensión superficial muy alta. En otras palabras, el agua es pegajosa y elástica, y tiende a agruparse en gotas en lugar de extenderse en una fina película. La tensión superficial es la responsable de la acción capilar, que permite que el agua (y sus sustancias disueltas) se desplace por las raíces de las plantas y por los diminutos vasos sanguíneos de nuestro cuerpo.
Temperatura del agua:
La temperatura del agua no sólo es importante para los bañistas y pescadores, sino también para las industrias e incluso para los peces y las algas. Se utiliza mucha agua para la refrigeración en las centrales eléctricas que generan electricidad. Para empezar, necesitan agua fría y, por lo general, devuelven el agua más caliente al medio ambiente. La temperatura del agua liberada puede afectar a los hábitats aguas abajo. La temperatura también puede afectar a la capacidad del agua para retener el oxígeno, así como a la capacidad de los organismos para resistir ciertos contaminantes.
PH:
El pH es una medida de lo ácida/básica que es el agua. El rango va de 0 a 14, siendo 7 el valor neutro. Un pH inferior a 7 indica acidez, mientras que un pH superior a 7 indica una base. El pH es realmente una medida de la cantidad relativa de iones de hidrógeno e hidroxilo libres en el agua. El agua que tiene más iones de hidrógeno libres es ácida, mientras que el agua que tiene más iones de hidroxilo libres es básica. Dado que el pH puede verse afectado por las sustancias químicas presentes en el agua, es un indicador importante del agua que está cambiando químicamente. El pH se expresa en «unidades logarítmicas», como la escala de Richter, que mide los terremotos. Cada número representa un cambio de 10 veces en la acidez/básica del agua. El agua con un pH de 5 es diez veces más ácida que el agua con un pH de 6.
La contaminación puede cambiar el pH del agua, lo que a su vez puede perjudicar a los animales y plantas que viven en ella. Por ejemplo, el agua que sale de una mina de carbón abandonada puede tener un pH de 2, que es muy ácido y afectaría definitivamente a cualquier pez lo suficientemente loco como para intentar vivir en él. Utilizando la escala del logaritmo, esta agua de drenaje de la mina sería 100.000 veces más ácida que el agua neutra – así que mantente alejado de las minas abandonadas.
Conductancia específica:
La conductancia específica es una medida de la capacidad del agua para conducir una corriente eléctrica. Depende en gran medida de la cantidad de sólidos disueltos (como la sal) en el agua. El agua pura, como el agua destilada, tendrá una conductancia específica muy baja, y el agua de mar tendrá una conductancia específica alta. El agua de lluvia suele disolver los gases y el polvo presentes en el aire, por lo que suele tener una conductancia específica mayor que el agua destilada. La conductancia específica es una medida importante de la calidad del agua porque da una buena idea de la cantidad de material disuelto en el agua.
Probablemente en la escuela has hecho el experimento en el que conectas una batería a una bombilla y pasas dos cables desde la batería a un vaso de precipitados con agua. Cuando los cables se ponen en un vaso de agua destilada, la luz no se enciende. Sin embargo, la bombilla sí se enciende cuando el vaso contiene agua salada (salina). En el agua salada, la sal se ha disuelto, liberando electrones libres, y el agua conducirá una corriente eléctrica.
Turbidez:
La turbidez es una medida de la nubosidad del agua. Se mide haciendo pasar un haz de luz a través del agua y viendo cuánto se refleja en las partículas del agua. La turbidez del agua está causada por materiales, como la suciedad y los residuos de las hojas, que están suspendidos (flotando) en el agua. El agua cristalina, como la del lago Tahoe (donde se trabaja duro para evitar que los sedimentos lleguen al lago) tiene una turbidez muy baja. Pero mira un río después de una tormenta: probablemente sea marrón. Estás viendo toda la tierra suspendida en el agua. Por suerte para nosotros, los materiales que causan turbidez en el agua potable se sedimentan o se filtran antes de que el agua llegue a nuestro vaso en casa. La turbidez se mide en unidades nefelométricas de turbidez (NTU).
Oxígeno disuelto:
Aunque las moléculas de agua contienen un átomo de oxígeno, este oxígeno no es el que necesitan los organismos acuáticos que viven en nuestras aguas naturales. Una pequeña cantidad de oxígeno, hasta unas diez moléculas de oxígeno por millón de agua, está realmente disuelta en el agua. Este oxígeno disuelto lo respiran los peces y el zooplancton y lo necesitan para sobrevivir.
El agua que se mueve rápidamente, como en un arroyo de montaña o un gran río, suele contener mucho oxígeno disuelto, mientras que el agua estancada contiene poco. El proceso en el que las bacterias del agua ayudan a la descomposición de la materia orgánica, como la que proviene de una planta de tratamiento de aguas residuales, consume oxígeno. Así, el exceso de materia orgánica en nuestros lagos y ríos puede provocar una situación de déficit de oxígeno. La vida acuática puede tener dificultades en aguas estancadas con mucha materia orgánica en descomposición, especialmente en verano, cuando los niveles de oxígeno disuelto están en su punto más bajo.
Dureza:
La cantidad de calcio y magnesio disuelto en el agua determina su «dureza». La dureza del agua varía en todo Estados Unidos. Si vive en una zona donde el agua es «blanda», es posible que nunca haya oído hablar de la dureza del agua. Pero si vive en Florida, Nuevo México, Arizona, Utah, Wyoming, Nebraska, Dakota del Sur, Iowa, Wisconsin o Indiana, donde el agua es relativamente dura, puede notar que es difícil hacer espuma al lavarse las manos o la ropa. Además, es posible que las industrias de su zona tengan que gastar dinero para ablandar el agua, ya que el agua dura puede dañar los equipos. El agua dura puede incluso acortar la vida de los tejidos y la ropa. ¿Significa esto que los estudiantes que viven en zonas con agua dura no están a la última moda, ya que su ropa se desgasta más rápido?
Sedimentos suspendidos:
Los sedimentos suspendidos son la cantidad de tierra que se mueve en una corriente. Depende en gran medida de la velocidad del flujo de agua, ya que el agua que fluye rápidamente puede recoger y suspender más tierra que el agua tranquila. Durante las tormentas, la tierra es arrastrada desde las orillas de los arroyos hacia ellos. La cantidad que se arrastra a un arroyo depende del tipo de tierra en la cuenca de drenaje del río y de la vegetación que lo rodea.
Si se perturba la tierra a lo largo de un arroyo y no se toman medidas de protección, el exceso de sedimentos puede dañar la calidad del agua de un arroyo. Probablemente haya visto esas cortas vallas de plástico que los constructores colocan en los bordes de la propiedad que están urbanizando. Se supone que estas vallas atrapan los sedimentos durante una tormenta y evitan que lleguen a un arroyo, ya que el exceso de sedimentos puede dañar los arroyos, los ríos, los lagos y los embalses.
Los sedimentos que llegan a un embalse son siempre una preocupación; una vez que entran no pueden salir, la mayor parte se deposita en el fondo. Los embalses pueden «ensuciarse» si entran demasiados sedimentos. El volumen del embalse se reduce, lo que se traduce en una menor superficie para la navegación, la pesca y las actividades recreativas, además de reducir la capacidad de generación de energía de la central eléctrica de la presa.
Geoquímica de soluciones acuosas:
Mira un diagrama del ciclo hidrogeoquímico.
- Ácido = sustancia que contiene hidrógeno y que da hidrógeno libre (H + ) cuando se disuelve en agua
- Base = sustancia que contiene el grupo OH y que cede el libre (OH – ) cuando se disuelve en agua
-
Una solución ácida es la que contiene un exceso de H + libre, y una base es la que contiene un exceso de OH – libre. Una reacción entre un ácido y una base suele llamarse neutralización.
Por ejemplo:
-
HCl (ácido) + NaOH (base) ==> H 2 O + NaCl
que se disocian en iones:
H + + Cl – + Na + OH – ==> H 2 O + Na + Cl – - es decir, Na + y Cl – no se ven afectados.
- pH = logaritmo inverso de la concentración (actividad) de H + libre , o pH = -log
-
El agua se disocia en H + y OH – ;
-
la constante de disociación es: K agua = =10 -14
- Así que tiene que haber 10 -7 moles cada uno de H + y OH – en un kilogramo de solución neutra a temperatura estándar de 25°C. Un mol es 6,023 x 10 23 átomos (o moléculas) y el H 2 O tiene un peso molecular de 18 gramos por mol. Un kilogramo de agua tiene alrededor de 1000/18 = 55,6 moles de agua o alrededor de 3,35 x 10 25 átomos de oxígeno y aproximadamente el doble de ese número (6,7 x 10 25 átomos) de H + (la cantidad de H + libre o OH libre – es relativamente pequeño en comparación con la cantidad de H 2 O no disociado).
- El pH oscila a 25°C entre 0 y 14; pH < 7 = solución ácida; pH > 7 = solución básica. Si se añade HCl u otro ácido, el pH disminuye; si se añade NaOH u otra base, el pH aumenta.
- El pH aumenta al disociarse el ácido carbónico (un ácido débil): Cuando el dióxido de carbono se combina con el agua, como ocurre en la atmósfera cuando se queman combustibles fósiles, se forma ácido carbónico: H 2 O + CO 2 ==> H 2 CO 3 . Los H + libres se ponen a disposición durante las sucesivas disociaciones:
-
H 2 CO 3 ==> H + + HCO 3- ácido carbónico a bicarbonato, ocurre a pH ~6,4
-
HCO 3 ==> H + CO 32- bicarbonato a carbonato, ocurre a pH ~10.3
Recuerde, el H + libre está disponible sólo cuando es ácido, o cuando el pH < ~7. La disociación de bicarbonato a carbonato se produce cuando hay demasiado OH – en el sistema y el H + se «libera» para equilibrar la base.
- Cationes y aniones disueltos en el agua
Cationes = donantes de electrones, cargados positivamente: Na + , K + , Mg ++ , Ca ++ , Fe ++ o Fe +++ , Mn ++ , Al +++
Aniones = aceptores de electrones, cargados negativamente: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metales = actúan como cationes principalmente: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, etc.
- Análisis del agua – Necesidad de tener un balance catión-anión
millequivalente (MEQ) = carga equivalente molar o anión o catión, medida de la carga total debida al ion en cuestión disuelto en la solución. Se parte de la concentración, se divide por el peso molar y se multiplica por la carga: XX mg/L / MW x CHG = MEQ
Ejemplo: NaCl en solución, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Así pues, si las MEQ totales de cationes y aniones no están equilibradas, existe algún error en el análisis.