O sistema imunológico
O sistema imunológico é composto de tecidos, células e moléculas cuja função primária é detectar, responder e eliminar patógenos e células transformadas.
A Resposta Imunológica Inata e Adaptativa
Há dois componentes principais do sistema imunológico-1) o sistema imunológico inato e 2) o sistema imunológico adaptativo. O sistema imunológico inato atua como a primeira linha de defesa e detecta patógenos através de receptores de reconhecimento de padrões codificados pela linha germinal, não forma memória e responde rapidamente (dentro de minutos a horas). O sistema imunológico adaptativo responde lentamente (em dias), usa receptores específicos de antígenos que passam por múltiplos rearranjos genéticos durante o desenvolvimento, e forma memória imunológica – “aprendendo” com o insulto inicial e preparando o corpo para combater a exposição futura a material nocivo semelhante. Ambos os tipos de respostas imunológicas podem ser impulsionadas por macromoléculas dentro do líquido extracelular ou pela ativação de células imunológicas específicas. Estas respostas são conhecidas como imunidade humoral e imunidade mediada por células, respectivamente.
Sob o guarda-chuva da resposta imunitária mediada por células, as células imunitárias estratificam-se principalmente com base no facto da resposta ser inata ou adaptativa. O sistema imunitário inato consiste principalmente em células fagocitárias, tais como neutrófilos, macrófagos, células assassinas naturais, basófilos e outras que têm como alvo organismos invasores perigosos. As células do sistema imunológico adaptativo são células T e células B. As células T naturais assassinas (NK) têm características tanto de células imunes inatas como adaptativas. Além disso, a maioria dos outros tipos de células, não específicas do sistema imunológico, podem abrigar funções imunes intrínsecas inatas na forma de receptores citoplasmáticos e moléculas sinalizadoras e efetoras, tais como membros das famílias RIG-I, STING e NLR. Como iremos rever mais adiante, as células de ambos os sistemas surgem de diferentes linhagens mielóides e linfóides de células estaminais hematopoiéticas.
Componentes do sistema imunitário
As células imunitárias maduras diferenciam-se das conhecidas como células estaminais hematopoiéticas. São células progenitoras não diferenciadas pluripotentes encontradas na medula óssea, no sangue periférico e na placenta. Estas células estaminais hematopoiéticas podem diferenciar-se na célula progenitora mielóide comum ou na célula progenitora linfóide comum.
Células linfóides
As células progenitoras linfóides comuns podem diferenciar-se em quatro grandes populações de linfócitos que podem ser distinguidas pela expressão do receptor da superfície celular: Células T, células B, células naturais assassinas (NK) e células NK-T.
Células T
Células T desempenham um papel crítico na imunidade mediada por células. Estas células são identificadas pela expressão de cadeias de sinalização de células T CD3.
Células T surgem de células progenitoras linfóides que se desenvolvem originalmente a partir de células estaminais hematopoiéticas na medula óssea. Quando o progenitor linfóide se compromete a tornar-se uma célula T, ele migra da medula óssea para o timo (daí o nome de célula T). O timo fornece o microambiente adequado onde as células T podem desenvolver-se nos seus vários subtipos, definidos pelos receptores específicos expressos na superfície da célula. As células T maduras nos estágios iniciais, ou timócitos, carecem de receptores para as células CD4 e CD8 e são, portanto, chamadas de células duplamente negativas (DN). As células DN sofrem então rearranjos genéticos e mutações nos genes que codificam os receptores das células T alfa e beta (TCR), o que as inicia por um caminho de comprometimento da linhagem em que o resultado final é um receptor de células T com afinidade específica para um antígeno único.
Os timócitos são então selecionados, tanto positiva como negativamente, para assegurar que eles reconheçam antígenos “estranhos”, mas não antígenos hospedeiros, que são apresentados como peptídeos através do MHC na superfície celular. Somente as células que passarem em ambos os testes serão então acionadas para expressar CD4 e CD8, tornando-se células duplo-positivas. No final da maturação, as células T ou expressarão CD4 ou CD8 (e perderão a expressão da outra) e, assim, se tornarão células unipositivas. Estas células T maduras CD4 ou CD8-positivas são então liberadas na corrente sanguínea e estão inicialmente no estado ingênuo, o que significa que ainda não se comprometeram com um determinado subtipo de célula T.
Se o timócito maduro mostrar uma afinidade intermediária para os peptídeos MHC durante a maturação então ele pode ser selecionado para se tornar uma célula T reguladora (Treg) por sua capacidade de reconhecer antígenos “auto” nocivos. As células T no sangue ou nos tecidos periféricos também podem ser induzidas localmente para se tornarem Tregs. A principal função de Tregs é manter a tolerância aos auto-antigénios, bem como limitar a função e proliferação das células T-efectoras.
Uma vez que chegam ao sangue ou ao tecido periférico, as células T ingénuas podem ser induzidas a tornarem-se células T-helper. As células que apresentam antígenos (APCs), tais como macrófagos, células dendríticas e células B, mostrarão o antígeno à célula T, e se o seu receptor tiver afinidade a célula T reconhecerá o antígeno. Normalmente, as células T CD4+ são adequadas para reconhecer antígenos peptídeos ligados a proteínas MHC classe II. Uma vez que o complexo peptídeo-MHC é reconhecido, a célula T ativará uma série de vias internas que permitem que o reconhecimento do antígeno seja verificado. Somente então a célula T-helper irá proliferar, expandindo o pool de células disponíveis que são específicas para o antígeno prejudicial, tais como diferentes bactérias e parasitas.
Uma vez que as células T-helper tenham reconhecido seu antígeno e se tornem ativadas, elas liberarão uma variedade de citocinas, que são moléculas que sinalizam a outras células imunes como responder apropriadamente à molécula prejudicial. Existem vários subconjuntos de células T de ajuda, incluindo Th1, Th2 e Th17. Estes subconjuntos produzem e secretam citoquinas distintas que ajudam a personalizar a resposta imunológica, dependendo do tipo de patógeno. Por exemplo, as células Th1 dependem da citocina efetora IFN-γ para sinalizar macrófagos para digerir e destruir o material nocivo, enquanto as células Th2 secretam uma combinação de IL-4, IL-5, IL-9, IL-10 e IL-13 para acionar os basófilos, eosinófilos e outras células para atacar a infecção. A quantidade específica e as variedades de citocinas determinarão a resposta apropriada à infecção ou à célula nociva. As células T também podem responder às células do self, tornando-se células T citotóxicas (ou células T assassinas naturais). Normalmente estas são células CD8+ que reconhecem células infectadas pelo vírus ou células tumorais. As células T assassinas naturais (NKTs) serão discutidas com mais detalhes em uma seção posterior. Estas e outros tipos de células T desempenham suas várias funções ou funções efetoras de maneiras diferentes para reconhecer material nocivo e recrutar outras células imunes para destruí-lo, bem como construir uma resposta imune duradoura ao mesmo tipo de insulto.
O caminho interativo de sinalização do receptor da célula T é revisado em detalhes aqui.
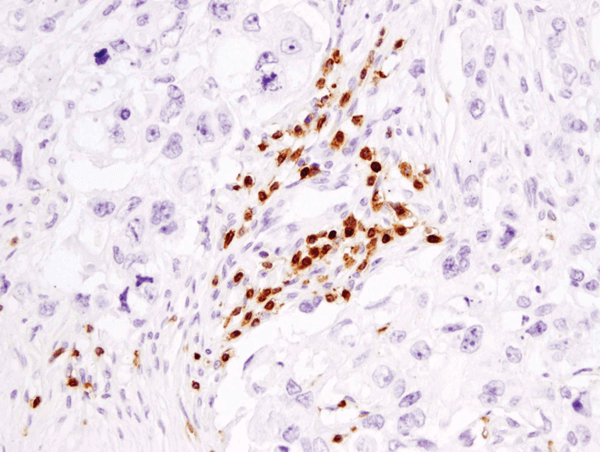
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Análise do IHC do carcinoma de mama humano com parafina usando o #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: análise de IHC de carcinoma de mama humano impregnado de parafina usando o #85061.
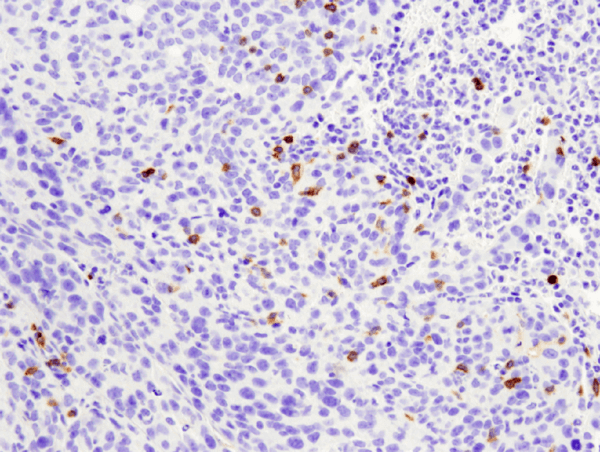
CD4 (D7D2Z) Coelho mAb #25229: Análise de IHC de tumor metastático 4T1 em pulmão de camundongo em parafina usando #25229.
CD4 (D7D2Z) Coelho mAb #25229: Análise de IHC de tumor metastático 4T1 em pulmão de camundongo em parafina usando o #25229.
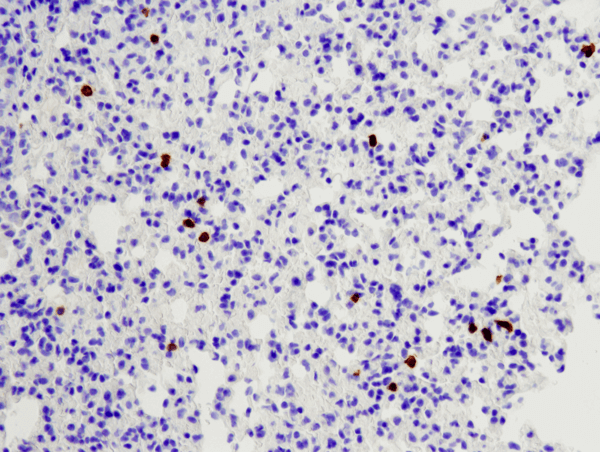
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Análise IHC do pulmão do rato em parafina usando o #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Específico do Rato) #98941: Análise IHC do pulmão do rato em parafina usando o #98941.
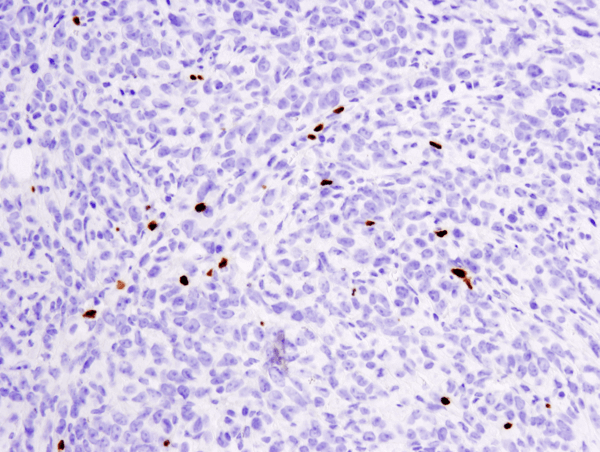
FoxP3 (D6O8R) Coelho mAb #12653: Análise IHC de tumor metastático 4T1 em pulmão de rato incluído em parafina usando o #12653.
FoxP3 (D6O8R) Coelho mAb #12653: Análise por IHC de tumor metastático 4T1 em pulmão de camundongo em parafina usando o #12653.
Células B
Células B são as células críticas no sangue que medeiam a produção de anticorpos. Quando material nocivo está presente na corrente sanguínea, é reconhecido como um antígeno por receptores específicos nas células B. Depois de processar o antígeno, e com a ajuda das células T, a célula B amadurece em plasmócitos que secretam anticorpos. As células B também podem desempenhar um papel na apresentação de antígenos e secreção de citocinas. Tanto o desenvolvimento como as várias funções da célula B serão discutidos.
15% dos leucócitos encontrados no sangue periférico são células B. As células B produzem imunoglobulinas (Ig), que são proteínas que ligam os antígenos (também conhecidas como anticorpos) compostas por duas cadeias pesadas idênticas e duas cadeias luminosas idênticas. Estas imunoglobulinas contêm sítios específicos de oferta de antigénios que variam na sequência de aminoácidos de uma molécula de anticorpos para outra. Estes locais conferem especificidade de cada anticorpo para o reconhecimento de um antígeno distinto.
Como mencionado acima, as células B diferenciam-se das células hematopoiéticas encontradas na medula óssea. É dentro da medula óssea que os receptores de Ig de superfície (anticorpos) são reunidos através de um processo de rearranjo genético. As células B utilizam a união somática de diferentes genes em uma infinidade de cromossomos que codificam as diferentes partes das cadeias pesadas e leves que compõem a Ig. As células B são empurradas para diferenciação através da produção de IL-7 por células do estroma da medula óssea. Essas células B em desenvolvimento seguem um programa de rearranjos seqüenciais de cadeias pesadas e leves mediados pela expressão do receptor de superfície celular diferencial. Por exemplo, a expressão de um receptor específico de células pré-B evita certos rearranjos genéticos em cromossomos não relacionados para garantir que a célula B madura possa expressar um certo receptor de superfície Ig capaz de reconhecer especificamente um único antígeno. Este processo é chamado exclusão alélica. A montagem incorreta das cadeias pesadas de Ig e cadeias leves pode induzir rearranjos secundários para a edição do receptor.
Além da expressão da superfície celular de um receptor de Ig, as células B também contêm proteínas transmembranas que podem induzir sinais intracelulares após a ligação de um antígeno à porção extracelular do receptor de Ig. As células B usam cascatas de sinalização intracelular semelhantes às células T que induzem mudanças transcripcionais que levam à proliferação e maturação. Especificamente, os domínios intracelulares do receptor de Ig podem ser fosforilados pela família src de quinases, iniciando uma cascata que é passada pela tirosina quinase Syk e uma proteína linker conhecida como BLINK para a fosfolipase C e fatores de troca de guanina, finalmente ativando a proteína quinase C, mobilizando cálcio, e ativando a MAP quinase de uma forma Ras/Rac-dependente.
Uma característica única das células B é a sua capacidade de se submeterem à mudança de isótipo. Isto refere-se especificamente a um processo de rearranjo do DNA que pode gerar cadeias pesadas ligeiramente diferentes. Além disso, emendas alternativas de exons de cadeia pesada podem permitir que a Ig permaneça ligada à superfície da célula ou se torne secretada se o exon transmembrana for emendada. Emendas alternativas e mudança de isótipo são induzidas através de citocinas derivadas de células T. Adicionalmente, as células T podem induzir mutações somáticas que levam a mudanças dentro dos sítios de ligação de antígenos das células B. Uma função auto-corretora das células B pode detectar se essas mutações aparentemente aleatórias levam a uma perda de afinidade com o antígeno e iniciar um programa para a morte da célula. Assim, antígenos que ativam tanto células T quanto células B acionam a maturação da célula T mediada por células B através de comutação isotipo e mutações somáticas, ambas altamente associadas à memória da célula B.
As respostas da memória são caracterizadas por uma rápida e extensa produção de Ig de alta afinidade para tais antígenos. O desenvolvimento destas respostas de memória são críticas para o sucesso da vacinação. No entanto, elas também podem aumentar a auto-imunidade e as reacções alérgicas.
Ativação de células B independentes de células T por um antígeno também pode ocorrer; entretanto, este tipo de ativação está ligado à memória imunológica fraca. Além disso, estes antigénios devem ser poliméricos para activar as células B.
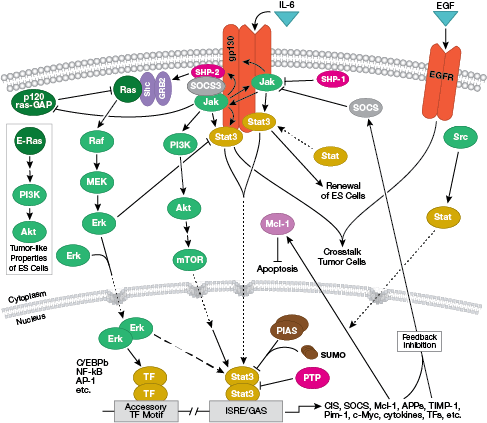
NB: Citoquinas, ou interleucinas (ILs), são moléculas secretadas que atuam em receptores transmembrana de superfície celular. Ao serem ligadas, estas citocinas ativam vias de transdução de sinal intracelular tipicamente dependentes da sinalização Jak-STAT.
A via interativa de sinalização do receptor de células B é revisada em detalhes aqui.
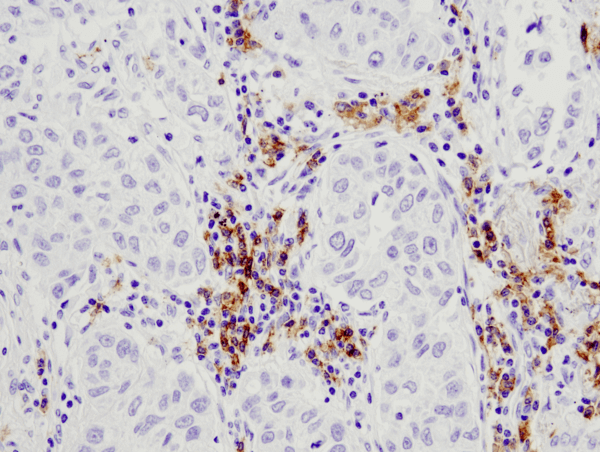
CD19 (D4V4B) XP® Rabbit mAb #90176: Análise IHC de carcinoma de pulmão humano embebido em parafina usando #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: Análise IHC de carcinoma de pulmão humano embebido em parafina usando #90176.
Células NK
Matador natural, ou NK, as células são outro tipo de célula derivada da linhagem linfóide. Similar às células B, elas se desenvolvem na medula óssea de forma citoquina e estroma de medula óssea dependente de células. Elas representam uma pequena proporção do sangue periférico e não possuem receptores específicos de antígenos. Em vez disso, as células NK dependem de um conjunto complexo de receptores transmembrana. Em particular, eles contêm receptores de superfície celular inibitórios que reconhecem moléculas HLA classe I e, portanto, são inibidos por moléculas auto-MHC, matando apenas as células que têm expressão HLA classe I desregulada. Portanto, eles servem ao importante propósito de atingir células infectadas por vírus e células tumorais cuja expressão HLA classe I está desregulada para evitar a morte por células CD8+ natural killer T (NK-T). As células NK também podem ser ativadas de forma anti-corpo, interferon ou citocina e, portanto, podem desempenhar um grande papel no combate a tumores. O mecanismo de ação das células NK depende da liberação de pequenos grânulos contendo granzimas e perforina de seu citoplasma. Após a sua libertação, estas proteínas podem fazer poros e quebrar proteínas intracelulares para induzir a apoptose. Como tal, diz-se que as células NK são citotóxicas.
As células NK-T são um subtipo especial de células T que expressam certos receptores e marcadores tipicamente expressos pelas células NK em combinação com um repertório limitado de receptores de células T. Portanto, este subtipo único compartilha propriedades tanto das células T quanto das células NK. Ao contrário das células NK, que se desenvolvem na medula óssea, as células NK-T se desenvolvem no timo.
Células mielóides
Células progenitoras mielóides comuns, que são descendentes de células estaminais hematopoéticas, dão origem a vários tipos diferentes de células mielóides, incluindo macrófagos, células dendríticas e várias outras células imunes inatas e células sanguíneas.
Macrófagos
Macrófagos podem ser desencadeados para reconhecer antígenos, tais como células danificadas ou material estranho, para destruição a pedido. Os macrófagos estão presentes na maioria dos tecidos e respondem quando necessário a infecções e células moribundas. O material reconhecido é destruído através da fagocitose no macrófago, que dá às células o seu nome (“big eater” em grego). Os macrófagos assumem várias formas quando presentes em diferentes locais e podem desempenhar funções adicionais para além da fagocitose.
Na lesão tecidual ou infecção patogénica, os monócitos no sangue serão recrutados para o tecido afectado e diferenciar-se-ão para fazer macrófagos. Dependendo da localização do tecido, existem diferentes tipos de macrófagos, tais como células Kupffer no fígado, macrófagos alveolares no pulmão, microglia no cérebro, etc. Estes diferentes tipos de macrófagos provêm todos de monócitos mas são especializados na sua função para o tecido residente. A maior parte da função geral da fagocitose é desempenhada pelos macrófagos do tecido residente. Para além de fagocitose de células mortas e material estranho, os macrófagos também podem sinalizar para outras células imunitárias através de citocinas. Em certa medida, os macrófagos desempenham a função crítica da apresentação do antigénio, trabalhando em conjunto com as células T para apoiar a imunidade adaptativa. Além disso, os macrófagos podem secretar citocinas como a IL-12 e desempenhar um papel nas respostas imunológicas locais, enquanto outros secretam grandes quantidades de IL-10, o que medeia o seu papel na reparação dos tecidos. Assim, os “grandes comedores” desempenham uma variedade de papéis no sistema imunológico, além da principal função da fagocitose.
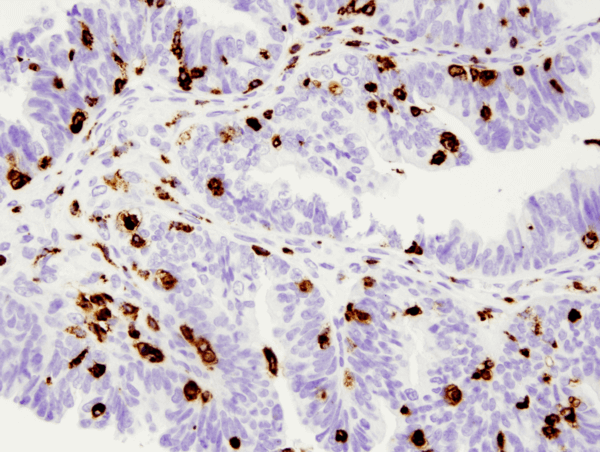
CD68 (D4B9C) XP® Rabbit mAb #76437: Análise IHC do carcinoma papilífero seroso humano do ovário com uso de parafina #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: Análise por IHC do carcinoma papilífero seroso humano do ovário, incluído em parafina, usando o número #76437.
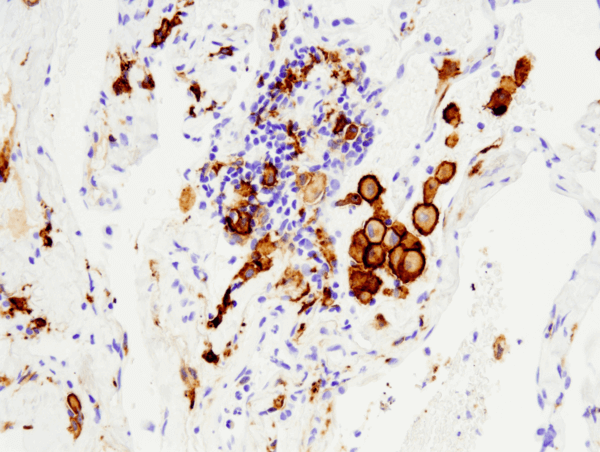
CD163 (D6U1J) Rabbit mAb #93498: Análise IHC do carcinoma pulmonar não pequeno em células humanas embebido em parafina usando o #93498 realizado no Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: Análise IHC de carcinoma pulmonar humano não de pequenas células embebido em parafina usando o #93498 realizado no Leica® Bond™ Rx.
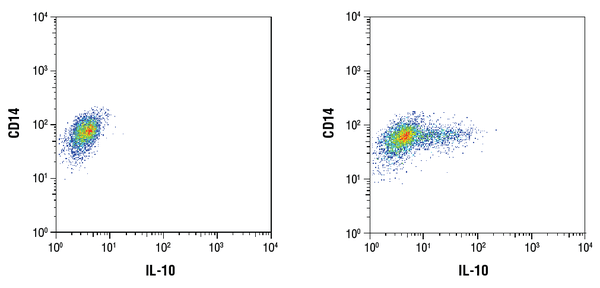
IL-10 (D13A11) XP® Rabbit mAb #12163: Análise citométrica de fluxo de células mononucleares do sangue periférico humano CD14+ purificadas sem tratamento (esquerda) ou tratadas com LPS (100ng/mL, 16 hr; direita) usando um anticorpo CD14 e #12163. Brefeldin A #9972 (300ng/mL) foi adicionado às células não tratadas e tratadas após 1 hora de estimulação do LPS. Foi utilizado como anticorpo secundário o fragmento #4414 (Alexa Fluor® 647 Conjugate) IgG (H+L), F(ab’)2 anti-coelho (H+L).
IL-10 (D13A11) XP® Coelho mAb #12163: Análise citométrica de fluxo de células mononucleares do sangue periférico humano CD14+ purificadas sem tratamento (esquerda) ou tratadas com LPS (100ng/mL, 16 hr; direita) usando um anticorpo CD14 e o #12163. Brefeldin A #9972 (300ng/mL) foi adicionado às células não tratadas e tratadas após 1 hora de estimulação do LPS. Foi utilizado como anticorpo secundário o fragmento #4414 (Alexa Fluor® 647 Conjugate) IgG (H+L), F(ab’)2 anti-coelho (H+L).
Células dendríticas
Semelhante aos macrófagos, as células dendríticas têm a capacidade de engolir material celular e estranho, mas ao invés de digeri-lo para remoção, as células dendríticas processam o material e o apresentam como antígeno para as células T. Como tal, as células dendríticas servem como células apresentadoras de antígenos, ou células acessórias, e assim retransmitem informações sobre patógenos entre o sistema imunológico inato e adaptativo. As células dendríticas recebem seu nome de suas distintas projeções celulares que alcançam e pegam material nocivo a ser digerido.
Progenitores de medula óssea hematopoiética, inicialmente as células dendríticas imaturas passam por uma fase de “aprendizagem”, na qual elas recolhem amostras da sua área local para material estranho e iniciam uma resposta de reconhecimento através de receptores de reconhecimento de padrões (um conjunto comum destes receptores são os receptores de pedágio). Essas células dendríticas imaturas podem residir em diferentes locais com acesso ao ambiente externo, como o revestimento do nariz, estômago, pulmões e até mesmo na pele. Após o reconhecimento do antígeno, as células dendríticas migrarão para o gânglio linfático onde treinarão as células T para reconhecer o antígeno e responder em conformidade. As células dendríticas são o único antígeno que apresenta células que ativam tanto a memória como as células T ingênuas. Os receptores tipo Toll-like são uma classe bem estudada de receptores presentes em macrófagos e células dendríticas, que medeiam o reconhecimento e a resposta a patógenos estranhos. Além de interagir diretamente com as células T, as células dendríticas também podem sinalizar através de citocinas como a IL-12, que atua para preparar o sistema imunológico para o ataque posterior ao material nocivo. Outros tipos de células dendríticas podem secretar citoquinas que sinalizam para recrutar mais macrófagos para limpar uma sobrecarga de material residual. Como principais mediadores celulares para a apresentação de antígenos, as células dendríticas desempenham assim um papel indispensável no crosstalk entre o sistema imunológico inato e adaptativo.
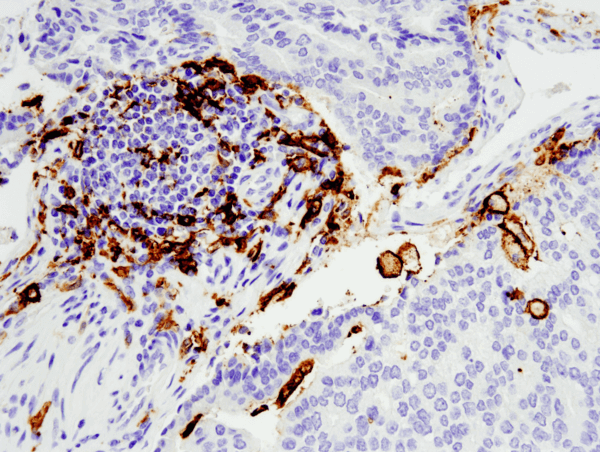
CD11c (D3V1E) XP® Rabbit mAb #45581: Análise IHC do adenocarcinoma de próstata humana incluído em parafina usando o número 455812 realizado no Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: Análise IHC do adenocarcinoma de próstata humana incluído em parafina usando o número 455812, realizada no Leica® Bond™ Rx.
Outras células imunitárias inatas e sinalização
Outras células do sistema imunitário inato incluem mastócitos, que funcionam na cicatrização de feridas e ajudam a fornecer uma protecção contra agentes patogénicos. Quando despoletados por um agente patogénico, os mastócitos podem segregar citocinas, bem como grânulos contendo histamina e heparina, que medeiam uma maior resposta imunitária, como o recrutamento de macrófagos e a dilatação dos vasos sanguíneos. Neutrófilos, eosinófilos e basófilos são referidos colectivamente como granulócitos devido aos grânulos característicos no seu citoplasma. Nos neutrófilos, os grânulos atuam para liberar compostos tóxicos que têm como alvo patógenos, como fungos e bactérias.
Imunologia em Saúde e Doença
Imunologia Cancro
O aproveitamento de células imunitárias para combater o cancro tornou-se um tema de investigação muito quente devido ao sucesso na clínica. Um foco recente da imunoterapia atual envolve o direcionamento das proteínas do ponto de controle de sinalização, como o PD-1, que normalmente previne a ativação e resposta das células T. A terapia celular adotiva é outra abordagem empolgante que envolve a imunodeficiência das células T colhidas do paciente. As células T são projetadas para expressar um receptor de antígeno quimérico específico que é específico para as células cancerosas do paciente. As células T são então reinfundidas no paciente e são agora programadas para procurar as células cancerosas e matá-las, de acordo com a função normal das células T. Estas e outras abordagens para manipular o sistema imunológico para atacar as células cancerosas nocivas do paciente representam uma classe revolucionária de terapias para tratar o câncer.