Tacos intracelulares, tais como danos no DNA da célula, conduzem a apoptose principalmente através do caminho intrínseco. A via intrínseca da apoptose, que envolve proteínas de sinalização conservadas, está fisicamente associada às mitocôndrias, e nos vertebrados é sensível ao stress oxidativo mitocondrial. A via é influenciada por membros da família Bcl ligados à membrana mitocondrial, incluindo os genes Bax e Bcl-2, que atuam como proteínas reguladoras pró ou anti-apoptóticas, respectivamente.
Visão da via intrínseca da apoptose
A via intrínseca da apoptose é iniciada, por exemplo, pela quimioterapia e/ou radioterapia. Ela é ativada por uma gama de estímulos exógenos e endógenos, como danos no DNA, isquemia e estresse oxidativo. Além disso, desempenha uma importante função no desenvolvimento e na eliminação de células danificadas.
Na via intrínseca, a consequência funcional da sinalização pró-apoptótica é a perturbação da membrana mitocondrial e a liberação do citocromo c no citoplasma, onde forma um complexo ou apoptossoma com fator ativador apoptótico da protease 1 (APAF1) e a forma inativa da caspase-9. Este complexo hidrolisa trifosfato de adenosina para clivar e ativar a caspase-9. O iniciador caspase-9 então cliva e ativa o executor caspases-3/6/7, resultando em apoptose celular. É totalmente diferente dos sinais extracelulares, que geralmente são gerados pelas células citotóxicas do sistema imunológico e disparam a apoptose principalmente através da via extrínseca.
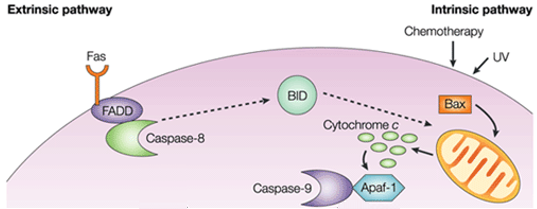
Figure 1. Diferença entre via extrínseca e via intrínseca.
Processo e regulação da via intrínseca da apoptose
A via intrínseca da apoptose induz a apoptose pela ativação direta da caspase-3 ou pela clivagem do lance (BH3 interagindo agonista da morte de domínio), resultando em disfunção mitocondrial e posterior liberação do citocromo c e ativação das caspases-9 e caspases-3. A caspase-3 promove as características típicas da apoptose, incluindo fragmentação de DNA e morte celular em vários tecidos.
A família de proteínas do linfoma de células B 2 (Bcl-2) controla firmemente a ativação da via intrínseca. É encontrada no linfoma folicular e primeiro identificada como um dos genes envolvidos na morte celular, ativando a apoptose pró-apoptótica ou inibindo a apoptose anti-apoptótica. As proteínas em um subgrupo, incluindo Bid, Bad, Bim, Bmf, Puma e Noxa, contêm um único domínio da homologia Bcl-2 (proteínas somente BH3) e têm atividade pró-apoptótica. Dois outros subconjuntos de proteínas têm múltiplos domínios de BH. O primeiro subconjunto, incluindo a proteína X associada à Bcl-2 (Bax), antagonista homólogo/assassino Bcl-2 (Bak) e regulador de apoptose da família Bcl-2 (Bok), é pró-apoptótico; o outro subconjunto, incluindo Bcl-2, Bcl-XL e Mcl-1, é anti-apoptótico. A via mitocondrial é parcialmente influenciada pelos membros da família Bcl ligados à membrana mitocondrial, incluindo as proteínas reguladoras pró-apoptóticas Bax e as proteínas reguladoras anti-apoptóticas Bcl-2.
As moléculas pró-apoptóticas causam permeabilização da membrana mitocondrial externa, levando ao efluxo do citocromo c, que liga o adaptador Apaf-1 e o iniciador caspase-9 no citosol para formar o complexo apoptossômico. Isto estimula a caspase-9, que por sua vez activa as caspases effector. A mitocôndria também libera uma proteína chamada Smac/DIABLO no citosol. Smac/DIABLO promove indiretamente a apoptose ao bloquear os efeitos de um grupo de proteínas anti-apoptóticas chamado inibidor das proteínas da apoptose (IAPs).
As proteínas anti-apoptóticas Bcl-2 e Bcl-XL inibem a liberação de citocromo c, enquanto Bax, Bak, e Bid, todas proteínas pró-apoptóticas, promovem sua liberação da mitocôndria. O citocromo c e a deoxiadenosina trifosfato (dATP) ligam-se à APAF-1 para formar um complexo multimérico que recruta e ativa a pró-caspase-9, uma protease de carrasco-mediante da apoptose que, por sua vez, ativa a cascata da caspase, resultando na apoptose celular. Durante este processo, a caspase-2, caspase-8, caspase-9 e caspase-10 estão envolvidas no início da apoptose. As caspase-3, caspase-6 e caspase-7 estão envolvidas na apoptose. A caspase-3 e a caspase-7 regulam a inibição da reparação do DNA e iniciam a degradação do DNA. Além disso, a caspase-6 regula a desintegração da lâmina e do citoesqueleto.
Passo de Apoptose Intrínseca em Fisiopatologia
Terapias quimioterápicas e dirigidas ao câncer matam células tumorais através da geração de sinal pró-morte que inicia o caminho apoptótico intrínseco da morte celular programada. O ponto de não retorno na cascata apoptótica é a permeabilização da membrana externa mitocondrial (MOMP); uma vez ocorrida, a permeabilização mitocondrial leva à formação de um apoptossoma, o que facilita a ativação da caspase e, posteriormente, desencadeia as outras marcas da morte das células apoptóticas. A decisão celular de iniciar a MOMP é controlada por um delicado equilíbrio entre as moléculas pró e anti-apoptóticas da família BCL-2.
Uma das razões para a resistência à quimioterapia é a falha das células tumorais em entrar em apoptose devido a defeitos na via apoptótica intrínseca (por exemplo, alterações na p53). Apesar das melhorias significativas no tratamento, as taxas de cura para muitos cancros continuam a ser subótimas. O aumento da quimioterapia citotóxica levou à terapia curativa para um subconjunto de cânceres, embora a resistência intrínseca ao tratamento seja difícil de prever para os pacientes individuais. A onda de terapias molecularmente direcionadas tem se concentrado em mutações ativadoras de fármacos e, portanto, está limitada a subconjuntos específicos de pacientes. A via mitocondrial intrínseca da apoptose representa um alvo promissor para novas terapias, e o direcionamento bem sucedido desta via tem o potencial de alterar o cenário terapêutico da terapia para uma variedade de cancros.