Objetivos de aprendizado
- Relatar as configurações eletrônicas dos elementos para a forma da tabela periódica.
- Determinar a configuração electrónica esperada de um elemento pelo seu lugar na tabela periódica.
No Capítulo 3 “Átomos, Moléculas e Iões”, introduzimos a tabela periódica como uma ferramenta para organizar os elementos químicos conhecidos. Uma tabela periódica é mostrada na Figura 8.11 “A Tabela Periódica”. Os elementos são listados por número atômico (o número de prótons no núcleo), e elementos com propriedades químicas similares são agrupados em colunas.
Figure 8.11 A Tabela Periódica
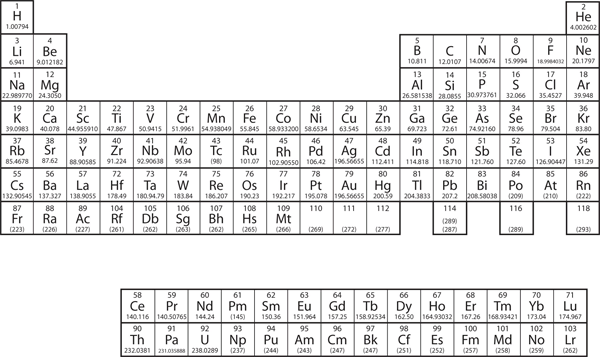
Por que a tabela periódica tem a estrutura que tem? A resposta é bastante simples, se você entender as configurações dos elétrons: a forma da tabela periódica imita o preenchimento das subcasas com elétrons.
Deixe-nos começar com H e He. Suas configurações de elétrons são 1s1 e 1s2, respectivamente; com He, o n = 1 shell é preenchido. Estes dois elementos compõem a primeira linha da tabela periódica (ver Figura 8.12 “O 1”).
Figure 8.12 A Subconcha 1s
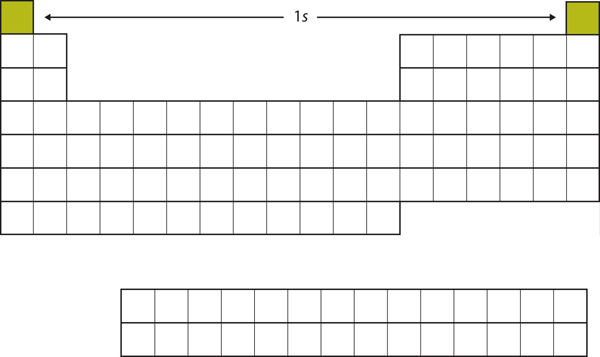
H e Ele representa o preenchimento da subconcha 1s.
Os dois electrões seguintes, para Li e Be, iriam para a subconcha 2s. Figura 8.13 “O 2” mostra que estes dois elementos são adjacentes na tabela periódica.
Figure 8.13 A Subconcha 2s
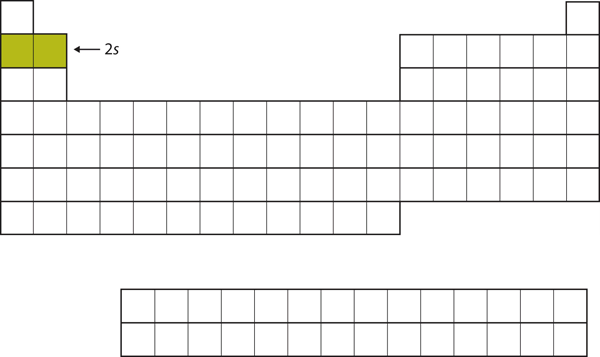
Em Li e Be, a subconcha 2s está sendo preenchida.
Para os próximos seis elementos, a subconcha 2p está sendo ocupada com elétrons. No lado direito da tabela periódica, estes seis elementos (B até Ne) estão agrupados (Figura 8.14 “O 2”).
Figure 8.14 A Subconcha 2p
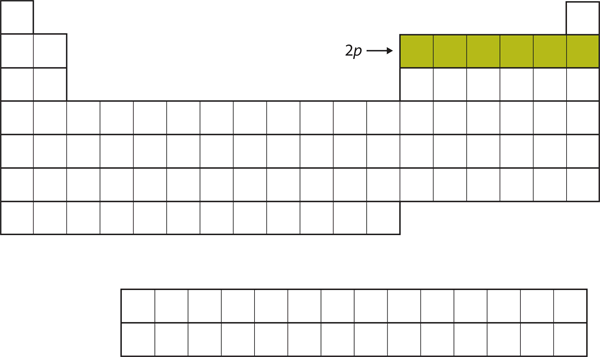
Para B até Ne, a subconcha 2p está sendo ocupada.
A próxima subconcha a ser preenchida é a subconcha 3s. Os elementos quando esta subesfera está sendo preenchida, Na e Mg, estão novamente do lado esquerdo da tabela periódica (Figura 8.15 “O 3”).
Figure 8.15 A subcasa 3s
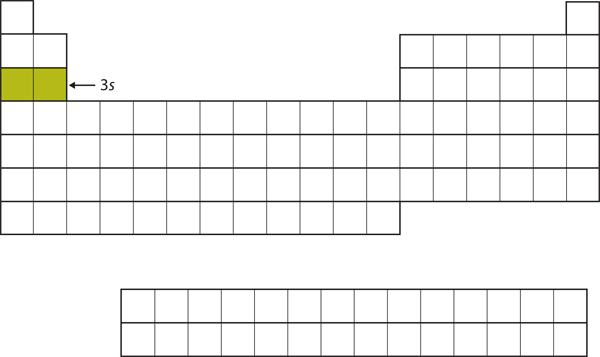
Agora a subcasa 3s está sendo ocupada.
Próximo, a subcasa 3p é preenchida com os seis elementos seguintes (Figura 8.16 “O 3”).
Figure 8.16 A Subconcha 3p
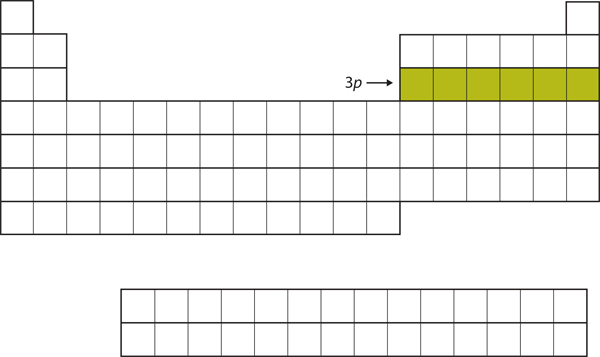
Próximo, a subconcha 3p é preenchida com electrões.
Em vez de preencher a subconcha 3d a seguir, os electrões vão para a subconcha 4s (Figura 8.17 “O 4”).
Figure 8.17 A Subconcha 4s
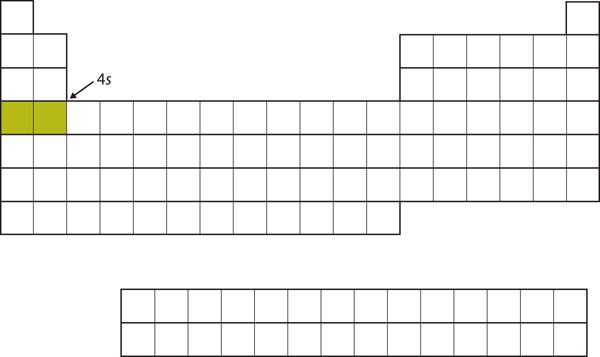
A subconcha 4s é preenchida antes da subconcha 3d. Isto se reflete na estrutura da tabela periódica.
Após o preenchimento da sub-camada 4s, a sub-camada 3d é preenchida com até 10 elétrons. Isto explica a seção de 10 elementos no meio da tabela periódica (Figura 8.18 “O 3”).
Figure 8.18 A Subconcha 3d
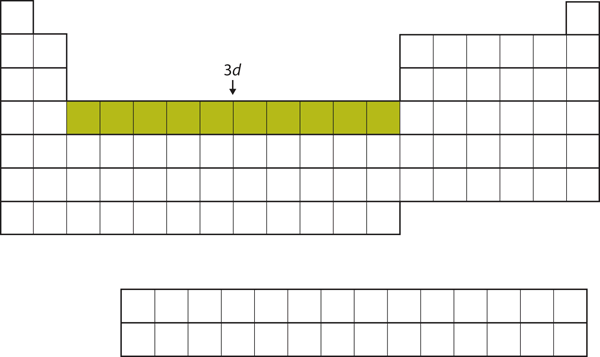
A Subconcha 3d é preenchida na seção do meio da tabela periódica.
E assim por diante. Conforme atravessamos as linhas da tabela periódica, a forma geral da tabela descreve como os elétrons estão ocupando as conchas e sub-conchas.
As duas primeiras colunas do lado esquerdo da tabela periódica são onde as sub-conchas estão sendo ocupadas. Por causa disso, as duas primeiras linhas da tabela periódica são etiquetadas como bloco s. Da mesma forma, o bloco p é a coluna da direita – mais seis colunas da tabela periódica, o bloco d é a coluna do meio da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é representada como destacada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e pesada. Figura 8.19 “Blocos na Tabela Periódica” mostra os blocos da tabela periódica.
Figure 8.19 Blocos na Tabela Periódica
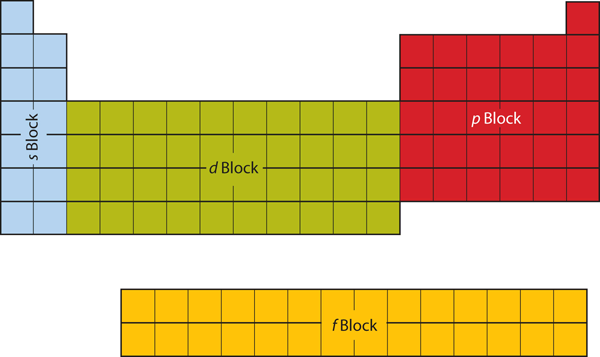
A tabela periódica é separada em blocos dependendo de qual subshell está sendo preenchida para os átomos que pertencem àquela seção.
Os elétrons na casca mais alta, mais quaisquer elétrons na última casca não preenchida, são chamados de elétrons de valência; a casca mais alta é chamada de casca de valência. (Os elétrons internos são chamados de elétrons de núcleo.) Os elétrons de valência controlam em grande parte a química de um átomo. Se olharmos apenas para a configuração electrónica da concha de valência, verificamos que em cada coluna, a configuração electrónica da concha de valência é a mesma. Por exemplo, pegue os elementos da primeira coluna da tabela periódica: H, Li, Na, K, Rb, e Cs. As suas configurações de electrões (abreviadas para os átomos maiores) são as seguintes, com a configuração de electrões da concha de valência realçada:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Todos eles têm uma configuração de electrões semelhante nas suas conchas de valência: um único electrão s. Como grande parte da química de um elemento é influenciada por electrões de valência, seria de esperar que esses elementos tivessem uma química semelhante – e eles têm. A organização dos elétrons em átomos explica não só a forma da tabela periódica, mas também o fato de que elementos na mesma coluna da tabela periódica têm química semelhante.
O mesmo conceito se aplica às outras colunas da tabela periódica. Os elementos em cada coluna têm as mesmas configurações de elétrons de concha de valência, e os elementos têm algumas propriedades químicas similares. Isto é estritamente verdadeiro para todos os elementos nos blocos s e p. Nos blocos d e f, porque existem exceções à ordem de preenchimento das sub-capas com elétrons, conchas de valência similares não são absolutas nestes blocos. No entanto, existem muitas semelhanças nestes blocos, pelo que se espera uma semelhança em propriedades químicas.
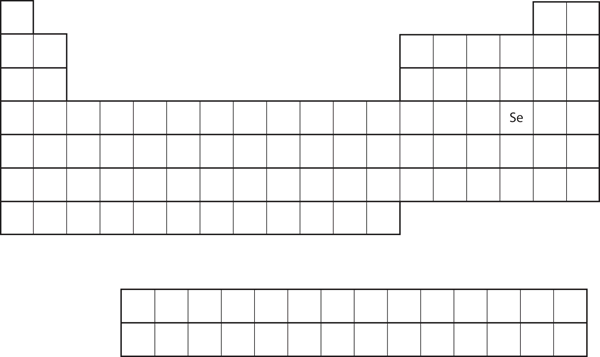
Similitude da configuração electrónica da concha de valência implica que podemos determinar a configuração electrónica de um átomo apenas pela sua posição na tabela periódica. Considere Se, como mostrado na Figura 8.20 “Selênio na Tabela Periódica”. Ela está na quarta coluna do bloco p. Isto significa que a sua configuração eletrônica deve terminar em uma configuração eletrônica p4. De fato, a configuração eletrônica de Se é 4s23d104p4, como esperado.
Figure 8.20 Selênio na Tabela Periódica
Exemplo 8
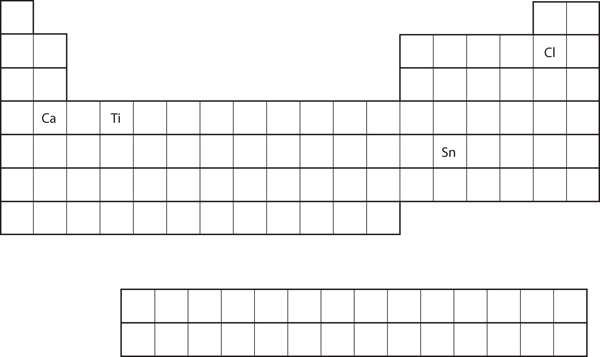
Da posição do elemento na tabela periódica, prever a configuração eletrônica da concha de valência para cada átomo. Ver Figura 8.21 “Vários Elementos da Tabela Periódica”.
- Ca
- Sn
Solução
- Ca está localizado na segunda coluna do bloco s. Seria de esperar que a sua configuração electrónica terminasse com s2. A configuração eletrônica do cálcio é 4s2.
- Sn está localizada na segunda coluna do bloco p, então esperamos que a sua configuração eletrônica termine em p2. A configuração eletrônica do Tin é 5s24d105p2.
Test Yourself
Da posição do elemento na tabela periódica, prever a configuração eletrônica da concha de valência para cada átomo. Ver Figura 8.21 “Vários Elementos na Tabela Periódica”.
- Ti
- Cl
Resposta
- 4s23d2
- 3s23p5
Figure 8.21 Vários Elementos da Tabela Periódica
Aplicação de Alimentos e Bebidas: Cores artificiais
A cor dos objectos vem de um mecanismo diferente das cores de néon e outras luzes de descarga. Embora as luzes coloridas produzam suas cores, os objetos são coloridos porque refletem preferencialmente uma certa cor da luz branca que brilha sobre eles. Um tomate vermelho, por exemplo, é vermelho brilhante porque reflete a luz vermelha enquanto absorve todas as outras cores do arco-íris.
Muitos alimentos, como os tomates, são altamente coloridos; de fato, a afirmação comum “você come com os olhos primeiro” é um reconhecimento implícito de que o apelo visual dos alimentos é tão importante quanto o seu sabor. Mas e os alimentos processados?
Muitos alimentos processados têm corantes alimentares adicionados a eles. Existem dois tipos de corantes alimentares: naturais e artificiais. Os corantes alimentares naturais incluem o açúcar caramelizado para o castanho; o urucum, o açafrão e o açafrão para vários tons de laranja ou amarelo; o betanina da beterraba para o púrpura; e até o carmim, um corante vermelho profundo que é extraído do cochonilha, um pequeno insecto que é um parasita nos cactos da América Central e do Sul. (Isso mesmo: você pode estar comendo suco de inseto!)
alguns corantes são artificiais. Nos Estados Unidos, a Food and Drug Administration atualmente aprova apenas sete compostos como corantes artificiais em alimentos, bebidas e cosméticos:
- FD&C Azul #1: Azul Brilhante FCF
- FD&C Azul #2: Indigotina
- FD&C Verde #3: Verde Rápido FCF
- RD&C Vermelho #3: Erythrosine
- FD&C Vermelho #40: Vermelho Allura AC
- FD&C Amarelo #5: Tartrazina
- FD&C Amarelo #6: Amarelo Pôr-do-sol FCF
>
>
Cores de menor numeração já não estão no mercado ou foram removidas por várias razões. Tipicamente, estes corantes artificiais são moléculas grandes que absorvem muito fortemente certas cores de luz, tornando-as úteis mesmo em concentrações muito baixas em alimentos e cosméticos. Mesmo em quantidades tão baixas, alguns críticos afirmam que uma pequena parcela da população (especialmente crianças) é sensível aos corantes artificiais e pedem que o seu uso seja restringido ou interrompido. No entanto, estudos formais sobre corantes artificiais e seus efeitos no comportamento têm sido inconclusivos ou contraditórios. Apesar disto, a maioria das pessoas continua a desfrutar de alimentos processados com corantes artificiais (como os mostrados na figura em anexo).

Os corantes alimentares artificiais encontram-se numa variedade de produtos alimentares, tais como alimentos processados, doces e corantes de ovos. Mesmo os alimentos para animais de estimação têm corantes alimentares artificiais, embora seja provável que o animal não se importe!
Source: Foto cortesia de Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- A disposição dos electrões nos átomos é responsável pela forma da tabela periódica.
- Configurações eléctricas podem ser previstas pela posição de um átomo na tabela periódica.
Exercícios
-
Onde na tabela periódica estão os subconjuntos dos elétrons sendo ocupados por elétrons?
-
Onde na tabela periódica há sub-cascas sendo ocupadas por elétrons?
-
Em que bloco é encontrado Ra?
-
Em que bloco é encontrado Br?
-
Quais são as configurações dos elétrons da casca de valência dos elementos na segunda coluna da tabela periódica?
-
Quais são as configurações dos elétrons do invólucro de valência dos elementos na última coluna da tabela periódica?
-
Quais são as configurações dos elétrons do invólucro de valência dos elementos na primeira coluna do bloco p?
-
Quais são as configurações dos elétrons do invólucro de valência dos elementos na última coluna do bloco p?
-
Da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) Sr
b) S
10. A partir da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) Fe
b) Ba
11. A partir da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) V
b) Ar
12. A partir da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) Cl
b) K
13. A partir da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) Ge
b) C
14. A partir da posição do elemento na tabela periódica, prever a configuração eletrônica de cada átomo.
a) Mg
b) I
Respostas
as duas primeiras colunas
o bloco s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2