Química da Água 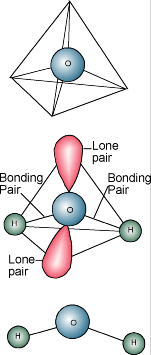 Você provavelmente sabe que a descrição química da água é H2O. Uma molécula da água consiste em um átomo de oxigénio ligado a dois átomos de hidrogénio. Os átomos de hidrogénio estão “ligados” a um lado do átomo de oxigénio, resultando numa molécula de água com uma carga positiva no lado onde estão os átomos de hidrogénio e uma carga negativa no outro lado, onde está o átomo de oxigénio. Como as cargas eléctricas opostas se atraem, as moléculas de água tendem a atrair umas às outras, tornando a água um pouco “pegajosa”. O lado com os átomos de hidrogênio (carga positiva) atrai o lado do oxigênio (carga negativa) de uma molécula de água diferente.
Você provavelmente sabe que a descrição química da água é H2O. Uma molécula da água consiste em um átomo de oxigénio ligado a dois átomos de hidrogénio. Os átomos de hidrogénio estão “ligados” a um lado do átomo de oxigénio, resultando numa molécula de água com uma carga positiva no lado onde estão os átomos de hidrogénio e uma carga negativa no outro lado, onde está o átomo de oxigénio. Como as cargas eléctricas opostas se atraem, as moléculas de água tendem a atrair umas às outras, tornando a água um pouco “pegajosa”. O lado com os átomos de hidrogênio (carga positiva) atrai o lado do oxigênio (carga negativa) de uma molécula de água diferente.
Todas estas moléculas de água atraem umas às outras, o que significa que elas tendem a aglomerar-se umas às outras. É por isso que as gotas de água são, na verdade, gotas! Se não fosse por algumas das forças da Terra, como a gravidade, uma gota de água teria a forma de uma bola — uma esfera perfeita. Mesmo que ela não forme uma esfera perfeita na Terra, nós deveríamos estar felizes por a água ser pegajosa.
A água é chamada de “solvente universal” porque ela dissolve mais substâncias do que qualquer outro líquido. Isto significa que onde quer que a água vá, seja através do solo ou através do nosso corpo, ela leva consigo químicos, minerais e nutrientes valiosos.
A água pura tem um pH neutro. A água pura tem um pH, de cerca de 7, que não é ácido nem básico.
Propriedades Físicas da Água:
A água é única na medida em que é a única substância natural que é encontrada nos três estados – líquido, sólido (gelo) e gás (vapor) – às temperaturas normalmente encontradas na Terra. A água da Terra está constantemente interagindo, mudando e em movimento.
 A água congela a 32° Fahrenheit (F) e ferve a 212° F. De fato, os pontos de congelamento e ebulição da água são a linha de base com a qual a temperatura é medida: 0° na escala Celsius é o ponto de congelamento da água, e 100° é o ponto de ebulição da água. A água é invulgar na medida em que a forma sólida, o gelo, é menos densa do que a forma líquida, e é por isso que o gelo flutua.
A água congela a 32° Fahrenheit (F) e ferve a 212° F. De fato, os pontos de congelamento e ebulição da água são a linha de base com a qual a temperatura é medida: 0° na escala Celsius é o ponto de congelamento da água, e 100° é o ponto de ebulição da água. A água é invulgar na medida em que a forma sólida, o gelo, é menos densa do que a forma líquida, e é por isso que o gelo flutua.
A água tem um alto índice de calor específico. Isto significa que a água pode absorver muito calor antes de começar a ficar quente. É por isso que a água é valiosa para as indústrias e no radiador do seu carro como um refrigerante. O alto índice de calor específico da água também ajuda a regular a taxa a que o ar muda de temperatura, razão pela qual a mudança de temperatura entre as estações é gradual e não repentina, especialmente perto dos oceanos.
A água tem uma tensão superficial muito alta. Em outras palavras, a água é pegajosa e elástica, e tende a se aglomerar em gotas ao invés de se espalhar em uma película fina. A tensão superficial é responsável pela ação capilar, que permite que a água (e suas substâncias dissolvidas) se mova através das raízes das plantas e através dos minúsculos vasos sanguíneos em nosso corpo.
Temperatura da água:
A temperatura da água é importante não só para os nadadores e pescadores, mas também para as indústrias e até mesmo para os peixes e algas. Muita água é utilizada para fins de refrigeração em centrais eléctricas que geram electricidade. Eles precisam de água fria para começar, e geralmente liberam água mais quente de volta para o meio ambiente. A temperatura da água libertada pode afectar os habitats a jusante. A temperatura também pode afetar a capacidade da água de reter oxigênio, bem como a capacidade dos organismos de resistir a certos poluentes.
pH:
pH é uma medida de quão ácida/básica é a água. O intervalo vai de 0 – 14, sendo 7 neutro. pHs inferiores a 7 indicam acidez, enquanto um pH superior a 7 indica uma base. pH é realmente uma medida da quantidade relativa de hidrogênio livre e íons hidroxila na água. A água que tem mais íons hidrogênio livres é ácida, enquanto que a água que tem mais íons hidroxila livres é básica. Como o pH pode ser afetado por produtos químicos na água, o pH é um indicador importante da água que está mudando quimicamente. O pH é relatado em “unidades logarítmicas”, como a escala Richter, que mede terremotos. Cada número representa uma mudança de 10 vezes na acidez/basicidade da água. Água com um pH de 5 é dez vezes mais ácida que água com um pH de 6,
Poluição pode alterar o pH de uma água, o que por sua vez pode prejudicar animais e plantas que vivem na água. Por exemplo, a água que sai de uma mina de carvão abandonada pode ter um pH de 2, o que é muito ácido e definitivamente afetaria qualquer peixe louco o suficiente para tentar viver nela! Usando a escala logarítmica, esta água de drenagem da mina seria 100.000 vezes mais ácida do que a água neutra – portanto, fique fora das minas abandonadas.
Condutância específica:
Condutância específica é uma medida da capacidade da água para conduzir uma corrente eléctrica. Ela é altamente dependente da quantidade de sólidos dissolvidos (como o sal) na água. Água pura, como água destilada, terá uma condutância específica muito baixa, e a água do mar terá uma condutância específica alta. A água da chuva frequentemente dissolve os gases e o pó transportado pelo ar enquanto está no ar e, portanto, muitas vezes tem uma condutância específica mais elevada do que a água destilada. A condutância específica é uma medida importante da qualidade da água porque dá uma boa idéia da quantidade de material dissolvido na água.
Provavelmente na escola você já fez a experiência onde ligou uma bateria a uma lâmpada e colocou dois fios da bateria em um copo de água. Quando os fios são colocados em um copo de água destilada, a luz não se acende. Mas, a lâmpada acende quando o copo contém água salgada (salina). Na água salina, o sal dissolveu-se, liberando elétrons livres, e a água conduzirá uma corrente elétrica.
Turbidez:
Turbidez é uma medida da turvação da água. É medida passando um feixe de luz através da água e vendo quanto é refletido das partículas na água. A turvação da água é causada por materiais, tais como sujidade e resíduos de folhas, que estão em suspensão (flutuantes) na água. A água cristalina, como o Lago Tahoe (onde se trabalha muito para evitar a lavagem dos sedimentos no lago) tem uma turbidez muito baixa. Mas olhe para um rio depois de uma tempestade – provavelmente é marrom. Você está vendo todo o solo em suspensão na água. Felizmente para nós, os materiais que causam turbidez na nossa água potável ou assentam ou são filtrados antes da água chegar ao nosso copo de beber em casa. A turbidez é medida em unidades de turbidez nefelométrica (NTU).
Oxigénio dissolvido:
Embora as moléculas da água contenham um átomo de oxigénio, este oxigénio não é o necessário para os organismos aquáticos que vivem nas nossas águas naturais. Uma pequena quantidade de oxigénio, até cerca de dez moléculas de oxigénio por milhão de água, é na verdade dissolvida na água. Este oxigênio dissolvido é respirado por peixes e zooplâncton e é necessário por eles para sobreviver.
Água em movimento rápido, como em um riacho de montanha ou grande rio, tende a conter muito oxigênio dissolvido, enquanto a água estagnada contém pouco. O processo onde as bactérias na água ajudam a matéria orgânica, como aquela que vem de uma estação de tratamento de esgoto, a decomposição consome oxigênio. Assim, o excesso de matéria orgânica nos nossos lagos e rios pode causar uma situação de carência de oxigénio. A vida aquática pode ter dificuldades na água estagnada que tem muita matéria orgânica em decomposição, especialmente no verão, quando os níveis de oxigénio dissolvido estão em baixa sazonal.
Dureza:
A quantidade de cálcio e magnésio dissolvidos na água determina a sua “dureza”. A dureza da água varia nos Estados Unidos. Se você vive em uma área onde a água é “macia”, então você pode nunca ter ouvido falar em dureza da água. Mas, se você vive na Flórida, Novo México, Arizona, Utah, Wyoming, Nebraska, Dakota do Sul, Iowa, Wisconsin ou Indiana, onde a água é relativamente dura, você pode notar que é difícil fazer espuma ao lavar as mãos ou as roupas. E, indústrias na sua área podem ter que gastar dinheiro para amaciar a água, pois a água dura pode danificar equipamentos. A água dura pode até encurtar a vida útil dos tecidos e das roupas! Isso significa que os alunos que vivem em áreas com água dura acompanham as últimas modas, já que suas roupas se desgastam mais rápido?
Sedimento Suspenso:
Sedimento Suspenso é a quantidade de terra que se move ao longo de um riacho. É altamente dependente da velocidade do fluxo de água, pois a água de fluxo rápido pode pegar e suspender mais terra do que a água calma. Durante as tempestades, o solo é lavado das margens do riacho para o riacho. A quantidade que é lavada em um riacho depende do tipo de terra na bacia de drenagem do rio e da vegetação ao redor do rio.
Se a terra é perturbada ao longo de um riacho e medidas de proteção não são tomadas, então o excesso de sedimentos pode prejudicar a qualidade da água de um riacho. Você provavelmente já viu aquelas pequenas cercas de plástico que os construtores colocam nas margens da propriedade que eles estão desenvolvendo. Essas cercas de lodo são supostamente para aprisionar o sedimento durante uma tempestade e evitar que ele se lave em um riacho, pois o excesso de sedimento pode prejudicar os riachos, rios, lagos e reservatórios.
Sedimento que entra em um reservatório é sempre uma preocupação; uma vez que entra não pode sair – a maior parte vai se instalar no fundo. Reservatórios podem “assorear” se muitos sedimentos entrarem neles. O volume do reservatório é reduzido, resultando em menos área para navegação, pesca e recreação, além de reduzir a capacidade de geração de energia da usina na represa.
Solução aquosa Geoquímica:
Vejam um diagrama do ciclo hidrogeoquímico.
- Ácido = substância que contém hidrogénio que produz hidrogénio livre (H + ) quando dissolvido em água
- Base = substância que contém o grupo OH que produz hidrogénio livre (OH – ) quando dissolvido em água
-
Uma solução ácida é aquela que contém um excesso de H + livre, e uma base é aquela que contém um excesso de OH livre – . Uma reacção entre um ácido e uma base é normalmente chamada neutralização.
Por exemplo:
-
HCl (ácido) + NaOH (base) ==> H 2 O + NaCl
que estão dissociados em iões:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + + Cl – - i.e. Na + e Cl – não são afectados.
- pH = registo inverso da concentração (actividade) de H + livre, ou pH = -log
-
A água dissocia-se em H + e OH – ;
-
a constante de dissociação é: K água = = =10 -14
- Assim tem de haver 10 -7 moles cada um de H+ e OH – num quilograma de solução neutra à temperatura padrão de 25°C. Uma molécula é 6,023 x 10 23 átomos (ou moléculas) e H 2 O tem um peso molecular de 18 gramas por molécula. Um quilograma de água tem cerca de 1000/18 = 55,6 moles de água ou cerca de 3,35 x 10 25 átomos de oxigénio e cerca do dobro desse número (6,7 x 10 25 átomos) de H + (a quantidade de H + livre ou OH livre – é relativamente pequena em comparação com a quantidade de H 2 O não dissociado).
- pH varia a 25°C de 0 a 14; pH < 7 = solução ácida; pH > 7 = solução básica. Se for adicionado HCl ou outro ácido então o pH diminui; se NaOH ou outra base for adicionado então o pH aumenta.
- pH aumenta à medida que o ácido carbónico (um ácido fraco) se dissocia: Quando o dióxido de carbono se combina com a água, como o que acontece na atmosfera quando combustíveis fósseis são queimados, o ácido carbónico forma-se: H 2 O + CO 2 ===> H 2 CO 3 . O H + livre é disponibilizado durante as sucessivas dissociações:
-
H 2 CO 3 ==> H + + HCO 3- ácido carbónico a bicarbonato, ocorre a pH ~6,4
-
HCO 3 ==> H + + CO 32- bicarbonato a carbonato, ocorre a pH ~10.3
Lembre-se, H + livre só está disponível quando ácido, ou quando pH < ~7. A dissociação de bicarbonato a carbonato ocorre quando há muito OH – no sistema e H + é “liberado” para equilibrar a base.
- Cátions e ânions dissolvidos na água
Cátions = doadores de elétrons, carregados positivamente: Na + , K + , Mg ++ , Ca ++ , Fe ++ ou Fe +++ , Mn ++ , Al ++++
Aniões = Aceitadores de elétrons, carregados negativamente: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metais = agem como cátions principalmente: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, etc.
- Análise da água – Necessidade de ter equilíbrio catião-anião
millequivalente (MEQ) = carga mole equivalente ou ânion ou catião, medida da carga total devido ao íon em questão dissolvido na solução. Iniciar com concentração, dividir por mole wt., multiplicar por carga: XX mg/L / MW x CHG = MEQ
Exemplo: NaCl em solução, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Assim, se o catião total e os MEQs de aniões não estiverem equilibrados, existe algum erro na análise.