Inscrito aceito em :29 Ago 19
Publicado online em: 18-09-2019 Verificação de Plágio: Sim
Revisado por: Farooq Sher
Segunda revisão por: Grigorios Kyriakopoulos
Aprovação final por: Grigorios Kyriakopoulos
Aprovação final por: Ayush Dogra
Como fechar a publicação | Histórico da publicação
Vijitra Luang-In1* , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 e Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 e Kedsukon Maneewan1
1Natural Antioxidant Innovation Research Unit, Departamento de Biotecnologia, Faculdade de Tecnologia, Universidade de Mahasarakham, Khamriang, Kantarawichai, Maha Sarakham, 44150, Tailândia.
2International College of Digital Innovation, Universidade de Chiang Mai, Chiang Mai 50200, Tailândia.
Autor correspondente E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
Este estudo teve como objectivo isolar e identificar bactérias que possam produzir a enzima amilase da floresta inexplorada de Nasinuan, Distrito de Kantarawichai, Província de Mahasarakham, Tailândia. Treze isolados bacterianos com capacidade de produção de amilase em ágar amílico a 1% foram identificados usando o sequenciamento de 16S rRNA. Doze bactérias foram gram-positivas, em forma de haste e identificadas como Bacillus spp. e uma bactéria com caráter gram-negativo e em forma de haste foi Enterobacter cloacae. Os seus familiares mais próximos foram encontrados na Índia, China, Coreia, Indonésia, Argentina, Itália, Israel, EUA, Argentina e África do Sul. Estas bactérias foram testadas para a actividade específica da amilase após 1-3 dias de indução enzimática com 1% de amido a 37°C. Os resultados mostraram a maior atividade específica no segundo dia de incubação na ordem: Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3 e assim a indução enzimática de 2 dias foi escolhida para uma análise mais aprofundada. Bacillus sp. 3.5AL2 apresentou a maior atividade enzimática amilase específica de 1,97 ± 0,41 U/mg de proteína nas condições ideais de 60°C e pH 7,0 após 30 min de incubação com 1% de amido em tampão 0,05 M PBS. Esta estirpe bacteriana produtora de amilase oferece grande potencial para aplicações em indústrias alimentícias e agrícolas na Tailândia.
Palavras-chave
Amilase; Bactérias; Floresta Nasinuana; solo
Download este artigo como:![]()
Copiar o seguinte para citar este artigo:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3).
Copiar o seguinte para citar esta URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolamento e Identificação de Bactérias Produtoras de Amila do Solo na Floresta da Comunidade de Nasinuan, Maha Sarakham, Tailândia. Biomed Pharmacol J 2019;12(3). Disponível em: http://biomedpharmajournal.org/?p=28497
Introdução
As amilases hidrolíticas do amido (α-amilase, β-amilase e glucoamilase) são uma das enzimas mais utilizadas na biotecnologia atual. As glucoamilases (1,4-α-D-glucan glucanoidrolase; EC 3.2.1.3) ou amiloglucosidases, são amilases exo-activas que produzem glicose a partir da extremidade não redutora do amido e dos oligossacarídeos correspondentes. As glucoamilases são implementadas comercialmente para a transformação de malto-oligossacarídeos em glicose1. Embora as amilases sejam produzidas a partir de diferentes fontes (microorganismos, plantas e animais), as amilases de micróbios são mais adequadas para a produção industrial devido ao curto período de crescimento microbiano, produção de baixo custo efetivo, comportamento ecologicamente correto, menos problemas de manuseio para os trabalhadores, produtividade2 e fácil manipulação dos genes bacterianos3. Bactérias e fungos tendem a secretar amilases fora das células para realizar a digestão extracelular do amido em açúcares. O aumento da demanda industrial por amilases microbianas tem sido observado devido à sua especificidade de reação, condições suaves pré-requisito para a reação e menor consumo de energia que os métodos químicos convencionais não enzimáticos.
A aplicação extensiva de amilase em alimentos, liquefação de amido, sacarificação, indústria cervejeira, detergente, papel, têxtil e destilaria, tem despertado uma maior atenção para o aumento da produção indígena de α-amilase4. O Bacillus é uma fonte bacteriana comum para a produção de amilase industrial. No entanto, diferentes cepas têm diferentes condições óptimas de crescimento e perfil de produção enzimática. Alegadamente, as cepas de Bacillus têm sido amplamente utilizadas industrialmente para produzir α-amilase incluindo B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8 e B. circulans9.
Até a data, um número de bactérias produtoras de amilase tem sido documentado, entretanto, nenhum estudo sobre bactérias produtoras de amilase do solo na Floresta Comunitária de Nasinuan, Distrito de Kantharawichai, Província de Mahasarakham, Tailândia tem sido relatado. Esta floresta parece ser rica em biodiversidade microbiana que pode ser útil na produção de enzimas industriais, incluindo a amilase. Este é o primeiro relatório a identificar bactérias produtoras de amilase isoladas da Floresta de Nasinuan. Essas amilases bacterianas podem ser aplicadas localmente em várias indústrias, incluindo celulose e papel, têxtil, bioetanol, cervejaria, processamento de alimentos, ração animal e agricultura na Tailândia no futuro.
Materiais e Métodos
Amostras de solo
Amostras de solo foram coletadas aleatoriamente abaixo da superfície do solo 15 cm e mantidas em sacos de poliestireno da Floresta Comunitária de Nasinuan, Distrito de Kantarawichai, Província de Mahasarakham, Tailândia (área de 9.6 hectares; coordenada de 16.340941, 103.210799).
Isolamento de bactérias produtoras de amilase
Amostras de solo (10 g) foram suspensas em 90 mL de solução estéril de NaCl 0,85%. As suspensões (100 µL) de diluições em série foram espalhadas em ágar de amido (g/L); 3,0 extrato de carne, 10,0 amido solúvel, 15,0 ágar pH 7,0 e incubado a 37 ºC por 7 dias. Em seguida, as placas foram inundadas com iodo de Gram. Quaisquer colônias com formação de zona clara ao redor das colônias foram subcultivadas em caldo líquido e estriadas pelo menos cinco vezes para obter isolados puros, como confirmado pela coloração de Gram e observação microscópica de 1000X de luz. Os isolados puros foram inoculados em ágar de amido e incubados a 37°C durante 7 dias. Os diâmetros das zonas claras sobre os diâmetros das colónias foram medidos usando uma régua como a razão Halo : Colónia.
16S rRNA sequenciamento do gene e análise filogenética
Isolados bacterianos puros foram identificados usando DNAs genómicos obtidos a partir do método acima descrito e primers universais: primer forward 27F 5′-GAGAGTTTGATYCTGGCTCAG-3′ e primer inverso 1492R 5’AAGGAGGTGATCCARCCGCA -3′. Em 25 µL de mistura PCR, foi composta por ADN genómico 0,5 ng, 2X Master Mix (Uma PCR) de 100 mM Tris-HCl (pH 9,1), 0,1% TritonTMX-100, 200 mM dNTP, 1,5 mM MgCl2, 0,005 U Taq DNA Polimerase e 0,2 µM primer para a frente e para trás com ajuste de volume com água sem núcleo. O termociclador PCR (Thermo Scientific Hybaid Px2) foi programado da seguinte forma: (1) desnaturação inicial durante 2 min a 94 ºC durante 1 ciclo; (2) desnaturação a 94 ºC durante 45 s; recozimento a 54 ºC durante 45 s, e extensão a 72 ºC durante 1 min durante 32 ciclos; (3) extensão final a 72 ºC durante 7 min. As amostras foram mantidas a 4 ºC até análise posterior. Os produtos PCR de 16S rRNAs (~ 1.500 bp) foram detectados em gel de agarose a 0,8%, purificado usando o kit de purificação do produto PCR (Vivantis, Malásia), enviado para a First Base Co. Ltd. (Malásia), para sequenciamento de ADN. As seqüências de rRNA 16S foram então comparadas com outras disponíveis no GenBank usando o programa BLASTN (Basic Local Alignment Search Tools)10. A árvore filogenética foi construída usando o método Muscle para alinhamento de sequências e o método de máxima verosimilhança usando MEGA X com 1.000 réplicas de valores bootstrap11. Todas as 16 sequências parciais de rRNA dos nossos isolados produtores de amilase foram depositadas no banco de dados NCBI.
Determinação da atividade da enzima amilase
O método seguiu Bhaskara et al. (2011)12. As três bactérias com maior Halo: Razões de colônia foram escolhidas para a determinação da atividade da enzima amilase. Cada isolado foi subcultivado em caldo líquido de amido (g/L): 10,0 amido solúvel, 10,0 peptona, 20,0 extrato de levedura, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O e incubado a 37 ºC, 150 rpm durante 1, 2 e 3 dias. O sobrenadante claro (enzima amilase extracelular bruta) foi obtido após centrifugação a 10.000g durante 15 min a 4 ºC. O extrato bruto foi concentrado usando o concentrador de proteína ultracentrifugadora MWCO 10 kDa (Vivaspin, Sartorius, UK).
O método DNS13 foi usado para determinar a atividade de amilase de cada isolado bacteriano em cada dia de indução enzimática. Um mL de enzima bruta foi misturado com 1 mL de solução de amido a 1% em 1 mL de tampão fosfato de sódio 0,05 M pH 7,0. As amostras foram incubadas a 37°C durante 30 min. Após a incubação, foi adicionado 0,5 mL de solução de DNS a cada amostra para parar a reacção e depois fervida a 100°C durante 5 min. no banho de água. A intensidade da cor da solução foi observada através da medição da densidade óptica (DO) utilizando um espectrofotómetro a 575 nm. A leitura foi comparada com uma solução preparada em branco (sem enzima bruta). Os valores de DO das amostras a T30min foram subtraídos dos das amostras a T0min, uma vez que a glucose ainda permaneceu nas amostras T0min após o processo de indução enzimática a 1, 2, 3 dias. O processo foi realizado em triplicatas. A concentração de glicose produzida para cada solução foi obtida a partir da curva padrão de glicose. A atividade da amilase foi calculada. Uma unidade de atividade da amilase é definida como a quantidade de amilase necessária para catalisar a formação de açúcar redutor que é igual a 1 µmol de glicose por minuto em condições de ensaio14,
A enzima bruta do isolado bacteriano com a maior atividade foi escolhida para trabalhos posteriores.
Para determinar a atividade enzimática específica dos isolados selecionados, foi utilizado o método Folin-Lowry para a estimativa da proteína total15. A atividade enzimática específica foi medida usando a seguinte fórmula.
Atividade específica (U/mg) = Atividade enzimática (U/ml)/ Concentração de proteína extracelular (mg/ml)
pH ideal e temperatura da atividade da enzima amilase
Solúveis soluções de amido (1%) em diferentes pH de 3 a 10 foram testadas. Um mL de solução de substrato diferente a 1% foi adicionado junto com 1 mL dos respectivos tampões; tampão citrato 0,05 M (pH 3 a 5), tampão fosfato de sódio 0,05 M (pH 6 e 7), Tris-HCl 0,05 M (pH 8 e 9) e NaOH glicina 0,05 M (pH 10). Um mL de enzima bruta foi adicionado a estes tampões também. As amostras foram incubadas a 37°C durante 30 min. A atividade específica da amilase foi calculada. O pH no qual a maior atividade foi observada foi observado. Da mesma forma, diferentes soluções de substrato foram feitas dissolvendo 1% de amido solúvel em soluções de pH 7,0 Um mL de 1% de amido solúvel foi adicionado junto com 1 mL de tampão fosfato de sódio 0,05 M (pH 7). Um mL de enzima bruta também foi adicionado aos tampões. As amostras foram incubadas a 20, 30, 40, 50, 60, 70, e 80°C durante 30 min. A atividade específica da amilase foi calculada. A temperatura em que foi observada a maior atividade foi notada. Tanto o pH quanto a temperatura ótima foram usados para determinar a atividade enzimática amilase específica final.
Análise estatística
Análise de variância de uma via (One-way ANOVA) foi usada com o teste Duncan Multiple Range’s Test on SPSS Statistics Ver. 17.0. Os resultados foram expressos como média ± DP com diferença estatística quando p < 0,05.
Resultados
Isolamento de bactérias produtoras de amila
Neste estudo, 13 isolados amilás-positivos mostraram zonas claras em ágar de amila a 1% com diferentes proporções de Halo : Colônia. As colônias mostrando zonas claras de solução de iodo foram tomadas como colônias bacterianas com decomposição positiva de amido. Todos os isolados bacterianos mostraram morfologias semelhantes nas colónias e apareceram como bactérias Gram-positivas e em forma de bastão (Tabela 1). O resultado mostrou rácios de Halo: colónias variando entre 1,18 e 1,71 (Quadro 1). Os isolados bacterianos foram então utilizados para determinar a duração ótima da indução enzimática amilase e apenas os 3 isolados com atividades específicas mais elevadas foram mostrados em 3,4.
Identificação da estirpe de bactérias produtoras de amilase
Todas as 13 estirpes bacterianas amilase positivas foram submetidas a 16S rRNA seqüenciamento do gene para identificação da estirpe. Os resultados de BLAST mostraram que todos os isolados amilás-positivos pertencem ao gênero Bacillus, exceto um isolado pertencente a Enterobacter (Tabela 2). Seus parentes mais próximos foram encontrados na Índia, China, Coréia, Indonésia, Argentina, Itália, Israel, EUA, Argentina e África do Sul com uma faixa de 96-100% de identidade.
Análise filogenética
A árvore filogenética de 13 cepas bacterianas amilase positivas e 2 cepas de referência com enzimas amilase putativas usando MEGA 7.0 mostrou que E. cloacae 2.1AL2 foi evolutivamente diferente das outras cepas de Bacillus (Fig. 1). B. thuringiensis serovar konkukian (NCBI accession no. AB617494.1) estirpe de referência evoluiu diferentemente da nossa bactéria Bacillus. Entretanto, outra estirpe de referência B. cereus ATCC 14579 (NCBI accession no. MG708176.1) isolada da folha de açafroa, Eqypt mostrou evolução similar à nossa bactéria (Fig. 1).
 |
Quadro 1: Características e Halo : Razões de colónia de 13 estirpes bacterianas produtoras de amilase
Clique aqui para Ver tabela |
Duração da indução enzimática amilase ideal
Foram mostrados que a duração da incubação que induziu a produção de amilase com a maior actividade específica foi de 2-3 dias entre todos os 3 isolados sem diferenças estatísticas. Bacillus sp. 3.5AL2 parecia produzir a maior atividade específica a 0,91 ± 0,12 U/mg no dia 2 a 37°C (Tabela 3). Assim, esta estirpe e esta condição foi utilizada para induzir a produção de amilase para análise posterior.
Optimal pH e temperatura da atividade da enzima amilase
Bacillus sp. 3.5AL2 mostrou a maior atividade específica a pH 7,0 quando 37°C foi fixado e a 60°C quando pH 7,0 foi fixado (Fig. 2). Assim, ambas as condições ótimas foram utilizadas para determinar a atividade específica da amilase e 1,97 ± 0,41 U/mg (Tabela 4) foi obtido.
Tabela 2: Treze linhagens bacterianas amilase positivas identificadas pela análise do rRNA 16S
| Isolado | Adesão
não. a |
Closest relativeb | Acesso no.c | % Identidade | |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, China |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilms, Argentina |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Solo, República da Coreia |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | Sedimento marinho, EUA |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Grão de trigo, Isarael |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Brião aviário, China |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Sistema radicular da videira, Itália |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Água da área industrial, Indonésia |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Papaya mealybug gut, Índia |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | Índia |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Rizospere de trigo, Índia |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Terra da rizosfera, Índia |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Esponja marinha, África do Sul |
aGenBank adesão no. das nossas estirpes depositadas no site do NCBI (http://www.ncbi.nlm.nih.gov/pubmed)
bEspécies com maior % de identidade e maior pontuação máxima na pesquisa BLAST
cGenBank no. de estirpes relativas mais próximas no site do NCBI
dBaseado nos resultados da pesquisa BLAST, identidade (%) das estirpes em comparação com os
parentes mais próximos.
eBaseado nos resultados da pesquisa BLAST, origem dos parentes mais próximos.
 |
Figura 1: Árvore filogenética de 13 linhagens de bactérias amilase positivas e 2 linhagens de referência de Bacillus
Click here to View figure |
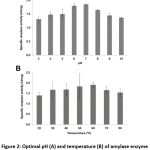 |
Figura 2: pH (A) e temperatura (B) óptimos da actividade da enzima amilase de Bacillus sp. 3.5AL2
Clique aqui para Ver figura |
Tabela 3: Duração ótima da indução enzimática amilase
|
Isolado |
Amilase específica atividade
(U/mg proteína) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0,21 ± 0,04Ab | 0,40 ± 0,04Ca | 0,41 ± 0,04Ba |
| B. cereus 2.3AL8 | 0.45 ± 0.06Ab | 0.62 ± 0.04Ba | 0.65 ± 0.06Aa |
| Bacillus sp. 3.5AL2 | 0,32 ± 0,11Ab | 0,91 ± 0,12Aa | 0,86 ± 0,11Aa |
Valores são meios ± SD em triplicado.
Capital e letras pequenas indicam diferenças estatísticas (p < 0,05) na coluna e linha, respectivamente.
Tabela 4: Actividade específica da enzima amilase no pH e temperatura óptimos
| Tensão | Actividade (U/mg) | Tempo óptimo. (°C) | PH ideal |
| Bacillus sp. 3.5AL2 | 1.97 ± 0.41 | 60 | 7.0 |
Discussão
Dados da alfândega tailandesa (2017) mostraram que a Tailândia importou enzimas industriais de outros países com o valor de 2.625 milhões de bahts em 2016 e a taxa de importação foi aumentada em 9,40% por ano. Uma das enzimas mais usadas na Tailândia, a amilase, tem sido aplicada nas indústrias de vestuário, têxtil e alimentar. No entanto, há uma falta de produção local de amilase comercial e, portanto, este trabalho visava isolar as bactérias do solo da floresta local com a capacidade de produzir amilase para usos industriais.
Resíduos ricos em amido podem ser uma melhor fonte potencial onde bactérias amilase positivas podem ser isoladas16. Além disso, estas podem ser isoladas de locais como fazendas de mandioca, solo e fábricas de farinha de processamento17. Neste trabalho, 13 bactérias produtoras de amilase foram isoladas e identificadas como Bacillus spp. e Enterobacter sp. que é similar aos relatórios anteriores18, 19, 20 onde Bacillus spp. foram encontradas principalmente como produtoras de amilase.
Nossos resultados mostraram que Bacillus sp. 3.5AL2, o isolado com a maior atividade específica entre 13 isolados, produziu a maior atividade específica a 0,91 ± 0,12 U/mg em 2 dias de incubação a 37°C. O pH e a temperatura óptimos para a actividade de amilase foram de 7,0 e 60°C, respectivamente. Ambas as condições ótimas deram a atividade específica de amilase do Bacillus sp. 3,5AL2 de 1,97 ± 0,41 U/mg. Sabe-se que as enzimas que podem trabalhar a altas temperaturas são consideradas como tendo uma vantagem em processos industriais como a liquefação de amido21. Assim, amilase de Bacillus sp. 3.5AL2 tem um uso potencial em tais indústrias.
Similiarmente, Bacillus sp. GM890 mostrou a temperatura ótima para amilase a 60°C20, Bacillus licheniformis AI20 mostrou a maior atividade entre a faixa de 60-80°C22 e Bacillus sp. WA21 teve uma temperatura ótima mais baixa de 55°C para amilase19,
A maior parte do amido – estirpe bacteriana degradante revelou uma faixa de pH entre 6,0 e 7,0 para crescimento normal e atividade enzimática4. Da mesma forma, neste trabalho, Bacillus sp. 3.5AL2 teve um pH ótimo a 7.0 que não requer qualquer adição de ácido ou álcali. Nosso achado foi de acordo com Bacillus sp. isolado dos resíduos da indústria dhal exibindo uma temperatura ótima de 60°C23 e B. amyloliquefaciens com um pH ótimo de 7,024. No entanto, Bacillus sp. WA21 mostrou o pH ótimo da amilase a 6,0 que é menor que o encontrado neste estudo19,
Este tipo de estudo é muito importante para o ponto de partida da produção comercial de amilase na Tailândia. No entanto, uma investigação adicional é essencial para tornar a produção de amilase rentável. Existe a necessidade de uma caracterização completa das enzimas, determinação da termoestabilidade, estabilidade do pH, influência de diferentes íons metálicos e diferentes substratos, especialmente resíduos agrícolas na Tailândia, e suas concentrações.
Após a obtenção de todos os dados necessários como mencionado acima, pensa-se que a produção de amilase comercial nas indústrias de enzimas na Tailândia será crescente e difundida em todas as regiões e, por sua vez, estará beneficiando a economia do país devido à auto-suficiência em seus próprios recursos para produzir a enzima amilase.
Conclusão
Este é o primeiro relatório de identificação de 13 isolados bacterianos produtores de amilase do solo na Floresta Comunitária de Nasinuan, Maha Sarakham. Todas as bactérias foram identificadas como Bacillus spp. com exceção de uma do gênero Enterobacter. Estas bactérias podem ser usadas para a produção de amilase e aplicadas local e nacionalmente na agricultura, processamento de alimentos e indústrias têxteis no futuro. Assim, isto irá reduzir o custo da importação de enzimas industriais de outros países, oferecer sustentabilidade da produção local de enzimas e melhorar a economia da nação.
Conflito de Interesses
Autores declaram não haver conflito de interesses.
- Pandey A. Glucoamylase research: Uma visão geral. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A., e Osman G. Propriedades enzimáticas de uma nova amilase termoestável, termofílica, alcalina e resistente a quelantes de um Bacillus alcalifílico isolado ANT-6. Biochem de processo. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., e Rai, V.A. Vista mais ampla: Enzimas microbianas e sua relevância nas indústrias, medicina e mais além. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., e Chauhan B. Microbial α-amilases: uma perspectiva biotecnológica. Processo Biochem. 38:1599-1616 (2003).
- Takasaki Y. Uma amilase produzindo maltotetrose e maltopentose a partir de circulantes. Agric Biol Química. 47:2193-2199 (1983).
- Fogarty W.M., e Kelly C.T. Amilase, amiloglucosidase e glucanases relacionadas. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- R.D. eólica, Buitelaar R.M.G., Huizing H.J., e Dijkhuizen L. Caracterização de um novo isolado Bacillus stearothermophilus: uma estirpe altamente termo-estável α-amilase produtora. Aplicação de Microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E., e Teague W.M. Purificação & caracterização de megatério clonado comercializado α-amilase. Parte I: Purificação & propriedades hidrolíticas. Amido. 43:319-323 (1991).
- Takasaki Y. Uma amilase produzindo maltotriose a partir de subtilis. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J., e Randall R.J. Medida da proteína com os reagentes de folin fenol. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W., e Lipman D.J. Ferramenta básica de busca de alinhamento local. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Gaurav K., e Karthik L. Optimização, produção e purificação parcial de extracelular α-amilase de Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. Medição das atividades celulásicas. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., e Qadeer M.A. Produção de α-amilase por Bacillus licheniformis usando um meio econômico. Biores Technol. 87:57-61 (2003).
- Mishra S., e Behera N. A atividade da amilase das bactérias degradantes do amido é isolada do solo que recebe resíduos de cozinha. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., e Ndjonenkeu T. Produção e Caracterização Parcial de uma amilase teimostável de Ascomycetes cepa de levedura isolada de solos amiláceos. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Produção e propriedades da α-amilase de Bacillus sp. termófila do Brasil J Microbiol. 33:57-61 (2002).
- Asad W. Produção de enzimas extracelulares por bactérias termofílicas indígenas: Purificação e caracterização parcial de α-amilase por Bacillus sp. WA21. Botânica do Paquistão J. 43:1045-1052 (2011).
- Kim T.U. Purificação e caracterização de uma cepa alcalina formadora de maltotetraos α-amilase a partir de uma cepa alcalófila de Bacillus, GM8901. Aplicar o Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., e Pandey A. Cultivo sólido de Bacillus amyloliquefaciens para produção de alfa amilase. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H., e Ahmed R.S. Purificação, e caracterização de termoestável α-amilase produzida por Bacillus licheniformis isolar AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., e Mulimani V.H. Isolamento e identificação de α-amilase produzindo Bacillus de Dhal
resíduos da indústria. Biofísica indiana J Biochem. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., e Khadiga A.A.T. Produção de amilase a partir de Bacillus amyloliquefaciens sob fermentação submersa usando alguns subprodutos agro-industriais. Ann Agri Sci. 60:193-202 (2015).
- Tamura K., e Nei M. Estimativa do número de substituições de nucleotídeos na região de controle do DNA mitocondrial em humanos e chimpanzés. Mol Biol Evol. 10:512-526 (1993).

(Visitado 12.737 vezes, 21 visitas hoje)