- Introdução
- Materiais e Métodos
- Participantes
- Procedimentos de Estudo, Aquisição de Dados de EEG e Análise
- Resultados
- Participantes
- EEG
- Fp1 Densidades Especrais de Potência do Canal (PSDs) Comparação
- Fp1 Teste de EEG de repouso/Retest Comparação
- Discussão
- Contribuições dos autores
- Funding
- Conflict of Interest Statement
- Confirmações
Introdução
Desordens neurodegenerativas representam enormes necessidades médicas globais não atendidas e requerem o desenvolvimento de novas terapias modificadoras da doença. Dada a natureza insidiosa dessas doenças e o alto custo de muitos testes diagnósticos, há uma necessidade significativa de biomarcadores amplamente disponíveis, confiáveis e baratos para acompanhar a progressão dos processos neurodegenerativos em períodos de tempo adequados para o desenvolvimento de medicamentos. Neste contexto, o EEG pode ter um potencial notável. Embora o EEG seja suscetível a fatores de estilo de vida e medicamentos conhecidos, ele tem muitas vantagens consideráveis. O EEG reflete a atividade sináptica, que é um denominador comum para o impacto funcional dos processos neurodegenerativos. O EEG é uma tecnologia não invasiva, portátil, segura e barata, que é amplamente aceita e requer um tempo de aquisição relativamente curto. O EEG qualitativo é rotineiramente utilizado na prática clínica para o diagnóstico da epilepsia. Mais recentemente, uma integração de um biomarcador de EEG quantitativo (qEEG) e avaliação clínica foi proposta para a avaliação do transtorno de déficit de atenção/hiperactividade (TDAH) e foi concedida pela FDA (Food and Drug Administration) designação classe II para apoiar a avaliação clínica do TDAH (Lenartowicz e Loo, 2014; Snyder et al., 2015). qEEG está em fase de investigação para uso como desfecho em doenças neurodegenerativas em ensaios clínicos. Entretanto, avanços recentes na análise de dados, interpretação e resolução espacial melhorada aumentaram o potencial do EEG como um biomarcador confiável e preciso para a progressão de doenças neurodegenerativas. Muitas análises QEEG de estado de repouso observacional relatadas suportam seu valor potencial como um biomarcador para detecção de assinaturas neurais de neurodegeneração que ocorrem na doença de Alzheimer (Babiloni et al, 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), doença de Parkinson (Sarnthein e Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) e demência frontotemporal (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
O longo dos anos, a tecnologia de hardware EEG também evoluiu e surgiram vários sistemas multicanais sem fio que fornecem EEG de alta qualidade e sinais fisiológicos em um design mais simples, conveniente e confortável do que os sistemas tradicionais e pesados. Os sistemas EEG tradicionais requerem um longo tempo de montagem e aplicação, normalmente envolvendo a abrasão do couro cabeludo do paciente. O tempo de aplicação e o desconforto tornam esses sistemas tradicionais um desafio para as populações afetadas pela demência, onde a cooperação com procedimentos clínicos demorados é muitas vezes difícil. No entanto, vários sistemas sem fio atualmente disponíveis podem ser aplicados em 20 minutos ou menos, sem desconforto durante a aplicação e com um ajuste confortável durante as aquisições. Combinados com os avanços nas técnicas de detecção de sinais e análise quantitativa, os sistemas sem fio são candidatos ideais para uma avaliação clínica relativamente rápida e tolerável de populações potencialmente desafiadoras de demência, como a variante comportamental da demência frontotemporal, caracterizada por mudanças proeminentes de comportamento e personalidade.
Mais recentemente, também tem havido um mercado crescente para tecnologias de uso doméstico, levando a sistemas de canais limitados disponíveis para uso pessoal, como meditação e treinamento de relaxamento. É concebível que estes sistemas, apesar da sua cobertura limitada, também possam ser utilizados em estudos clínicos seleccionados. A aplicação desses sistemas de consumo em pesquisas clínicas não foi, no entanto, amplamente explorada e a precisão e confiabilidade desses sistemas para medições repetidas não foram bem estabelecidas. Além disso, não está claro se a aquisição de canais limitados pode fornecer dados e cobertura anatômica suficientes para avaliar as assinaturas neurais em pacientes afetados por doenças neurodegenerativas.
O estudo atual foi projetado para fornecer uma avaliação inicial do potencial dos sistemas EEG de consumo para ensaios clínicos, comparando a facilidade de uso, precisão e confiabilidade de dois sistemas EEG multi-canal sem fio, B-Alert X24 e Enobio 20, com dois sistemas de consumo, de canal limitado, Muse e Mindwave.
Materiais e Métodos
Participantes
A população do estudo incluiu cinco participantes saudáveis que se qualificaram para o estudo (Tabela 1). Os sujeitos foram excluídos se, após revisão de seu histórico médico, medicações concomitantes e estilo de vida (consumo de álcool e cafeína, bem como estado tabágico), não foram considerados saudáveis. Especificamente, foram excluídos do estudo se tinham histórico de epilepsia, ou outros distúrbios do sono, neurológicos ou psiquiátricos, ou se estavam tomando medicamentos ou tinham um estilo de vida conhecido por afetar o sinal de EEG, como fumar e consumo considerável de álcool e cafeína.

Tabela 1. A demografia e as características básicas da população estudada.
Consentimento Informado Escrito foi obtido de todos os participantes do estudo seguindo as diretrizes para investigação experimental com sujeitos humanos exigidas pelo Comitê de Revisão Institucional do Chesapeake.
Procedimentos de Estudo, Aquisição de Dados de EEG e Análise
Para evitar a potencial variabilidade do sinal de EEG associado à ingestão nutricional e variações circadianas, todas as visitas ocorreram pela manhã após um café da manhã padrão com baixo teor de carboidratos e alta proteína (para minimizar a sonolência pós-prandial) no local do estudo do laboratório de pesquisa Advanced Brain Monitoring (ABM). Além disso, os participantes foram solicitados a evitar bebidas alcoólicas na noite anterior à visita do estudo, bem como jejuar e evitar cafeína na manhã da visita.
Os dados foram adquiridos durante duas visitas separadas ~1 semana, além de dois sistemas médicos EEG multicanal (20 canais), B-Alert (Advanced Brain Monitoring, ABM) e Enobio (Neuroelectrics) (Figura 1, Tabela 2) e dois sistemas de consumo de canal limitado, Muse (Interaxon, 2 canais) e Mindwave (Neurosky, 1 canal) (Figura 1, Tabela 2) na seguinte ordem: Muse, Mindwave, B-Alert, Enobio. O Sistema EEG B-Alert X24 e o Enobio são ambos sistemas sem fio CE com certificação médica de 20 canais aplicados na montagem padrão internacional 10-20 e adquirem sinal EEG a uma taxa de amostragem de 256 Hz. Além disso, o B-Alert foi autorizado pela FDA para uso como dispositivo médico.
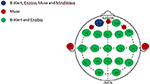
Figure 1. Distribuição anatômica de canais dos sistemas EEG de canais múltiplos e limitados. Representação dos canais partilhados e únicos entre os quatro sistemas de EEG avaliados. O canal comum aos quatro sistemas EEG, Fp1 (azul); canais exclusivos do sistema Muse (vermelho); canais compartilhados entre os sistemas multicanais, B-Alert e Enobio (verde).

Tabela 2. Comparações de sistemas EEG.
B-Alert usa mastoides como canal de referência. Enobio pode ser usado com uma referência de mastoide, clipe de ouvido ou usando outros locais do couro cabeludo. O Mindwave também tem uma referência no deslizamento do ouvido e o Muse tem três canais de referência na testa. Todos os sistemas incluíram verificação da qualidade do sinal, no entanto, ao contrário dos sistemas EEG médicos, ambos os sistemas de consumo possuem eletrodos secos e nenhuma verificação de impedância.
Estas tecnologias foram selecionadas com base na sua capacidade de fornecer aos usuários finais saídas EEG brutas através de acesso prático e não-proibitivo.
Dez minutos de EEG em estado de repouso foram adquiridos durante olhos abertos (EO) com fixação visual em um símbolo de cruz apresentado na tela de um computador (5 min), bem como enquanto os olhos fechados (EC) durante 5 min.
Desde que todos os quatro sistemas só partilham o canal FP1 (Figura 1), padrões de EEG (cru e descontaminado), densidades espectrais de potência (PSDs), e comparações de teste/reteste de fiabilidade entre os quatro sistemas de EEG avaliados no estudo foram realizados com foco no eléctrodo Fp1 tanto em condições EO como EC.
Os dados de EEG de cada sistema foram carregados no MATLAB (Mathworks) usando funções construídas à medida. Os dados do EEG registrados durante pausas e instruções foram descartados antes da análise. A densidade espectral de potência do EEG para cada período de 1 s foi calculada usando o método de periodograma modificado de Welch com um afunilamento da janela de Hamming de 1 s de comprimento. Os PSDs foram calculados no EEG de repouso durante os períodos de olhos abertos e olhos fechados. Para permitir unidades iguais (μV), um fator de correção de 1,25 (Muse), 0,25 (MindWave), ou 1.000 (Enobio 20) foi aplicado. Todos os dados PSD do canal Fp1 foram calculados como média para os cinco sujeitos de cada visita. O teste de retorno foi realizado calculando e plotando Vist1/Visit2.
Resultados
Participantes
Participantes eram todos voluntários saudáveis com uma média de idade de 27 anos, eram todos de mão direita e não-fumantes, e predominantemente do sexo masculino (60%). Seus dados demográficos e características básicas estão resumidos na Tabela 1.
EEG
EEG foram coletados com sucesso de todos os quatro sistemas testados. Como esperado, devido aos eletrodos secos e ao número limitado de canais, o tempo de preparação foi consideravelmente menor para os sistemas EEG de consumo. Entretanto, não houve diferença observada na tolerância e aceitação dos sujeitos nos quatro sistemas.
Padrão de dados brutos de EEG em EO (Figura 2) e EC (Figura 3) as condições foram coletadas e avaliadas de cada sistema. Muse e Mindwave foram mais propensas a artefatos devido a piscadas oculares e movimento muscular na região frontal com abertura ocular (Figura 2).
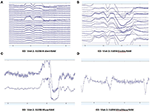
Figura 2. Extratos de dados brutos do EO de B-Alert (A) e Enobio (B) Muse (C) e MindWave (D) dentro do mesmo participante durante a mesma visita.
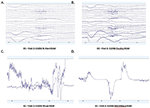
Figura 3. Extractos de dados brutos de CE de B-Alert (A) e Enobio (B) Muse (C) e MindWave (D) dentro do mesmo participante durante a mesma visita.
Fp1 Densidades Especrais de Potência do Canal (PSDs) Comparação
PSDs médios no canal Fp1 comuns a todos os quatro sistemas EEG para a Visita 1 e Visita 2 foram calculados e foram traçados para ambas as condições EO (Figuras 4A,B) e CE (Figuras 4C,D). Na condição EO, os espectros B-alert e Enobio foram aproximadamente iguais, enquanto Mindwave foi ligeiramente aumentada, mas seguiu uma curva semelhante. Foi observado um aumento na potência de banda larga para os PSDs adquiridos com o sistema Muse. Da mesma forma, na condição EC (Figuras 4C,D), B-Alert, Enobio e Mindwave os PSDs foram semelhantes, porém foi observado um aumento na potência de banda larga para os espectros da Muse, que também pareceram ter maior variação do que os outros sistemas. Picos a 8-12 Hz (banda alfa) eram visíveis nos espectros adquiridos com os sistemas B-Alert, Enobio e Mindwave em cada visita. Enquanto havia um pico alfa claro para os espectros de potência da Musa na Visita 2, nenhum pico foi observado nos espectros da Visita 1.
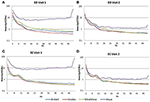
Figura 4. Fp1 Densidades espectrais de potência (PSDs) dos quatro sistemas EEG na condição EO na Visita 1 (A) e Visita 2 (B) e na condição EC na Visita 1 (C) e Visita 2 (D).
Fp1 Teste de EEG de repouso/Retest Comparação
Na condição EC, a razão espectral de potência estava entre 0,975 e 1,025 para B-Alert, Enobio, e Mindwave (Figura 5A). A razão PSD do sistema Muse teve mais variação que os outros três sistemas com razões entre 1,125 e 1,225. Na condição EO, parecia haver um pouco mais de variação para Enobio nas ondas lentas Delta (1-3 Hz), Theta (3-7 Hz) e alfa lenta (8-10) e para B-Alert e Mindwave nas ondas mais rápidas Beta (13-30 Hz) e Gama (25-40 Hz). No entanto, as proporções ainda se encontravam entre 0,975 e 1,05. Similarmente à condição EC, o teste/reteste para Muse teve maior variação, com proporções de até 1,2 (Figura 5B).
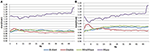
Figure 5. Razões de teste-reteste para a condição EC (A) e EO (B).
Discussão
Este estudo comparou o sinal EEG quantitativo e a confiabilidade de teste-reteste dos sistemas EEG médicos e de consumo, a fim de avaliar sua potencial aplicação em pesquisa clínica e ensaios clínicos. Os sistemas de EEG de consumo recentemente popularizados foram avaliados devido ao seu baixo custo, ampla acessibilidade e potencial para estudos domiciliares em populações desafiadoras. Entre as aplicações populares dos sistemas de EEG para consumidores estão a meditação e o treinamento de relaxamento, bem como o enfrentamento da ansiedade ou dor. Investigações recentes têm vindo a explorar a sua utilidade para além do jogo: O NeuroSky demonstrou ser capaz de detectar o início da fase 1 do sono (Van Hal et al., 2014) e também tem havido interesse em avaliar o EEG do consumidor dentro de interfaces de computador do cérebro (Bialas e Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). A aplicação de sistemas EEG mais simples (6 canais, por exemplo) também está sendo explorada para cenários de emergência (Jakab et al., 2014). Uma avaliação prévia, embora utilizando um fone de ouvido mais complexo, mostrou que sistemas de EEG de múltiplas derivações disponíveis comercialmente, como o Emotiv EPOC 16-electrode cap, também podem ter valor na avaliação das condições clínicas (Schiff et al., 2016).
Este estudo forneceu evidências de que dados de EEG de boa qualidade podem ser coletados com sucesso de EEGs de consumidores. Entretanto, houve distinções no aumento de potência, teste de reteste e forma do pico alfa observado em 8-13 Hz. A Mindwave mostrou espectros de potência Fp1 semelhantes aos sistemas médicos com um ligeiro aumento da banda larga sobre B-Alert e Enobio. Muse mostrou um aumento de banda larga nos espectros de potência, que pode refletir artefatos nos dados adquiridos por um eletrodo seco.
Sistemas EEG de consumo mostraram uma configuração significativamente mais conveniente e rápida, o que é ótimo para seu uso pretendido em aplicações de entretenimento e auto-ajuda. No entanto, a qualidade dos seus dados foi globalmente afectada negativamente pela susceptibilidade dos artefactos associados com o eléctrodo seco. Como esperado, a qualidade dos dados foi particularmente diminuída durante a EO. A falta de capacidade de teste de impedância e aplicação na região frontal, que é particularmente propensa a piscar os olhos e movimento muscular com abertura dos olhos também contribuiu provavelmente para este artefato relativo. Além disso, a avaliação realizada pelos sistemas EEG de consumo é, pela sua natureza, limitada e confinada à única região anatômica do cérebro coberta pelos poucos canais, excluindo avaliações multi-rede.
Eléctrodos secos também podem ser mais propensos a resultar em desconforto ao longo do tempo e representar um maior risco de colocação errada na testa, levando a uma aquisição e teste/reteste impreciso do sinal. Em comparação com os equipamentos de grau médico, a confiabilidade do teste/reteste foi menor nos sistemas EEG de consumo. A confiabilidade foi medida com uma aquisição de teste/reteste para todos os sistemas (Figura 5). Enquanto B-Alert, Enobio e Mindwave tiveram um desempenho razoavelmente bom, Muse teve uma confiabilidade relativamente baixa. Além disso, enquanto um claro pico alfa foi demonstrado para Muse na Visita 2 (Figura 4), a ausência de um pico alfa na Visita 1 sugere uma falta de consistência que pode ser devida ao artefato. Medidas consistentes e confiáveis da atividade cerebral são cruciais em ensaios clínicos quando se monitora a progressão da doença e se avalia a eficácia de uma terapêutica experimental. Embora os sistemas de consumo possam ser úteis para uma avaliação rápida quando o tempo é limitado, essas limitações do EEG de consumo podem dificultar suas aplicações em ambientes de pesquisa e estudos clínicos e um sistema de grau médico com alta confiabilidade de teste-reteste é recomendado para uso como um desfecho farmacodinâmico em avaliações clínicas.
Ultimamente, a comparação de sistemas de EEG médicos e de consumo sob condições experimentais destacou a diferenciação no desempenho e, particularmente, as limitações específicas de uso que poderiam dificultar as aplicações de sistemas de consumo em ambientes de pesquisa e estudos clínicos. Por outro lado, os sistemas médicos multi-líderes são menos ideais para fins de entretenimento que requerem configuração rápida e processamento de dados a partir de um número mínimo de eléctrodos. A principal limitação deste estudo reside no pequeno tamanho da população do estudo e na falta de aleatorização da ordem dos sistemas utilizados para a aquisição. Os dados foram adquiridos na mesma ordem de sistemas, a fim de evitar efeitos de tempo de aquisição que podem impactar o EEG devido aos ritmos circadianos. No entanto, a métrica de potência do EEG provou ser muito confiável e repetível para indivíduos quando se utiliza sistemas de EEG padrão. Por esta razão, o tamanho da amostra selecionada foi considerado informativo.
Em conclusão, os dados do EEG podem ser coletados com sucesso dos quatro sistemas testados, incluindo os sistemas de EEG de consumo, com limitações variáveis na usabilidade, qualidade dos dados e confiabilidade que orientam suas aplicações ideais, inclusive em ambientes de ensaios clínicos. Susceptibilidade ao artefato e variabilidade na confiabilidade do teste/reteste associado aos sistemas EEG de consumo atuais sugerem o uso do sistema EEG de grau médico para coletas robustas de dados de EEG transversais e longitudinais.
Contribuições dos autores
ER e AV: participaram da concepção e desenho do projeto, da análise e interpretação dos dados e da preparação do manuscrito. SW, CB e GR: participaram da concepção e desenho do projeto, da sua execução, da análise e interpretação dos dados e da preparação do manuscrito. Todos os autores estiveram envolvidos na elaboração, redação e revisão do manuscrito e todos leram e aprovaram a versão final do manuscrito.
Funding
Este estudo foi apoiado pela Biogen.
Conflict of Interest Statement
ER e AV: empregado da Biogen. SW e CB: Funcionário da Advanced Brain Monitoring, Inc. GR: Empregado da Neuroelectrics.
Confirmações
Gostaríamos de agradecer aos participantes do estudo pelo seu tempo e contribuições para este estudo. A equipe da Biogen participou do desenho, análise e interpretação dos dados, da redação do relatório e da decisão de submeter o artigo para publicação.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Fontes corticais de ritmos eletroencefalográficos do estado de repouso na demência relacionada à doença de Parkinson e à doença de Alzheimer. Clin. Neurofisiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). “Development of EEG biomarkers for Alzheimer’s disease”, em GTC Biomarkers Summit (San Diego, CA).
Bialas, P., e Milanowski, P. (2014). Uma interface de alta freqüência de estado estável visualmente evocada com base no potencial do cérebro do computador usando fones de ouvido EEG de grau consumidor. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). EEG quantitativo e LORETA: ferramentas valiosas no discernimento do FTD do AD? Neurobiol. Idade 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., e ChiehLee, T. (2015). A potência de frequência e a coerência da electroencefalografia estão correlacionadas com a gravidade da doença de Alzheimer: uma análise multicêntrica em Taiwan. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Os marcadores quantitativos de EEG estão relacionados com a gravidade da doença de Alzheimer no registro prospectivo de demência da Áustria (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). O pico de frequência dominante do EEG diferencia entre a doença de Alzheimer e a degeneração frontotemporal do lobar. J. Alzheimer Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Novo sistema de eletroencefalografia sem fio com um tempo mínimo de preparação para uso em emergências e cuidados pré-hospitalares. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., e Jo, S. (2015). Avaliação quantitativa de uma interface híbrida não invasiva de baixo custo baseada no EEG e no movimento dos olhos. IEEE Trans. Neural. Syst. Reabilitação. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). “Deep networks using auto-encoders for PD prodromal analysis”, em Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Uso do EEG para diagnóstico de TDAH. Moeda. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., e Zanetti, O. (2011). O substrato anatômico e os marcadores EEG do couro cabeludo estão correlacionados em indivíduos com deficiência cognitiva e doença de Alzheimer. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Diferenças no EEG quantitativo entre demência frontotemporal e doença de Alzheimer, conforme revelado pela LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Investigação da conectividade funcional do EEG em estado de repouso em degeneração lobar frontotemporal. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., e Soria-Frisch, A. (2016). “EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients”, em Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., e Jeanmonod, D. (2007). Alta coerência tálamo-cortical teta em pacientes com doença de Parkinson. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Um sistema de registo electroencefalográfico de baixo custo e de fácil utilização para a avaliação da encefalopatia hepática. Hepatologia 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., and Johnson, R. (2015). “A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Integração de um biomarcador EEG com a avaliação do ADHD de um clínico. Comportamento Cerebral. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). “Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., e Claire Davies, T. (2017). Já estamos lá? Avaliação da interface cérebro-computador de grau comercial para controle de aplicações informáticas por indivíduos com paralisia cerebral. Deficiência. Rehabil. Assistência. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., e Bossemeyer, R. (2014). Detecção de sono de baixo custo com base no EEG. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., e Verma, A. (2016). “Identification of neurophysiological biomarkers of MCI using resting state, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar