- Background and Introduction
- Case Presentation
- Discussão
- Patofisiologia da DDA
- Pesquisa de Literatura
- Causas de DDA
- Apresentação clínica da DDA
- Complicações associadas da DDA
- Administração de ADI
- Conclusão
- Dados Disponibilidade
- Declaração de Ética
- Consentimento para participar
- Contribuições do autor
- Funding
- Conflito de interesses
- Acreditos
Background and Introduction
Hypothalamic Adipsic Diabetes Insipidus (ADI), uma síndrome rara com apresentação clínica heterogênea, é caracterizada por uma congregação de defeitos nos mecanismos homeostáticos para o equilíbrio hídrico. Estes incluem osmoregulação do mecanismo da sede, secreção de arginina vasopressina e capacidade renal para concentrar a urina. Menos de cem casos graves foram relatados em todo o mundo nas últimas quatro décadas (1).
O manejo desses pacientes é extremamente desafiador, pois esses pacientes tendem a sofrer grandes oscilações no plasma de sódio, mesmo quando a DI é bem controlada (2).
Nós relatamos um caso de DDA grave que ocorreu no pós-operatório de cirurgia de malformação arteriovenosa cerebral (MVA). Descrevemos a possível patogênese neste caso e revisamos a literatura para todos os casos relatados de forma semelhante e descrevemos os potenciais mecanismos envolvidos, a apresentação clínica, o manejo agudo e crônico e o prognóstico.
Case Presentation
Uma senhora de 27 anos de idade apresentou hemorragia intracerebral frontal esquerda com extensão intraventricular secundária a um grande complexo de gânglios basais (MVA) com alimentadores arteriais complexos das artérias cerebrais médias esquerdas (ACM), e artérias cerebrais anteriores (ACA) com Escala de Classificação Spetzler Martin de 3 (3).
Após recuperação inicial da craniotomia descompressiva e cirurgia de evacuação do coágulo, ela foi submetida a uma cirurgia eletiva de excisão da MVA ~2 semanas depois. Durante a cirurgia da MAV, os cirurgiões relataram hemorragia rápida dos vasos de alimentação (a MCA, ACA e os vasos coroidais) com hemorragia intracerebral grave e hemorragia intra-ventricular que exigiu transfusão maciça de sangue de até 32 unidades no intra-operatório. Ela foi colocada em coma induzido por barbitúricos e induziu hipotensão para minimizar o edema cerebral (4).
Começou a ter poliúria com grandes volumes de urina intra-operatoriamente logo após o episódio de hemorragia intra-operatória profusa. Embora no pré-operatório suas concentrações de sódio estivessem normais, as concentrações de sódio foram maiores imediatamente (na 1ª hora) no pós-operatório, na faixa de 151-160 mmol/L em conjunto com uma baixa osmolalidade urinária <130 mosm/L. Foi considerada DI transitória e ela foi iniciada com desmopressina intravenosa (desmopressina intravenosa) 1 mcg que foi administrada diariamente juntamente com 3,5-4 L de infusão salina de meia força por 3 dias consecutivos.
No entanto, desde então ela desenvolveu edema pulmonar (provavelmente uma consequência de transfusão de sangue maciça intra-operatória, líquidos hipotônicos intravenosos e desmopressina intravenosa simultânea) no quarto dia pós-operatório, a desmopressina intravenosa foi descontinuada, e plasma fresco congelado e diuréticos (furosemida intravenosa 40 mg) foram administrados para reduzir o edema extra-vascular. Na hora seguinte, ela começou a desenvolver novamente poliúria com um débito urinário de 800 mL em uma única hora e suas concentrações de sódio subiram para 172 mmol/L. Em vista do concomitante edema cerebral pós-operatório, foi decidido diminuir as concentrações de sódio de forma orientada, de modo que a taxa de diminuição do sódio permanecesse dentro de 5-10 mmol/L/dia, com um nível alvo de 155 mmol/L. Foi administrada uma dose baixa de desmopressina EV 0,25 mcg, e sugeriu-se um regime de titulação com o objetivo de manter um débito urinário por hora inferior a 100 mL/h. Ela necessitou de desmopressina intravenosa 0,75 mcg no quinto dia pós-operatório, e depois intravenosa 0,25 mcg duas vezes ao dia no sexto dia, quando ela atingiu um nível alvo de 155 mmol/L. Esta concentração de sódio poderia ser mantida com a dosagem de desmopressina por mais 2 dias.
No nono dia, pós-operatório, a desmopressina foi descontinuada, pois ela foi capaz de manter um baixo débito urinário sem a desmopressina, e as concentrações de sódio foram estáveis. Nesta fase, foi considerado que ela tinha desenvolvido síndrome de secreção inapropriada do hormônio diurético (SIADH) e os fluidos estavam restritos a 1 L/dia. Suas concentrações de sódio permaneceram estáveis em 134-138 mmol/L durante esta semana.
No 14º dia pós-operatório, ela desenvolveu novamente poliúria com concentrações crescentes de sódio e osmolalidade sérica. Neste momento, a desmopressina IV foi retomada a 0,25 mcg duas vezes ao dia. As concentrações de sódio puderam ser mantidas em 138-150 mmol/L com desmopressina intravenosa (0,25 mcg duas vezes ao dia) e fluidos. Ela tinha passado por uma fase trifásica com um período de DI transitório, seguido por SIADH, e subsequente DI permanente (ver Figura 1). O cortisol sérico, hormônio de crescimento, fator de crescimento-1 da insulina, função tireoidiana e níveis de prolactina estavam todos dentro da faixa normal.

Figura 1. Gráfico mostrando todas as medidas seriadas em nosso paciente durante toda a internação.
Após a inserção de shunt ventriculoperitoneal (feito para manter a pressão intracraniana) 6 semanas após a excisão da MVA, ela foi transferida para as enfermarias de reabilitação e o regime de desmopressina intravenosa convertido em regime subcutâneo (SC) (ver Figura 1). Quando a alimentação da sonda nasogástrica foi interrompida, tentamos regular os fluidos pela sede. As investigações de sangue mostraram aumento dos níveis de sódio até 165 mmol/L e ela não sentiu sede durante este período de hipernatracemia apesar de uma osmolalidade sérica de 350 mosm/kg. Ela permaneceu adipsica apesar da recuperação da afasia. Uma escala de sede não foi usada como no interrogatório, ela verbalizou que não sentiu sede alguma, e uma escala de sede não pôde ser aplicada. Portanto, os fluidos tinham que ser regulados para manter o equilíbrio do sódio. Seu débito urinário foi fixado e seu balanço de sódio bem regulado num regime de desmopressina 0,5 mcg pela manhã e 0,375 mcg pela noite, com fluidos regulados de 1,5-2 L por dia. Ela não tinha nenhuma evidência de distúrbios termorregulatórios. A cranioplastia com poliéteretercetona (PEEK) foi realizada ~4 meses após a cirurgia inicial.
Após 5 meses de reabilitação multidisciplinar intensiva, ainda apresentava mão direita dominante não funcional e déficits cognitivos residuais significativos, não sendo possível a longo prazo a dosagem segura e a auto-administração da desmopressina subcutânea.
Um ensaio de desmopressina nasal e desmopressina oral mostrou absorção variável significativa levando a maiores flutuações nas concentrações de sódio. A seguir, decidimos usar a desmopressina sublingual disponível como desmopressina Melt. Após várias tentativas de diferentes regimes de dosagem, conseguimos fixar o débito urinário em aproximadamente 2 L/dia usando a desmopressina Melt oral lyophilizate 120 mcg (2 comprimidos) de manhã e 60 mcg (1 comprimido) à noite. No entanto, com esta dose ela estava tendo hiponatremia em certas horas do dia. Realizamos uma titulação de dose adicional cortando os comprimidos de desmopressina usando uma pinça/forceps para levantar os comprimidos da embalagem blister e cortar os comprimidos em pedaços exatos de um quarto (cada 15 mcg) com a ajuda de um cortador de comprimidos. Com um regime de 90 mcg (1,5 comprimidos) de manhã e 75 mcg (1,25 comprimidos) à noite conseguimos alcançar resultados semelhantes aos do regime subcutâneo. Com este regime, e uma ingestão de fluido regulada de 2 L/dia, suas concentrações de sódio foram mantidas na faixa de 135-150 mmol/L sem grandes flutuações ou sintomas cognitivos. Essa dosagem também permitiu que ela tivesse aumento de atividade durante o dia para reabilitação e que ela fosse capaz de dormir bem perturbada pela poliúria à noite.
Ver Figura 1 para as medidas seriadas de sódio nessa paciente durante todo o período de internação com os eventos descritos acima.
Em vista da história clínica e do fato de que sua hipófise e hipotálamo estão em sua maioria intactos, é improvável que ela tenha tido defeitos significativos na barorregulação.
Discussão
Patofisiologia da DDA
Em condições fisiológicas, o sódio plasmático, osmolalidade e equilíbrio hídrico são mantidos dentro de faixas estreitas secundárias a uma interação cuidadosa entre sede e ingestão de água, secreção de vasopressina neuro-hipofisária e a antidiurese nos tubos coletores distais renais.
Sinais periféricos (orofaríngeo, osmosensores intestinais, osmolalidade sanguínea) codificam informações sobre o estado atual de hidratação em tempo real e estes são integrados centralmente (5). Um estado de desidratação levará a sinais estimulatórios ao órgão subfornical (OVLT) que hierarquicamente envia sinais ao organum-vasculosum da lâmina terminal (OVLT), e ao núcleo pré-óptico mediano (MnPO) (6). O MnPO, que pode servir como “detector central”, envia sinais estimulatórios aos núcleos hipotalâmicos para aumentar a liberação de vasopressina e também envia sinal de sede aumentada através do OVLT e do OVLT (7, 8). As vias neurais relacionadas à sede que conectam o OVLT e o OVLT ao córtex cingulado e insular resultam na percepção consciente da sede (7, 8). Pelo contrário, no estado de hidratação adequada, os sinais dos sensores periféricos, levam a uma inibição dessas áreas, e o feedback negativo do MnPO leva à supressão da sede e à menor secreção e liberação de vasopressina (circuito vermelho). Com efeito, os neurônios no MnPO, OVLT e SFO estão ampla e reciprocamente interligados, uma vez que a ativação optogenética e quimiogênica dos neurônios em qualquer uma dessas áreas pode estimular a sede (9). Portanto, a interrupção do fornecimento de sangue resultando em danos celulares levará à adipsia. Casos de DDA devido à auto-imunidade às células neuronais do OVLT e OVLT também foram publicados indicando a importância funcional desses sensores neuronais no controle da sede (10).
Os neurônios AVP exibem atividade “faseada” de potenciais de ação com intervalos nos quais o AVP é liberado nos terminais axonais. A liberação de vasopressina é regulada pelas entradas osmosensoriais do MnPO, através de barorreceptores e há também uma regulação antecipatória onde a liberação de vasopressina é estimulada antes das refeições (prandial), em hipertermia e em um padrão circadiano (11). Há um padrão circadiano diário de secreção de vasopressina na circulação com aumento dos níveis entre 24:00 e 02:00 h e os níveis caem progressivamente durante o dia com o nadir entre 16:00 e 20:00 h (12). Este aumento da meia-noite circadiana causado por um aumento na liberação de vasopressina resulta em parte do aumento da excitação sináptica dos neurônios magnocelulares pelo núcleo supraquiasmático que é conhecido por regular o ritmo circadiano (11). Na DDA, a regulação osmosensorial da secreção de vasopressina é mais afetada e outros efeitos podem variar dependendo do local e extensão da lesão, enquanto que a resposta barorreceptora é conhecida por ser preservada em muitos pacientes com lesão limitada, como demonstrado em um estudo (13).
AVP atua nos dutos coletores renais através dos receptores Vasopressin-2 (V2) para aumentar a permeabilidade da água, o que leva à diminuição da formação de urina. A reabsorção de água é controlada através da regulação do canal de água, aquaporina-2 (AQP2). AVP induz, a curto prazo, a translocação intracelular de vesículas portadoras de AQP2 para a membrana plasmática apical, regulando assim o tráfico de AQP2. A longo prazo, com concentrações adequadas de AVP, regula a transcrição do gene AQP2 para aumentar a abundância de proteína AQP2 no ducto coletor (14). Na ADI, postulamos que é provável que a resposta osmosensorial aguda seja mais afetada do que a resposta crônica. Assim haverá uma relativa abundância de aquaporina mas o tráfico agudo para a membrana apical será afectado.
Ver Figura 2 para ilustração detalhada dos mecanismos.
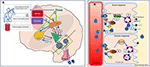
Figura 2. Representação esquemática da regulação do equilíbrio de fluidos em humanos. (A) O controlo e regulação da secreção vasopressina no cérebro. (A) Os sinais periféricos (orofaríngeo, osmosensores intestinais, osmolalidade sanguínea) codificam informação sobre o estado actual de hidratação em tempo real (1) e integrada centralmente (2). Um estado de desidratação leva a sinais estimulantes ao OVLT e ao MnPO (3), que hierarquicamente enviam sinais ao OVLT e ao MnPO. O MnPO, que pode servir como “detector central”, envia sinais de estimulação aos núcleos hipotalâmicos para aumentar a liberação de vasopressina (4), e também envia sinais de sede aumentada através do OVLT e do OVLT (5, circuito azul no diagrama). Pelo contrário, no estado de sinais de hidratação adequados dos sensores periféricos, há uma inibição dessas áreas e feedback negativo do MnPO levando à supressão da sede e menor secreção e liberação de vasopressina (circuito vermelho 6). As vias neurais relacionadas à sede que ligam o OVLT e o OVLT ao córtex cingulado e insular resultam na percepção consciente da sede (7). Na DI adipsica, na ausência de estímulos osmosensoriais associados aos circuitos neurais devido a danos celulares, a liberação estimulante ou inibição da vasopressina e a percepção consciente da sede, ambos são perturbados. (B) O mecanismo de ação da vasopressina sobre os túbulos coletores renais. (B) A vasopressina na circulação sanguínea liga-se ao receptor 2 de vasopressina na superfície luminal das células principais do túbulo colector distal nos rins (1). Na fase aguda, através da síntese de cAMP de ATP através de AC (adenilato ciclase) forma a proteína quinase A (2) que estimula a translocação da aquaporina da vesícula de armazenamento para a membrana apical e a superfície luminal do sangue (3). Isto resulta no transporte de água para a célula (4) e na sua posterior absorção para a circulação (5). Na fase crónica, através do controlo transcricional mediado por cAMP do gene da aquaporina (6) podem ser encontrados níveis aumentados do canal de água da aquaporina nas células principais (7). Na DI adipsica, a resposta aguda é provavelmente mais afetada do que a resposta crônica, uma vez que a secreção de vasopressina osmosensorial relacionada é afetada.
Pesquisa de Literatura
Realizamos uma pesquisa sistemática na literatura incluindo Pubmed, Scopus e Embase para casos relatados como relato de caso ou série de casos de DDA dos anos 1980 a 2018. Usamos o termo de pesquisa: Adipsia, Adipsic disorder, e Adipsic DI e limitámos a pesquisa à língua inglesa e aos humanos. Também pesquisamos quaisquer outras referências identificadas durante a leitura de cada relato de caso/ série de casos. Encontramos 25 referências (10, 13, 15-39) com um total de 45 casos relatados na literatura. Resumimos todos os relatos de casos na Tabela 1.
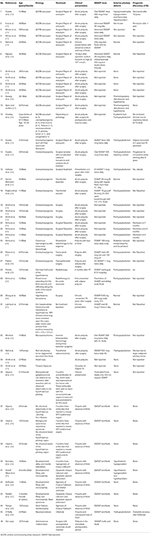
Tábua 1. Demografia, etiologia, apresentação clínica, manejo e prognóstico de pacientes com diabetes insípido adipsico relatados na literatura.
Causas de DDA
Quarenta por cento (17/46) dos casos de DDA descritos na literatura ocorreram secundários à ruptura do aneurisma da artéria comunicante anterior (ACOM) e à clipagem pós-cirúrgica utilizando uma abordagem craniectomia frontal. Em um caso, foi descrita a dupla patologia do craniofaringioma e do aneurisma ACOM (15). O suprimento arterial do TOVLT foi descrito como sendo proveniente de quatro fontes (40): (1) uma fonte mediana superior que se ramifica da artéria comunicante anterior, (2) e (3) duas fontes laterais provenientes de artérias que se ramificam de cada artéria cerebral anterior abaixo da artéria comunicante anterior, e (4) uma fonte mediana inferior que ascende de abaixo do quiasma óptico. Caracteristicamente, os capilares que revestem este órgão estão fora da barreira hemato-encefálica e, portanto, uma mudança na osmolalidade pode ser facilmente sentida por estes órgãos (41). Deve-se notar que melhorias nas técnicas cirúrgicas e o uso de bobinamento em vez de clipagem podem reduzir essas complicações. Para pacientes em boas condições clínicas com aneurismas rompidos da circulação anterior que são adequados para coiling, dados de uma meta-análise mostram que o coiling está associado a um melhor resultado (42). Quando comparado ao recortamento em que ambas as extremidades da ACA são recortadas com interrupção do fornecimento de sangue ao hipotálamo, o procedimento de inserção de uma bobina no aneurisma é capaz de preservar os alimentadores do hipotálamo na maioria dos casos.
A segunda causa da ADI tem sido descrita como craniofaringioma supra-selar (17/46). Estes casos frequentemente envolvem uma excisão trans-frontal e a recuperação após a cirurgia tem sido descrita em alguns casos. Um caso de hemangioma cavernoso com manifestação semelhante após episódio de sangramento também tem sido descrito (26).
Tumores hipotalâmicos incluindo hamartoma, tumor de glândula pineal e tumor de células germinativas podem apresentar DDA (26, 29, 30). Um caso de carcinoma hepatocelular com metástase ao hipotálamo e DDA resultante foi relatado (31).
Interessantemente, apenas dois casos de tumores pituitários com DDA foram descritos (18, 32). Ambos os casos tinham um tumor agressivo com ressecção trans-frontal múltipla e hemorragia intracraniana no intra-operatório. Um caso cada foi descrito em relação à lesão da cabeça e exposição ao tolueno também (13).
Quatro casos foram descritos com súbita apresentação aguda de poliúria e hipernatremia. Estes doentes não apresentaram quaisquer anomalias estruturais no hipotálamo e as investigações detalhadas revelaram evidências de anticorpos contra os órgãos do TVLT. Estes casos foram postulados como tendo uma patologia auto-imune subjacente (10, 33).
Congenital ou casos de primeira infância em doentes com problemas de desenvolvimento do corpus callosum também foram descritos com manifestação de DDA (34-38). Um caso de neurosarcoidose afetando extensamente a hipófise anterior, pituitária posterior e hipotálamo com DDA também tem sido descrito (39).
Apresentação clínica da DDA
Apresentação clínica na maioria dos casos descritos é poliúria na semana imediata após a clipagem cirúrgica para MVA ou após craniotomia. A apresentação bioquímica é hipernatremia com aumento da osmolalidade sérica na presença de urina diluída de forma inadequada em grandes volumes. Se a sensação de sede for avaliada usando uma escala de sede, estes pacientes com IDA relatam sede baixa ou mínima, apesar da hipernatremia. Curiosamente, estes pacientes têm uma resposta normal à hipotensão e seu mecanismo barorreceptor está intacto (13).
Nosso paciente passou por uma fase trifásica de DI inicial, seguida por SIADH e depois DI permanente. Este padrão descrito como resposta trifásica foi descrito após cirurgias de hipófise e craniofaringioma. A fisiopatologia da resposta trifásica parece ser explicada pela disfunção hipotalâmica precoce (caracterizada por poliúria e hipernatremia), posterior liberação de vasopressina pré-formada das vesículas de armazenamento na pituitária posterior (não relacionada a qualquer estímulo) (caracterizada por SIADH) e, finalmente, esgotamento das reservas de vasopressina (DI permanente) (43). Em nosso paciente, é provável que na terceira fase, a deficiência na resposta à osmolalidade na liberação de vasopressina seja desmascarada após a resolução da SIADH, ao invés de uma depleção absoluta de vasopressina.
Complicações associadas da DDA
Poucos relatos de casos descreveram distúrbios termorregulatórios. O panipopituitarismo tem sido relatado em casos de craniofaringioma e somente em casos de tumor pituitário e não estava presente em nosso paciente.
>
Embora não seja relatado consistentemente, outras complicações importantes da hipernatremia incluem trombose venosa profunda; portanto, a heparina de baixo peso molecular pode ser indicada durante doença aguda e imobilização (18).
Besidade tipotalâmica e apneia do sono também tem sido comumente relatada (18). Em uma série de casos (13), onde avaliaram a resposta da AVP à hipotensão, descobriram que os pacientes com craniofaringiomas também tiveram uma perda da resposta da AVP baro-regulada. Estes pacientes apresentavam evidências de panipofituitarismo, indicando que a cirurgia de seus tumores havia deixado lesões mais disseminadas na hipófise, incluindo a hipófise posterior, que é a via final comum para a secreção de AVP.
Administração de ADI
O manejo destes casos foi descrito (15, 18). A educação do paciente e da família sobre os princípios de equilíbrio e manejo da água é crucial. O consumo de água pode ser fixado em 1,5-2 L diariamente e, em seguida, a titulação da desmopressina realizada. O acompanhamento diário do peso é útil para detectar desidratação ou sobrecarga de fluidos. É recomendado fazer concentrações semanais de sódio plasmático para monitorar as flutuações. Apesar da monitorização rigorosa, é difícil reproduzir um controlo permanente das concentrações de sódio plasmático que imita a osmoregulação fisiológica. Em vista do risco de oscilações rápidas nas concentrações de sódio, e os sintomas de hiponatremia observados na faixa de referência baixa, é aconselhável manter as concentrações de sódio dentro da faixa de referência alta.
Desmopressina o análogo sintético de AVP foi introduzido pela primeira vez para tratamento de DI em 1972 (44). A maioria dos pacientes se dá bem com doses baixas de desmopressina administrada duas vezes ao dia. Há um equilíbrio fino e os níveis de sódio podem oscilar para níveis muito baixos com pequenas dosagens.
Nosso paciente se saiu muito bem em doses muito baixas de administrações parenterais, que é conhecido por ter a menor variabilidade em biodisponibilidade (45). A absorção das formulações intranasais é altamente variável, especialmente em crianças ou adultos com problemas cognitivos, pois podem não inalar a solução de forma consistente (46, 47). As formulações orais são uma boa opção, pois aumentar a dose levará a uma maior duração de ação, mas não tem efeito de pico (48-50). Tentamos esta forma em doses variáveis de 50-100 mcg, mas encontramos variações significativas nos efeitos dia a dia com esta formulação. A desmopressina sublingual (Minirin Melt) está disponível desde 2005. Estudos farmacológicos têm demonstrado que a via sublingual resulta em uma biodisponibilidade maior em ~60% quando comparada à via oral (49, 50). Doses refinadas de desmopressina sublingual podem ser obtidas cortando cada comprimido de 60 mcg, permitindo ajustes de dose de 65 a 90 mcg sublingual. Foi descrito o perfil farmacocinético semelhante de tais comprimidos divididos (51). Sabe-se que a ingestão concomitante de alimentos diminui a taxa e a extensão da absorção em 40%, pelo que é melhor evitar qualquer consumo alimentar dentro de uma hora antes e depois da administração dos comprimidos de desmopressina sublingual. Recentemente foi descrito um protocolo detalhado de administração de líquidos com monitorização diária do sódio com dose fixa de desmopressina subcutânea (28), demonstrando a dificuldade na monitorização diária. Outro relato de caso recente (27) também relatou o uso da forma sublingual de desmopressina para DDA na dose de 60 e 120 mcg diariamente. O uso da desmopressina sublingual pode ser uma alternativa útil nos casos em que os efeitos ideais não podem ser alcançados com outras formulações. Estes pacientes requerem um monitoramento rigoroso do peso diário, volume de urina e ingestão de líquidos 24 horas por dia. Em vista dos defeitos cognitivos e de memória, esses pacientes tendem a ter, geralmente precisam de um cuidador para monitorar a ingestão de líquidos para garantir que estejam bebendo o volume necessário.
Na nossa revisão de casos, 6 pacientes tiveram uma remissão da DDA dos quais 2 estavam relacionados ao aneurisma ACOM (15, 16) e 4 estavam relacionados ao craniofaringioma (15, 26). Um paciente com neurosarcoidose teve uma remissão com terapia com Infliximab (39). Tais observações podem sugerir que ambos os osmoreceptores reguladores da sede e suas vias eferentes demonstram mais neuroplasticidade do que os reguladores da produção de AVP (26).
Conclusão
ADI é uma complicação extremamente rara de distúrbios hipotalâmicos que resulta em uma perda de função no centro da sede. Devido ao controle hierárquico do centro da sede, a ausência de sede também está associada à perda da regulação da vasopressina e da poliúria. Os sujeitos que sofrem de DDA precisam ser delicadamente administrados em baixas doses de desmopressina e equilíbrio hídrico. Com as abordagens atuais de monitoramento e cuidados personalizados, ainda não é possível imitar a osmoregulação quase fisiológica em tempo real.
Dados Disponibilidade
Todos os conjuntos de dados gerados para este estudo estão incluídos nos arquivos de manuscritos/suplementos.
Declaração de Ética
Consentimento Informado Escrito foi obtido do(s) indivíduo(s) para a publicação de quaisquer imagens ou dados potencialmente identificáveis incluídos neste artigo.
Consentimento para participar
Obtivemos permissão por escrito dos parentes mais próximos do paciente para escrever e publicar este manuscrito.
Contribuições do autor
RD foi o endocrinologista primário que gerenciou o equilíbrio hídrico do paciente, conceituou a idéia, escreveu o manuscrito, fez a revisão da literatura, adquiriu os dados, escreveu e revisou o manuscrito final. HC, AC e JH foram residentes envolvidos no manejo deste paciente, e revisaram o manuscrito final. HT foi o anestesista responsável por este paciente durante a fase de terapia intensiva, conceituou a idéia e avaliou criticamente o manuscrito final. KC foi o principal especialista em reabilitação responsável pela paciente, conceituou a idéia e avaliou criticamente o manuscrito final. BB conceitualizou a idéia e avaliou criticamente o manuscrito final.
Funding
RD foi apoiado em parte pelo Center Grant do National Medical Research Council (NMRC/CG/017/2013) e pelo National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Acreditos
Agradecemos à paciente e seus pais por nos permitirem escrever e publicar este manuscrito.
1. Eisenberg Y, Frohman LA. Adipsic diabetes insipidus: uma revisão. Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Anormalidades da regulação da sede. Int. Rim. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Uma proposta de sistema de classificação para malformações arteriovenosas. J Neurocirurgia. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. O uso do coma induzido por barbitúricos durante procedimentos neurocirúrgicos cerebrovasculares: uma revisão da literatura. Circ. Cérebro. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. Um sinal de osmolaridade do intestino ao cérebro controla a saciedade da sede. A natureza. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Arquitetura neural hierárquica subjacente à regulação da sede. Natureza. (2018) 555:204-9. doi: 10.1038/natureza25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regulação da sede e da libertação de vasopressina. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Dos órgãos circunventriculares sensoriais ao córtex cerebral: vias neurais que controlam a sede e a fome. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. O núcleo pré-óptico mediano: frente e centro para a regulação do fluido corporal, sódio, temperatura, sono e homeostase cardiovascular. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimunidade ao sensor do nível de sódio no cérebro causa hipernatremia essencial. Neurônio. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulação da secreção de vasopressina e sede na saúde e na doença. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. A base neural da sede homeostática e anticipatória. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrnrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulação da liberação de vasopressina em diabetes insípido adipsico. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Mecanismos moleculares que regulam a aquaporina-2 na conduta colectora dos rins. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Padrões heterogêneos de recuperação da sede em pacientes adultos com diabetes insípido adipsico. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Adaptação renal compensatória para manipulação de água em um paciente com diabetes insípido adipsico após a ruptura de um aneurisma da artéria comunicante anterior. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Diabetes adipsic hypothalamic insipidus após a clipagem do aneurisma da artéria comunicante anterior. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Bola SG, Vaidya B, Bayliss PH. Síndrome adipsic hipotálamica: diagnóstico e gestão. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsic hypernatremia and diabetes insipidus following anterior communicating artery aneurysm clipping: diagnostic and therapeutic challenges in the amnestic rehabilitation patient. Lesões cerebrais. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Hipernatremia crônica e hipotermia após hemorragia subaracnoidea. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia e hipotermia após hemorragia subaracnóidea. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Perspectivas clínicas sobre o diabetes insípido adipsico: uma grande série de casos. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Obesidade hipotalâmica complicada por diabetes insípido central adipsico após ressecção cirúrgica de um craniofaringioma. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Rabdomiólise grave devido a hipernatremia adipsica após cirurgia de craniofaringioma. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. Do desperdício de sal cerebral ao diabetes insípido com adipsia: relato de caso de uma criança com craniofaringioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Avaliação objetiva da recuperação da sede em pacientes com diabetes insípido adipsico. Pituitária. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Diabetes insípido adipsico secundário à ressecção do craniofaringioma. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Monitoramento diário do sódio e protocolo de ingestão de líquidos: prevenção de hospitalização recorrente em diabetes insípido adipsico. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia em um paciente com diabetes insípido. Rep. Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Gota juvenil e diabetes insípido adipsico: um relato de caso e revisão de literatura. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Hiperosmolaridade severa e hipernatremia em uma jovem adipsica. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Diabetes insípido adipsic após cirurgia da hipófise para um macroprolactinoma. Hipófise. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Hipernatremia adipsica sem lesões hipotalâmicas acompanhadas de auto-anticorpos para órgão subfornical. Pathol Cerebral. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hipoplasia do corpo caloso associado a hipernatremia adipsica e hipogonadotropinismo hipotalâmico: um relato de caso e revisão da literatura. Int. Pediatria. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Hipernatremia crônica de um defeito congênito na osmoregulação da sede e vasopressina. J Pediatra. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Hipernatremia essencial, hormônio antidiurético e secreção de neuro-hipofisina: resposta à clorpropamida. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Hipernatremia adipsica em duas irmãs. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Um caso de hipernatremia crônica com agenesia de corpus callosum. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiological remission and recovery of thirst appreciation after infliximab therapy in adipsic diabetes insipidus secondary to neurosarcoidosis. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Os órgãos circunventriculares: um atlas de anatomia comparativa e vascularização. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid hemorrhage. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Distúrbios do equilíbrio hídrico após neurocirurgia: a resposta trifásica revisitada. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Efeitos do DDAVP, um análogo sintético de vasopressina, em pacientes com diabetes insípido cranial. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmacocinética e farmacodinâmica da desmopressina administrada oralmente versus intravenosa durante o dia versus intravenosa durante a noite em homens saudáveis entre 55-70 anos de idade. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressin 30 anos em uso clínico: uma revisão de segurança. Curral Seguro de Drogas. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Tratamento da diabetes neuro-hipofisária insípida. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmacocinética de 1-deamino-8-D-arginina vasopressina após várias vias de administração em voluntários de saúde. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmacocinética, farmacodinâmica, eficácia a longo prazo e segurança da vasopressina oral 1-deamino-8-D-arginina em pacientes adultos com diabetes insípido central. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Farmacocinética plasmática da desmopressina após administração sublingual: um estudo exploratório de dose-escalação em voluntários saudáveis do sexo masculino. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Liofilizado de Desmopressina para o tratamento do diabetes insípido central: primeira experiência em lactentes muito jovens. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar