- Introdução
- Materiais e Métodos
- Critérios de Inclusão
- Estimulação ovariana e recuperação de ovócitos
- Política de transferência embrionária
- Medições de Resultados Primários e Análise Estatística
- Resultados
- Parâmetros de Oócitos e Embriões
- Resultados de gravidez e taxa acumulada de nascimento vivo (CLBR)
- Discussão
- Conclusão
- Dados Disponibilidade
- Declaração de Ética
- Contribuições do Autor
- Funding
- Conflito de interesses
- Conhecimento
Introdução
Recentemente um novo sistema, o critério POSEIDON, foi desenvolvido para classificar pacientes de infertilidade com baixo prognóstico submetidos a tratamento com tecnologia reprodutiva assistida (ART) (1). É um sistema útil para a identificação e classificação de pacientes com reserva ovariana prejudicada ou com resposta ovariana deficiente (POR), fornecendo orientações para o diagnóstico e manejo destas pacientes (2). Quatro subconjuntos foram sugeridos com base em parâmetros quantitativos e qualitativos, incluindo, idade, biomarcadores da reserva ovariana e resposta ovariana. Os novos critérios, ao introduzir uma estratificação mais detalhada da POR, reduziram significativamente a heterogeneidade das pacientes que cumprem os critérios de Bolonha (3), o que pode diferenciar os subconjuntos de pacientes dentro da população da POR que poderiam ser identificados e beneficiar de intervenções específicas (4). Embora os critérios POSEIDON tenham sido estabelecidos, juntamente com algumas recomendações de tratamento específicas propostas para os subgrupos específicos de pacientes (5), ainda não existem evidências suficientes para suportar a validade dos parâmetros utilizados nos critérios POSEIDON, bem como a avaliação dos resultados dos diferentes subgrupos.
Dentre os quatro grupos baseados nos critérios POSEIDON, o grupo 1 é, sem dúvida, o de melhor prognóstico, considerando sua idade mais jovem e reserva ovariana normal, enquanto o grupo 4 tem o pior prognóstico devido à idade avançada e à diminuição da reserva ovariana. No entanto, uma questão interessante é quem conseguiria um melhor resultado na gravidez, as mulheres mais velhas (grupo 2) com reserva ovariana normal ou as jovens (grupo 3) com reserva ovariana diminuída. A taxa cumulativa de nascimento vivo (CLBR) é considerada uma medida preferível para o sucesso do tratamento de FIV (6). Até o momento, houve muito poucos relatos sobre as RBCs dos quatro grupos de pacientes definidos pelos critérios POSEIDON.
As características e o prognóstico das pacientes devem ser usados para desenvolver estratégias de manejo clínico. O objetivo deste estudo é caracterizar os pacientes com baixo prognóstico, a fim de facilitar a tomada de decisões de tratamento. Neste estudo, foram analisadas as características basais e os resultados dos grupos de pacientes definidos pelos critérios POSEIDON, e foi proposta a CLBR resultante de um ciclo aspirado de fertilização in-vitro (FIV)/injeção de espermatozóides intravenosos (ICSI) como medida de desfecho primário para pacientes de baixo prognóstico submetidos ao tratamento de FIV (7).
Materiais e Métodos
Este estudo retrospectivo incluiu 18.455 ciclos de FIV recém aspirados com subsequentes transferências de embriões congelados de Janeiro de 2014 a Janeiro de 2017 no nosso centro. O resultado do nascimento vivo foi acompanhado durante pelo menos 2 anos até Janeiro de 2019. O estudo foi aprovado pelo Comitê de Ética para a Aplicação Clínica da Tecnologia Reprodutiva Humana Assistida do Hospital Northwest Women’s and Children’s Hospital (No. 2018002). O Comitê de Ética aprovou este estudo dispensou a necessidade de obter o consentimento livre e esclarecido. Todas as pesquisas foram realizadas de acordo com diretrizes e regulamentos relevantes.
Critérios de Inclusão
Patientes foram categorizados de acordo com os critérios do POSEIDON:
Pacientes de baixo prognóstico
Grupo 1 (n = 879 ciclos): Idade < 35, contagem de folículos anormais (AFC) ≥ 5, número de oócitos recuperados ≤ 9 no ciclo anterior;
Grupo 2 (n = 482 ciclos): Idade ≥ 35, AFC≥5, número de oócitos recuperados ≤ 9 no ciclo anterior;
Grupo 3 (n = 858 ciclos): Idade < 35, AFC < 5;
Grupo 4 (n = 1.306 ciclos): Idade ≥ 35, AFC < 5;
Pautoperigosos
Grupo 5 (n = 664 ciclos): AFC ≥ 5, estimulação ovariana anterior > 9 oócitos;
Grupo 6 (n = 13708 ciclos): AFC ≥ 5, nenhuma estimulação ovariana anterior.
Flow chart e procedimento de processamento de dados estão listados na Figura 1. As características demográficas e basais dos pacientes são apresentadas na Tabela 1.
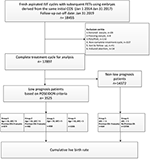
Figura 1. Fluxograma e processamento de dados.
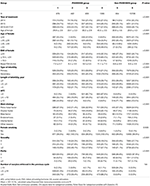
Tábua 1. Características demográficas e basais.
Estimulação ovariana e recuperação de ovócitos
O protocolo para estimulação ovariana (OS) foi determinado individualmente de acordo com a idade feminina, índice de massa corporal (IMC), hormônio estimulante do folículo basal (FSH) e contagem de folículos anormais (AFC). 94,33% dos pacientes com FIV receberam gonadotrofinas recombinantes e/ou urinárias (rFSH/hMG) no protocolo agonista de GnRH ou protocolo antagonista de GnRH seguido de FIV ou ICSI. Para mulheres com reserva ovariana diminuída, foi utilizado o protocolo de estimulação ovariana leve ou estimulação ovariana em fase luteal ou ciclo natural. A gonadotrofina humana menopausal (hMG, Li Zhu, China) foi adicionada no protocolo de ovulação leve ou protocolo de Xangai, de acordo com a resposta das pacientes à estimulação. A gonadotrofina coriônica humana (hCG) 4.000-10.000 UI ou hCG recombinante (r-hCG, MerckSerono S.p.A.) 250μg foi administrada quando 2-3 folículos atingiram o tamanho de 17 mm ou mais. Trinta e seis horas depois, a recuperação de oócitos foi realizada usando aspiração transvaginal guiada por ultra-sonografia. Os parâmetros de estimulação ovariana de cada grupo estão listados na Tabela 2.

Tábua 2. Parâmetros de estimulação ovariana.
Política de transferência embrionária
Os procedimentos de processamento de oócitos e desenvolvimento embrionário, bem como o sistema de pontuação embrionária foram descritos em nossos artigos anteriores (8, 9). Os embriões Graus 1-3 no dia 3 foram considerados embriões utilizáveis, e os Graus 1-2 foram considerados embriões de boa qualidade. Todas as transferências de embriões frescos (ETs) foram realizadas no dia 3 ou no dia 5. Em casos com número suficiente (≥ 3-4) de embriões de boa qualidade no dia 3, a transferência de blastocisto no dia 5 seria praticada. Além dos embriões transferidos, os embriões extras dos pacientes foram vitrificados no dia 3 ou na fase blastocitária (dia 5-6). Os embriões do estágio de clivagem Grau 1-3 no dia 3 e os blastocistos com escore Gardner acima de 4CC foram criopreservados (Cryo-top, sistema aberto, Kuwayama). Os métodos e o procedimento do ET congelado são detalhados em estudo de verificação anterior pela nossa equipa (8, 9). Se a implantação falhasse em ciclo fresco, a transferência de embriões congelados (FET) seria realizada utilizando os embriões vitrificados restantes ou blastocistos. Os pacientes com menos de 35 anos de idade com embriões de boa qualidade foram encorajados a receber uma transferência de um único embrião. Também foi aplicada uma política de transferência de embriões única para as pacientes com útero anormal (por exemplo, útero cicatrizado, malformação uterina) e/ou outros casos conflitantes com a gravidez gêmea. A injeção intramuscular de progesterona (60 mg/dia) foi administrada para suporte da fase luteal desde o dia da recuperação dos oócitos até uma beta-hCG sérica negativa ou 8 semanas de gravidez.
Medições de Resultados Primários e Análise Estatística
O resultado primário foi o nascimento vivo cumulativo (CLB) definido como pelo menos um nascimento vivo resultante de um ciclo de ART aspirado no ET fresco ou no FET subsequente em relação ao número de oócitos recuperados. O numerador do cálculo CLBR foi a soma dos nascidos vivos alcançados nos FETs e dos nascidos vivos em ciclos frescos. Somente o primeiro parto foi contado na análise se um paciente obteve múltiplos partos. A CLBR foi definida como o nascimento vivo cumulativo por aspiração de oócitos transvaginal de acordo com a definição terminológica (7, 10). Um ciclo de tratamento completo refere-se a um ciclo de tratamento que atingiu o nascimento vivo ou a um ciclo de tratamento que não atingiu o nascimento vivo com todos os embriões transferidos. A taxa acumulada de nascidos vivos neste estudo foi calculada com base no ciclo de tratamento completo, portanto os pacientes (n = 337) de tratamento não completo foram excluídos.
O processamento de dados e a análise estatística foram realizados usando o software EmpowerStats (www.empowerstats.com) e os pacotes de software estatístico R. Para avaliar o odds ratio (OR) da CLBR em diferentes grupos de pacientes, foi estabelecido um modelo de regressão de múltiplas variáveis com potenciais fatores de confusão como as variáveis e ajustadas para o ano de tratamento, IMC feminino, tipo de infertilidade, tempo de infertilidade, gravidez, paridade, etiologia principal, protocolo OS, tipo de gonadotrofina e dose inicial de FSH. Os pacientes foram inscritos por 3 anos, durante os quais o procedimento de FIV foi revisado. Para eliminar o viés causado por este fator, a taxa cumulativa de nascimento vivo foi ajustada para o ano de tratamento. IMC feminino, tipo de infertilidade, duração da infertilidade, gravidade, paridade e principal etiologia foram fatores importantes que afetaram a gravidez e o nascimento vivo através da experiência ou literatura. Protocolo OS, tipo de gonadotrofina e dose inicial de FSH são os indicadores chave para afetar o número de oócitos recuperados e, finalmente, a chance cumulativa de nascidos vivos.
Resultados
Parâmetros de Oócitos e Embriões

Tabela 3. Parâmetros de oócitos e embriões e CLBRs.
Resultados de gravidez e taxa acumulada de nascimento vivo (CLBR)
Inconsistente com o padrão de distribuição do número de oócitos e embriões por grupo, as CLBRs na ordem do mais alto para o mais baixo foi de 44.6% no grupo 1(n = 879), 35,5% no grupo 3(n = 858), 24,5% no grupo 2 (n = 482) e 12,7% no grupo 4 (n = 1306). Uma análise de regressão de múltiplas variáveis foi realizada com variáveis que podem atuar como fatores de confusão descritos nas Tabelas 1 e 2. Os odds ratios (ORs) ajustados da CLBR com seus intervalos de confiança (ICs) de 95% foram mostrados na Tabela 4. Consistente com a tendência de resultados não ajustados, a CLBR no grupo 3 (OR 0,9, IC 95% 0,7-1,2, p = 0,615) foi ligeiramente inferior e o grupo 5 (OR 1,3, IC 95% 0,9-1,7, p = 0,111) foi ligeiramente superior à CLBR no grupo 1 sem diferença estatística significativa. A CLBR no grupo 2 foi significativamente menor do que no grupo 1 (OR 0,6, IC 95% 0,4-0,8, p = 0,004) e a CLBR no grupo 4 foi a menor (OR 0,4, IC 95% 0,3-0,6, p < 0,001) em comparação ao grupo 1. A Tabela 5 mostrou os resultados da gravidez por transferência ou FET em pacientes com baixo prognóstico. As taxas de implantação nos grupos idosos (grupo 2 e grupo 4) foram significativamente menores do que nos grupos jovens (grupo 1 e grupo 3).

Tabela 4. Análise de regressão logística para CLBRs.

Tabela 5. Resultados da gravidez por transferência de embriões frescos e congelados em pacientes com baixo prognóstico.
Figure 2 mostrou o gráfico de tendências dos principais eventos em pacientes com baixo prognóstico. Houve um cruzamento de linhas de tendência entre o grupo 2 e o grupo 3 após a transferência embrionária. Os pacientes do grupo 2 (idade ≥35; AFC ≥ 5) apresentaram maior AFC, mais oócitos recuperados, mais embriões e mais embriões de boa qualidade, mas diminuíram a taxa de implante e CLBR. Pelo contrário, embora os pacientes do grupo 3 (idade < 35 anos; AFC < 5) tivessem menos oócitos e embriões, a CLBR mostrou-se superior à do grupo 2. A análise SWOT de 4 grupos de pacientes de baixo prognóstico definidos pelos critérios POSEIDON é mostrada na Figura 3.
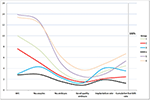
Figura 2. Gráfico de tendências de eventos chave em pacientes de baixo prognóstico. Houve um cruzamento de linhas de tendência entre o grupo 2 (vermelho) e o grupo 3 (azul) após a transferência embrionária. O eixo X representa o número médio de AFC, número de oócitos, número de embriões, número de embriões de boa qualidade, taxa de implantação e taxa de nascimento vivo acumulado. O eixo Y à esquerda representa o número das primeiras quatro variáveis (n) e o eixo Y à direita representa a taxa das duas últimas variáveis (%).

Figura 3. Análise SWOT de 4 grupos de pacientes de baixo prognóstico definidos pelos critérios POSEIDON.
Discussão
A principal constatação deste estudo retrospectivo na população definida pelos critérios POSEIDON foi que a CLBR foi maior no grupo 1, seguida pelo grupo 3 e grupo 2, e menor no grupo 4. De acordo com nossos resultados, a CLBR das mulheres jovens com reserva ovariana pobre (grupo 3) foi ligeiramente inferior à das mulheres jovens com boa reserva ovariana e resposta anterior baixa (grupo 1). Embora as pacientes do grupo 2 (idade ≥ 35; AFC ≥ 5) tivessem melhor reserva ovariana, mais oócitos e mais embriões, a CLBR e a taxa de implantação, ao contrário, foram menores do que nas pacientes do grupo 3 com reserva ovariana mais pobre, menos oócitos e menos embriões. Este achado pode facilitar o desenvolvimento de estratégias de manejo para pacientes de baixo prognóstico.
Os critérios inovadores do POSEIDON visam identificar e estratificar pacientes de baixo prognóstico em quatro grupos distintos com base na idade feminina, AFC e resposta ovariana no ciclo anterior (4). As pacientes do grupo 2 foram caracterizadas por boa reserva ovariana e idade avançada, exatamente o oposto das pacientes do grupo 3 com reserva ovariana ruim, mas estão em idade mais jovem. Estudos (11-13) mostraram que a CLBR aumenta com o número de oócitos recuperados mesmo nas mulheres de idade avançada (14). Foi sugerido que o número de oócitos recuperados é uma variável muito importante independentemente associada à CLBR. Os pacientes do grupo 2 com maior número de oócitos deveriam ter um prognóstico melhor do que os pacientes do grupo 3, pois os pacientes do grupo 2 tinham mais embriões para transferir. Entretanto, a CLBR e a taxa de implante foram inversamente maiores no grupo 2 do que no grupo 3,
Nossos resultados são consistentes com estudos anteriores (15, 16) sobre a associação da reserva ovariana e o resultado da gravidez. Chang et al. (15) verificaram que houve menores taxas de fertilização normal, clivagem, embriões de alta qualidade, implantação e gravidez em mulheres mais velhas do que em mulheres mais jovens com diminuição da reserva ovariana. A principal razão foi o impacto adverso do envelhecimento do oócito no resultado da gravidez (baixa taxa de implantação e alta taxa de perda de gravidez) devido a anormalidades cromossômicas (17) e disfunção citoplasmática (18). O declínio na fertilidade com o envelhecimento envolve tanto a quantidade quanto a qualidade do oócito. O implante e o aborto estão relacionados à qualidade dos oócitos, mas não necessariamente à reserva ovariana (16). A reserva ovariana justa no grupo 2 aumentaria a possibilidade de obtenção de mais oócitos e embriões para transferência, mas ao mesmo tempo, a maior taxa de aneuploidia levaria a baixa taxa de implantação e alta taxa de aborto.
Em termos do tratamento dos pacientes do grupo 2, deve ser dada mais atenção ao desenvolvimento de estratégias para melhorar a qualidade dos oócitos do que a quantidade de oócitos ou de embriões. Como mais embriões são obtidos no dia 3 no grupo 2, cultivar embriões para o estágio de blastocisto para transferência é uma boa opção. Os embriões do dia 5-6 têm menor taxa de aneuploidia segmentar (19) e maior viabilidade para implantação (20) do que os embriões do dia 2-3. Os testes genéticos pré-implantação para aneuploidias (PGT-A) também são benéficos para mulheres avançadas selecionarem um embrião euploide para transferência (21). Um regime ideal de estimulação ovariana para melhorar a qualidade dos oócitos (22, 23) poderia ser uma opção alternativa. Suplementos como a desidroepiandrosterona foram tentados para melhorar o desenvolvimento folicular (24), embora não haja evidências suficientes para apoiar seu uso nessas pacientes.
As pacientes do grupo 3 (idade < 35; AFC < 5) tinham uma reserva ovariana pobre, que se esperava que fossem más respondentes com mau resultado na gravidez. Curiosamente, a taxa de produção de oócitos (145,3% de oócitos recuperados por AFC) no grupo 3 foi significativamente maior do que nos outros grupos, embora a dose inicial de FSH não tenha sido significativamente aumentada (Tabela 2). Isto sugere que a resposta dos folículos antrais à gonadotropina pode ter atingido o limite de sua capacidade, portanto não haverá benefício adicional no número de oócitos para aumentar ainda mais as doses diárias de gonadotrofina (25). A avaliação da sensibilidade ovariana à FSH é um elemento chave para melhorar as taxas de sucesso da FIV nestes pacientes de baixo prognóstico e abrir novas perspectivas de tratamento (26). A alta taxa de produção de oócitos por AFC no grupo 3 também apoiou a recomendação relatada de dose máxima diária de 300 IU rFSH (5). Para os pacientes do grupo 3, mais esforços devem ser concentrados no aumento do número de oócitos, uma vez que o resultado clínico da gravidez é assegurado quando os oócitos são adquiridos.
Os pacientes do grupo 5 foram os pacientes de prognóstico não baixo que tiveram boa resposta ovariana (mais de 9 oócitos na recuperação anterior), porém a maioria destes pacientes não conseguiu nascer vivos no ciclo de FIV anterior. Comparando com outras pacientes de prognóstico não baixo com o primeiro tratamento de FIV (grupo 6), embora as pacientes do grupo 5 tenham mais AFC e número de oócitos recuperados, o desenvolvimento embrionário e o resultado da gravidez foram inferiores aos do grupo 6. Portanto, o fracasso nas primeiras pacientes de FIV com boa resposta ovariana pode ser o mau prognóstico para o tratamento posterior da FIV.
O fator pelvico-tubal é a causa mais comum de infertilidade, sendo responsável por cerca de 10,8-78,3% das mulheres inférteis na China (27, 28). O fator tubal envolve principalmente oclusão tubária e patologia peritoneal causando aderências, que foi diagnosticada por histerossalpingografia e laparoscopia. A causa prevalente da infertilidade do fator tubal foi atribuída à doença inflamatória pélvica (DIP), salpingite e endometriose (29). Nos grupos de pacientes deste estudo, o fator tubal é a principal etiologia da infertilidade, variando de 62,9 a 71,4%, que foi maior do que em mulheres de infertilidade de outros países e regiões. Portanto, deve-se ter o cuidado de interpretar as implicações mais amplas dos achados.
Limitações estão relacionadas à natureza retrospectiva do estudo e o fato de os dados serem de um único centro também enfraquece a universalidade de nossas observações. Outras limitações potenciais podem ser que o protocolo análogo não-GnRH foi utilizado em algumas mulheres com reserva ovariana diminuída e não naquelas com reserva ovariana normal. Os novos ciclos que não produziram nenhum oócito não foram incluídos neste estudo, por exemplo, ciclos com cancelamento da estimulação ovariana.
Os resultados deste estudo podem fornecer novos insights para o desenvolvimento de estratégias de manejo para pacientes de baixo prognóstico. Uma análise SWOT foi realizada para auxiliar o manejo de pacientes de mau prognóstico em clínica, que foi extraída dos relatórios POSEIDON (1, 2, 4, 5) e dos dados deste estudo. A resposta dos folículos antrais à gonadotrofina foi extremamente maior no grupo 3 do que nos outros grupos. Considerando o gratificante resultado da CLBR no grupo 3, a fim de aumentar a produção de ovócitos, sugerimos que se tente mais estimulações ovarianas, mas não mais duras, através da dose diária excessiva de gonadotrofina. Embora as pacientes do grupo 2 tenham mais reserva ovariana, bem como mais oócitos e embriões, a CLBR foi menor do que o esperado. A estratégia de manejo para o grupo 2 deve ser melhorar a taxa de nascimento vivo ao invés de aumentar o número de oócitos recuperados.
Conclusão
Em conclusão, inconsistente com o padrão de distribuição da quantidade de oócitos e quantidade de embriões por grupo de pacientes, as CLBRs na ordem de maior para menor estavam no grupo 1 (mulheres jovens com boa reserva ovariana), grupo 3 (mulheres jovens com reserva ovariana ruim), grupo 2 (mulheres em idade avançada com boa reserva ovariana), e finalmente no grupo 4 (mulheres em idade avançada com reserva ovariana ruim.
Dados Disponibilidade
Os dados brutos que suportam as conclusões deste manuscrito serão disponibilizados pelos autores, sem reserva indevida, a qualquer pesquisador qualificado.
Declaração de Ética
O estudo foi aprovado pelo Comitê de Ética para a Aplicação Clínica da Tecnologia Reprodutiva Humana Assistida do Northwest Women’s and Children’s Hospital (No. 2018002). O comitê de ética que aprovou este estudo renunciou à necessidade de obter o consentimento livre e esclarecido. Toda a pesquisa foi realizada de acordo com as diretrizes e regulamentos relevantes.
Contribuições do Autor
WS e JS conceberam e desenharam o estudo. A WS e a WZ redigiram e revisaram o manuscrito. WS, ZZ, e WZ analisaram e interpretaram os dados. LT, ZZ, e HZ coletaram e limparam os dados. Todos os autores leram e aprovaram a versão final do manuscrito.
Funding
O estudo foi financiado pelos Projectos Gerais de Desenvolvimento Social na Província de Shaanxi (No. 2018SF-247) e pelo Programa de Formação de Pessoal do Hospital de Mulheres e Crianças do Noroeste (2018ZD02).
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Conhecimento
Agradecemos a todos os clínicos, cientistas e embriologistas do Northwest Women and Children’s Hospital pela assistência na coleta de dados, e a todas as pacientes pela contribuição para este estudo. Agradecemos à Dra. Xinglin Chen do Departamento de Epidemiologia e Bioestatística, X&Y solutions Inc. em Boston pela sua contribuição para o suporte estatístico.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. Uma nova estratificação mais detalhada dos ovarianos de baixa resposta à estimulação ovariana: de uma má resposta ovariana a um conceito de baixo prognóstico. Esterilização Fertil. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. A nova estratificação POSEIDON de “Pacientes de baixo prognóstico em tecnologia reprodutiva assistida” e sua proposta de marcador de sucesso. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definindo pacientes de baixo prognóstico submetidos à tecnologia reprodutiva assistida: Critérios POSEIDON – o porquê. Endocrinol frontal. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Factores relacionados com a gravidez clínica após transferência de embriões aquecidos vitrificados: uma análise de regressão logística retrospectiva e multivariada de 2313 ciclos de transferência. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Taxas cumulativas de nascimento vivo de acordo com o número de oócitos recuperados após a primeira estimulação ovariana para fertilização in vitro/injeção de espermatozóides intra-uterino: uma análise multinacional multicêntrica que inclui aproximadamente 15.000 mulheres. Esterilização Fertil. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Associação entre o número de oócitos recuperados e a taxa cumulativa de nascimento vivo em mulheres com 35-40 anos de idade submetidas a longos ciclos de FIV/ICSI agonistas de GnRH. Arco Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Prognóstico cumulativo da taxa de nascimentos vivos com base no número de oócitos aspirados nos ciclos ART anteriores. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Taxas acumuladas de nascimento vivo e número de oócitos recuperados em mulheres de idade avançada. Uma análise de centro único incluindo 4500 mulheres >/ = 38 anos de idade. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Qualidade do ovo e resultado da gravidez em jovens mulheres inférteis com diminuição da reserva ovariana. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bispo LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. A diminuição da reserva ovariana medida por meio da hormona estimulante do folículo basal e da contagem de folículos astrais não está associada à perda de gravidez em pacientes mais jovens com fertilização in vitro. Esterilização Fertil. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Oocyte aging under under female reproductive aging: biological mechanisms and therapeutic strategies. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. A incidência e origem da aneuploidia segmentar em oócitos humanos e embriões pré-implantados. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparação dos resultados da gravidez após vitrificação na fase de clivagem e blastocisto: uma meta-análise. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. A estimulação ovariana na fase luteal pode melhorar a recuperação dos ovócitos e a qualidade dos ovócitos em pessoas com baixa resposta ovariana submetidas à fertilização in vitro: resultados preliminares de um estudo piloto prospectivo de um único centro. Adv. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Eficácia da desidroepiandrosterona (DHEA) para superar o efeito do envelhecimento ovariano (DITTO): uma prova de princípio duplamente cega de ensaio aleatório controlado por placebo. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Entendendo a taxa de saída folicular (FORT) e suas implicações para os critérios POSEIDON. Endocrinol frontal. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Estudo Epidemiológico sobre Infertilidade em Três Províncias da China. Tese de Doutorado, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologia e etiologia da infertilidade do oviduto. J Saúde Reprodutiva/Investimento Familiar. (2016) 35:212-216.
Google Scholar