Quando o hidrogénio está ligado de forma covalente a um átomo altamente electro-negativo, como flúor, cloro, oxigénio ou nitrogénio, o átomo H tem uma carga positiva parcial, escrita Hδ+.
Hδ+ é fisicamente muito pequeno, portanto a densidade de carga sobre ele é excepcionalmente alta.
Imagine outro átomo negativo ou eletronegativo, digamos em uma molécula diferente, aproxima-se do Hδ+; haverá atração mútua, resultando em uma atração dipolo-dipolo particularmente forte.Esta atracção é chamada uma ligação de hidrogénio.
Em geral, as ligações de hidrogénio são mais fracas que as ligações iónicas e covalentes, mas são mais fortes que as forças de van der Waals.

Aglutinação de hidrogênio em água
O exemplo mais conhecido de ligação de hidrogênio é a água:
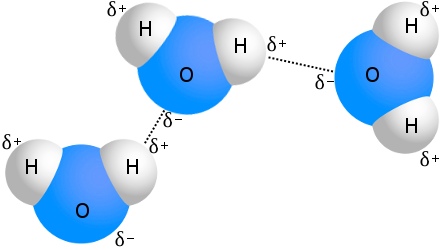
Todas as moléculas de água podem ser ligadas ao hidrogênio com até quatro outras moléculas de água.Em água à temperatura ambiente, o número médio de ligações de hidrogênio por molécula de água é 3,6,
O movimento térmico aleatório das moléculas assegura que a vida útil de qualquer ligação de hidrogênio individual em água é curta, com uma média de apenas 10 picossegundos.No entanto, o tempo para formar uma nova ligação é ainda mais curto.
Para quebrar permanentemente uma única ligação de hidrogênio na água leva 21 kJ mol-1, uma entrada significativa de energia.
Aglutinação de Hidrogénio em Água vs Sulfureto de Hidrogénio
Sulfur está no grupo 16 da tabela periódica, o mesmo que o oxigénio. O enxofre é mais pesado que o oxigênio, portanto o H2S deve ter pontos de fusão e ebulição mais altos que o H2O. Entretanto, este não é o caso porque o enxofre é menos eletronegativo que o oxigênio, e portanto a ligação de hidrogênio em H2S é fraca.

Mol. Massa: 16
Melt Pt.: 0.00 °C
Boil Pt.: 99.98 °C
Electronegatividade do O (Pauling): 3.44
Entalpia de ligação ao hidrogénio: 21 kJ mol-1

Mol. Massa: 34
Massa de S (Pauling): -82 °C
Massa de S (Pauling): -60 °C
Electronegatividade de S (Pauling): 2.58
Entalpia de ligação ao hidrogênio: ≅ 3 kJ mol-1
Ligação ao hidrogênio em amônia e fluoreto de hidrogênio
Fluorine e nitrogênio são os elementos mais eletronegativos em seus grupos de tabela periódica, e a ligação ao hidrogênio é observada em fluoreto de hidrogênio e amônia.
Como no caso da água, o flúor de hidrogênio e os pontos de fusão e ebulição do amoníaco são superiores aos hidretos de elementos mais pesados em seus grupos.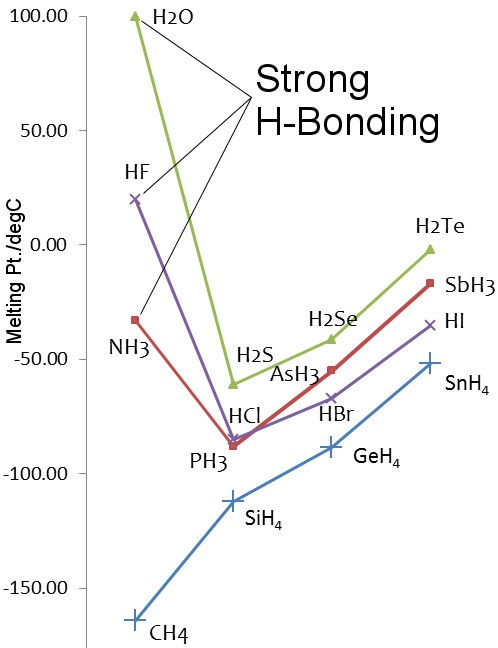
Ligação do hidrogênio no DNA
Os pares de bases do ADN ligam suas duas cadeias de hélices.
Se uma peça de vestuário de lã é lavada a alta temperatura, as ligações de hidrogênio são destruídas, as bobinas perdem sua elasticidade, e a peça se torna mishapen.
