O QUE É UMA ANOMALIA CORONÁRIA CONGENITAL DA ARTE CORONÁRIA?
Está em curso um debate sobre o que deve ser considerado normal e o que deve ser considerado uma anomalia arterial coronária (AAC). Segundo Angelini1, as AAC são diagnosticadas por exclusão, o que significa que, nos casos em que a morfologia da artéria coronária não é normal, define-se a normalidade segundo um critério estatístico (intervalo entre mais ou menos 2 desvios padrão do valor médio). Assim, um AAC seria aquela morfologia arterial coronariana observada em menos de 1% da população geral.1,2 Os AAC podem ser produzidos durante a cardiogênese normal ou patológica: no primeiro caso, o resultado seria um AAC isolado, sobre o qual nos concentramos neste artigo, enquanto, no segundo caso, estariam associados a outras malformações cardíacas.
CLASSIFICAÇÃO
Existem várias classificações.1-3 Uma nova que tenta padronizar critérios diagnósticos e grupos de AAC de acordo com 7 categorias foi recentemente proposta4 (Tabela 1).

>
 >
>Grupos internacionais estão chamando por registros incluindo pelo menos aquelas anomalias que causam a maioria dos eventos clínicos (morte súbita e isquemia miocárdica) atribuídos à AAC,5-7 constituído por aqueles originários do seio contralateral ou “errado” de Valsalva. Este grupo inclui artérias coronárias de vaso único (“hiperdominância” na classificação de Rigatelli et al4), uma vez que elas têm que fornecer sangue ao miocárdio proveniente de um óstio coronário único e estabelecer rotas que ocasionalmente são similares às do CEA com origem no seio errado de Valsalva (Figura 1).
>

Figure 1. Arteriografia coronária em projeção oblíqua anterior esquerda mostrando um único vaso da artéria coronária direita.
INCIDÊNCIA
As diferentes definições ou classificações e a análise tanto das séries angiográficas8,9 quanto das séries de autópsia10 e, nos últimos anos, das séries ecocardiográficas11 resultam em uma incidência relatada de AAC que varia entre 0,1% e 8,4%,1,8,11 tornando difícil estabelecer a magnitude exata do problema que representam. Em geral, a incidência pode ser bastante semelhante à de outras doenças que temos sido capazes de definir com mais precisão, tais como a cardiomiopatia hipertrófica (0,2%)12 ou a síndrome de Wolff-Parkinson-White (0,1% a 0,3%).13
A incidência de artérias coronárias anômalas com origem no seio errado e artérias coronárias de vaso único nos estudos angiográficos coronários varia entre 0.28% e 1,74%.2,3,8,9,14-16 Dada sua importância clínica, vamos focar nossa revisão nestas anomalias.
Apresentação clínica
Aniicialmente, estas anomalias foram diagnosticadas durante a angiografia coronária realizada em pacientes com doença valvar ou cardiopatia isquêmica, e foram consideradas como não tendo significado clínico. Posteriormente, começaram a surgir relatos de morte súbita em atletas jovens, nos quais o único sinal de doença era uma anomalia com origem nas artérias coronárias.8,17
O espectro clínico na apresentação é variável: enquanto alguns pacientes são assintomáticos, outros apresentam angina, dispnéia, síncope, infarto agudo do miocárdio, insuficiência cardíaca e morte súbita.1,2,5,8,17-20 Currenthy, CAA são consideradas como a segunda causa mais comum de morte súbita em atletas nos Estados Unidos.21
Isso significa que todas as CAA devem ser consideradas como indicando alto risco? Absolutamente não, mas do ponto de vista estratégico, elas devem ser consideradas “potencialmente malignas” até que testes adicionais sejam realizados para descartar isquemia miocárdica provocada pela anomalia.
A maior preocupação está em determinar qual CEA pode apresentar com morte súbita. Hoje, sabemos que aqueles que seguem um curso interarterial (ou intramural), aqueles em que a artéria coronária anômala é a dominante e aqueles que produzem sinais clínicos em pacientes com menos de 30 ou 35 anos de idade são aqueles em que a incidência de morte súbita é maior.22-26
Por este motivo, nossa abordagem para um AIO deve ser diferente, dependendo da idade do paciente. Nos jovens, com menos de 35 anos de idade, “focaremos” na prevenção da morte súbita, enquanto naqueles com mais de 35 anos de idade, o objetivo maior será tratar a isquemia miocárdica (Figura 2).
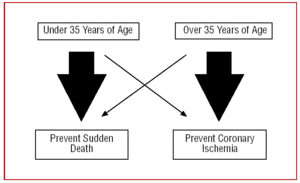
Figure 2. Abordagem diferente de acordo com a idade do paciente.
Ocasionalmente, devido à sua origem e curso anômalo, as AAC podem ser danificadas durante a cirurgia para troca valvar, mas isto também pode ocorrer durante o fechamento oval do forame percutâneo. Por este motivo, a presença de AAC deve ser descartada antes de intervenções deste tipo.27-30
PATHOPHYSIOLOGY OF ISCHEMIA IN CORONARY ANOMALIES
Existem várias teorias31 para explicar os mecanismos que produzem isquemia em AAC, mas nenhuma delas foi claramente demonstrada. Em uma delas, a causa é considerada a angulação marcada da artéria anômala onde ela emerge da aorta. Em contraste com uma artéria coronária normal, que é perpendicular à aorta na sua origem, a artéria coronária anômala tem que se dobrar sobre si mesma para alcançar, a partir do seio oposto de Valsalva, o seu território de suprimento normal. Por isso, o óstio da artéria coronária anômala seria menor, com cristas tipo valvar, em comparação ao óstio circular normal, e poderia se comprimir no caso de uma expansão acentuada da aorta, como a observada durante o exercício extenuante.32
A outra teoria refere-se ao curso inicial da AAC. Quando é interarterial, entre a aorta e a artéria pulmonar, o aumento da pressão nos 2 vasos, ocorrendo durante o esforço, produziria uma compressão da artéria coronária anômala.33 Além disso, se a via inicial for intramural, a obstrução pode ser aumentada, pois a artéria coronária pode se deformar dentro da parede aórtica durante os períodos de hipertensão.34
Alguns autores consideram que o mecanismo que conduz à toisquemia envolve a produção de um espasmo na artéria coronária anômala como resultado do dano endotelial produzido pelo trajeto anômalo,35 e outros, que uma intussuscepção da porção proximal da AAC na parede aórtica seria produzida.31
Finalmente, todos os mecanismos discutidos podem produzir isquemia aguda ou crônica (eventos isquêmicos menores) que provocam fibrose miocárdica que, por sua vez, poderia ser a causa da geração de arritmias letais.36
COMO É UM DIAGNÓSTICO CORONARIZADO?
O diagnóstico requer um alto índice de suspeita e a avaliação de sua presença sob certas circunstâncias. Como mencionamos acima, a maioria das AAC é descoberta incidentalmente durante angiografias coronarianas realizadas em pacientes com cardiopatia isquêmica ou doença valvar submetida a este estudo antes da cirurgia para troca valvar.
Young people who present no coronary risk factors or associated valve disease represent the greatest diagnostic challenge. Devemos suspeitar de uma AAC na presença de síncope de esforço, dispnéia ou dor torácica indicativa de angina.24,26,35 Evidentemente, o primeiro teste diagnóstico que todos nós realizamos é a ergometria padrão. Entretanto, isto não tem se mostrado muito útil no tipo de paciente, pois geralmente é negativo, fato que indica que a isquemia devida à AAC apresenta-se apenas ocasionalmente.35,36
Assim, uma vez que testes “funcionais” não são de grande ajuda, temos que optar por um estudo de imagem que nos permita examinar a anatomia coronariana. O teste não-invasivo inicialmente recomendado é o ecocardiograma transtorácico (ETT)7,26,37-40. Na maioria desses pacientes, a realização do ETT simples na projeção do eixo curto paraesternal no plano da raiz da aorta permite distinguir os dois óstios coronarianos e até mesmo determinar o curso inicial do AIO. Pellicia et al estudaram 1360 atletas de elite por meio do ecocardiograma, visualizando o óstio e a porção proximal da artéria coronária principal esquerda em 97% dos casos e a artéria coronária principal direita em 80%.34 realizaram ecocardiografia em todas as crianças e adolescentes (faixa etária de 3 meses a 20 anos) encaminhados ao seu hospital (1997-2002) com sintomas de isquemia miocárdica, suspeita de cardiopatia congênita ou dor músculo-esquelética. Todos eles foram submetidos a TTE convencional com o auxílio do mapeamento do fluxo de cor Doppler para determinar a direção do fluxo sanguíneo. Identificaram 10 pacientes com origem anômala de uma artéria coronária no seio errado (6 pacientes com artéria coronária esquerda originando-se no seio direito de Valsalva e 4 com artéria coronária direita originando-se no seio esquerdo de Valsalva). Utilizando TTE com técnicas de Doppler colorido, observaram um curso intramural dentro da parede aórtica em nove dos pacientes e um curso intramiocárdico no paciente remanescente. Quando o curso de um AAC originado no seio errado é intramural, pode parecer emergir do seu óstio normal. Assim, os autores recomendam a utilização de Doppler colorido para determinar a direção do fluxo quando for necessário descartar a presença de uma anomalia.
Improvações nas técnicas de imagem ecocardiográfica nos permitem determinar a origem e seguir o curso inicial de um AAC em determinados grupos de pacientes. Estudos têm sido realizados em crianças, adolescentes e atletas de elite, mas grandes séries envolvendo a população adulta normal ainda não foram estudadas. Assim, a identificação dos óstios coronarianos em pacientes jovens com essa sintomatologia deve ser realizada sistematicamente no exame de TTE.7,26
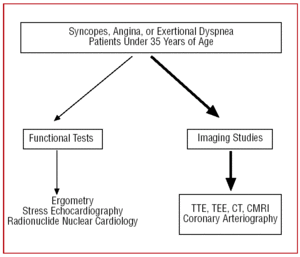
Em pacientes com má janela ecocardiográfica, ou quando a dúvida diagnóstica persiste apesar das indicações clínicas, para permitir a visualização da origem e curso inicial da AAC, pode ser realizada ecocardiografia transesofágica (ETE),7,26,42,43 tomografia computadorizada (TC)26,44-46-(Figura 3) ou ressonância magnética cardíaca (RMC)26,47,48 (Figura 4).

Figure 3. Imagem de tomografia computadorizada multidetectores mostrando artéria coronária circunflexa (Cx) com origem na artéria coronária direita (DC), seguindo um curso retroaórtico para chegar ao seu território de distribuição normal. Ao indica aorta; AP, artéria pulmonar. Cortesia do Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Espanha.
>
 >
>>
>
>>
Figure 4. Protocolo de diagnóstico proposto em pacientes com menos de 35 anos de idade com suspeita de anomalia arterial coronária. CMRI indica ressonância magnética cardíaca; TC, tomografia computadorizada; ETE, ecocardiografia transesofágica; ETT, ecocardiografia transtorácica.
Qual técnica devemos utilizar e em que ordem? Cada equipe médica deve responder a esta pergunta de acordo com as técnicas disponíveis e sua experiência. O que devemos fazer é identificar o CEA e seu curso inicial por meio da técnica menos invasiva disponível. Embora o ETE tenha sido utilizado no diagnóstico e identificação do curso inicial de algumas CEA, consideramos que, dada a sua natureza semi-invasiva, só deve ser utilizado depois de outras técnicas terem falhado. Hoje, devido à crescente disponibilidade e às excelentes imagens tridimensionais que podem ser obtidas, parece prudente optar pela TC multidetectores (Figura 5) ou pela RMC.49,50 A arteriografia coronária padrão seria indicada se os outros exames não resultassem em um diagnóstico definitivo. A este respeito, recomenda-se a 36ª Conferência de Bethesda51 para a seleção de atletas competitivos com anomalias cardiovasculares, publicada em abril de 2005: “As anomalias coronarianas devem ser consideradas em atletas com síncope de esforço ou arritmia ventricular sintomática e devem ser investigadas com estudos apropriados, como ecocardiografia, RMC ou tomografia computadorizada ultra-rápida. A angiografia coronária é indicada se outros estudos não forem diagnósticos”. Em resumo, eles não optam por 1 estudo diagnóstico ou outro.
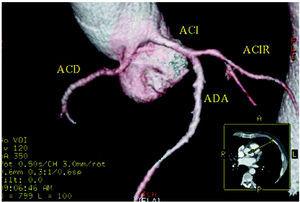
Figure 5. Tomografia computadorizada multislice (16 fatias); reconstrução tridimensional renderizada mostrando artéria coronária direita (ACD) originada no seio de Valsalva esquerdo. Indiactes ACI artéria coronária esquerda; ACIR, artéria coronária circunflexa; ADA, artéria coronária descendente anterior. Cortesia do Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Espanha.
Em pacientes acima de 35 anos de idade que apresentam sinais clínicos de angina ou síncope repetida, após o teste funcional (ergometria, ecocardiografia de exercício, etc.), geralmente é realizado um cateterismo, uma vez que a maior incidência de aterosclerose leva a uma suspeita de doença arterial coronária. Em determinados centros equipados com a tecnologia, pacientes com quadro clínico atípico podem ser submetidos ao rastreamento inicial com TC multidetectores ou CRMI. Em qualquer circunstância, a AAC seria um achado (Figura 6).
>
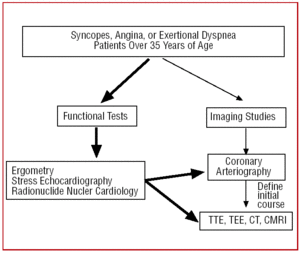
Figure 6. Protocolo de diagnóstico proposto em pacientes acima de 35 anos de idade com suspeita de anomalia arterial coronária. CRM indica ressonância magnética cardíaca; TC, tomografia computadorizada; ETE, ecocardiografia transesofágica; TTE, ecocardiografia transtorácica.
COMO É O CURSO INICIAL DE UMA ANOMALIDADE CORONÁRIA IDENTIFICADA?
Este é um dos pontos mais complexos do estudo da AAC e constitui um aspecto fundamental na identificação do risco.
Para começar, temos de ter em conta que o nome e a natureza de uma artéria coronária são definidos pelo território que fornecem e não pela sua origem. Assim, uma coronária que surge do seio direito de Valsalva e ramos fora para suprir os territórios das artérias descendente anterior e circunflexa (Cx), não é uma artéria coronária direita, mas uma artéria coronária principal esquerda com origem no seio errado. Quando uma artéria coronária surge do seio errado, o nome, a natureza e mesmo a função permanecem os mesmos; apenas sua origem e curso inicial são anômalos.2
Após emergir do seio errado de Valsalva, uma artéria coronária anômala pode alcançar seu território de suprimento normal por pelo menos cinco rotas diferentes2,52:
1. Retrocardíaco, atrás das valvas mitral e tricúspide.
2. Retroaórtica, geralmente seguida pelo Cx com origem no seio direito de Valsalva ou na artéria coronária direita, adjacente à parede aórtica posterior, no sulco entre o átrio e a aorta (seio transverso) (Figura 3).
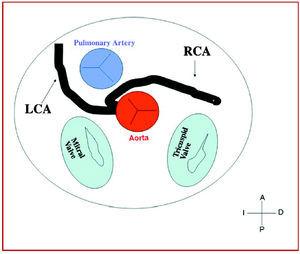
Figure 7. Diagrama mostrando o curso interarterial de uma artéria coronária direita (ACD) originária do seio controlateral.
>
>>
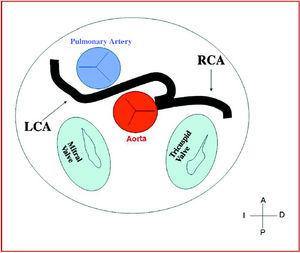
Figure 8. Diagrama mostrando o curso interarterial de uma artéria coronária esquerda (ACV) originada no seio controlateral.
4. Intraseptal, através da porção superior do septo intraventricular. É intramiocárdica na maioria dos casos e é reconhecida na angiografia por causa do estreitamento sistólico, semelhante a uma ponte miocárdica, e porque geralmente há 1 ou 2 ramos perfurantes septal nesta zona (Figura 9).
>
 >
>Figure 9. Diagrama mostrando o curso intraseptal de uma artéria coronária esquerda (IC) originada no seio direito de Valsalva.
>5. Pré-cardíaco ou pré-pulmonar, caracterizado pela sua localização subepicárdica, na parede anterior da via de saída do ventrículo direito ou infundíbulo. Esta passagem é geralmente seguida por uma anômala coronária direita, haste principal esquerda ou artéria coronária descendente anterior esquerda.
Outros possíveis cursos ou mesmo vários cursos em um determinado paciente foram relatados.2
Como estes cursos iniciais podem ser identificados pela angiografia coronária? Inicialmente, considerou-se que a introdução de um fio-guia na artéria pulmonar seguida de arteriografia coronária em projeção lateral seria suficiente para determinar a relação entre a anomalia e os grandes vasos. Entretanto, esta técnica é de valor limitado, pois, por exemplo, em vista lateral, tanto o curso septal quanto o interarterial parecem estar localizados posterior à artéria pulmonar e anterior à aorta quando, na realidade, o curso septal está localizado caudalmente a ambos os vasos.53
Diferentes características angiográficas coronárias para o reconhecimento da anomalia e seu curso inicial, mesmo antes da visualização, também têm sido relatadas. A este respeito, Page et al54 propõem dois sinais que nos permitem reconhecer uma origem anômala do Cx e seu curso inicial:
1. O sinal “myocardium unperfused”. Durante a opacificação seletiva da artéria coronária esquerda, podemos observar uma área avascular na zona póstero-lateral do ventrículo esquerdo que indica a origem anômala do Cx. Primeiro é necessário injetar um meio de contraste no seio coronariano esquerdo para descartar o envolvimento de óstios independentes das artérias descendente anterior e Cx. Entretanto, se a identificação do Cx não for clara, devemos lembrar que é mais comum observar o Cx originado no seio coronariano direito ou na artéria coronária direita do que a presença de óstios separados no seio coronariano esquerdo.55
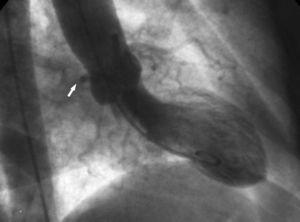
2. O sinal de “raiz aórtica”. Na ventriculografia, a projeção oblíqua anterior direita mostra o contorno do Cx anômalo e segue seu curso ao passar atrás do seio coronariano direito (Figura 10).
>
>
>
>
Figure 10. Ventriculografia em projeção oblíqua anterior direita mostrando o contorno da artéria circunflexa anômala (seta) passando atrás do seio coronariano direito; este é conhecido como o sinal da raiz aórtica ou sinal de Page.
Em 1985, Ishikawa et al,56 seguidos por Serota et al em 1990,57 propuseram uma série de critérios arteriográficos coronarianos destinados a definir a relação, ao longo do curso inicial, entre o vaso anômalo e a aorta e a artéria pulmonar (Figura 11). Esses autores tentaram identificar os diferentes cursos com base na orientação do “loop” formado pela artéria coronária anômala com o restante da árvore coronária56 ou aplicando o conceito de “ponto” (visualização da coluna de contraste da AAC que, por sua vez, adota a morfologia de um ponto57).
>
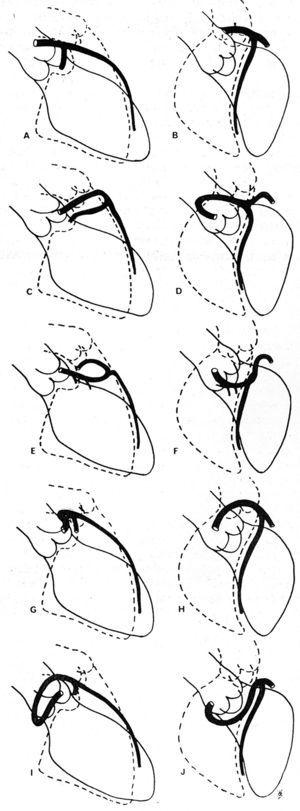
Figure 11. Ilustrações de imagens angiográficas das artérias coronárias descendente anterior esquerda e circunflexa proximal em projeção oblíqua anterior direita (A, C, E, G, I) e em projeção oblíqua anterior esquerda (B, D, F, H, J), mostrando os diferentes percursos iniciais possíveis de uma artéria coronária esquerda originada no seio direito de Valsalva. A e B representam uma artéria coronária normal; C e D mostram “loop” anterocraniano, descrito no curso anterior; E e F: “loop” anterocraniano, curso septal; G e H: “loop” póstero-crânio, curso interarterial; I e J: “loop” póstero-crânio, curso retroaórtico. Extraído de Ishikawa et al.56
Em muitos casos, a identificação do curso inicial da AAC por meio da angiografia coronária é difícil, pois esta técnica proporciona uma visão bidimensional da árvore coronária, que é uma estrutura tridimensional complexa. Cardiologista intervencionista experiente no diagnóstico de AAC, a angiografia coronária pode ser suficiente para a correta identificação do curso. Entretanto, dada a sua baixa incidência, a maioria dos cardiologistas intervencionistas tem uma experiência limitada no estudo de AAC. Assim, na grande maioria dos casos, eles não são adequadamente descritos. Em um registro recente envolvendo 13 hospitais espanhóis, o curso inicial de um CEA relatado não foi identificado na maioria dos casos.16
Assim, em muitas ocasiões, a identificação do curso inicial de um CEA com origem no seio errado requer uma técnica de imagem adicional. Como mencionamos acima, tanto TTE quanto ETE podem ser empregados para este fim, mas, dada a crescente disponibilidade em nossos hospitais de técnicas não invasivas que proporcionam uma definição mais correta e exata da anatomia coronariana e sua relação com estruturas adjacentes em pacientes que podem ser candidatos à cirurgia, optamos pela RM ou TC multidetectores.35,37,47,49
O QUE É A MELHOR ABORDAGEM TERAPÊUTICA?
Este é um dos aspectos mais controversos desta condição, uma vez que não foram estabelecidas directrizes oficiais a este respeito.
Após a CEA ter sido diagnosticada e caracterizada, pareceria lógico tentar determinar se ela está ou não a provocar isquemia miocárdica. Se o paciente teve um infarto do miocárdio (sem relação demonstrável com aterosclerose) ou se foi submetido a reanimação por morte súbita atribuível à anomalia e tem menos de 35 anos de idade, a maioria dos autores recomenda a revascularização.24,26,35
Uma prova de estresse com tálio ou ecocardiografia sob estresse induzido por drogas ou exercício demonstrando isquemia reversível no território da anomalia ajudará no processo de tomada de decisão.36
O que deve ser feito no caso de indivíduos jovens, assintomáticos, nos quais a CEA é descoberta incidentalmente se os critérios de risco forem atendidos, mas a prova de estresse não produz nenhuma evidência de isquemia? Primeiro, o paciente deve adotar um estilo de vida sedentário.26,35
Corrado et al. compararam a morte súbita em atletas jovens e não-atletas e apenas aqueles atribuídos à AAC ou à displasia arritmogênica do ventrículo direito foram associados ao esforço.58 Com relação ao tratamento, a revascularização é controversa, mas há autores que optam por esta abordagem, uma vez que, nestes pacientes, a morte súbita é imprevisível e pode ser o primeiro sinal de AAC.24,26,34,35 Alguns autores apóiam visitas anuais de acompanhamento nestes casos, com ecocardiogramas ou testes de estresse de tálio, e baseiam suas decisões nos resultados.7,36 Após o tratamento cirúrgico, os pacientes desfrutam de um estilo de vida normal, incluindo a participação em esportes.25,34,49
Em pacientes acima de 35 anos de idade, as decisões devem ser tomadas de forma individualizada. O risco de morte súbita é menor mas, como a AAC pode provocar isquemia miocárdica sintomática, em alguns casos a revascularização é realizada (Figura 12).24,26
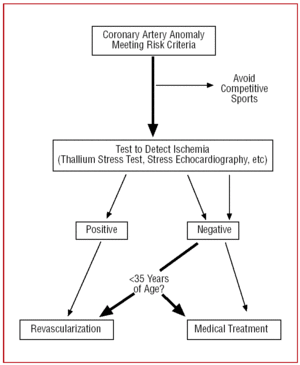
Figure 12. Protocolo terapêutico proposto para anomalias coronarianas com origem no seio contralateral de Valsalva na presença de fatores de risco.
Alguns grupos estão investigando a utilização de certos protocolos diagnósticos (ecocardiograma intracoronariano para avaliar o óstio coronariano anômalo em repouso e após infusão de dobutamina ou sobrecarga de líquido)59 ou a utilização de fios de pressão intracoronariana para detectar isquemia.60
Como pode ser observado, até que diretrizes oficiais sejam estabelecidas nesta matéria, a abordagem mais razoável pareceria ser, primeiro, confirmar se a idade do paciente e a anatomia da AAC estão associadas ao risco e, segundo, verificar se a isquemia coronariana (apresentada pelo paciente ou demonstrada) é claramente provocada pela anomalia.
COMO A REVASCULARIZAÇÃO DEVERÁ SER REALIZADA?
Logicamente, é necessário tratar cada caso de forma individualizada de acordo com a anatomia coronariana; assim, a revascularização pode ser cirúrgica ou percutânea.
A revascularização cirúrgica envolve bypass aortocoronário, reimplante ostial ou a técnica de desobstrução, que liberta o segmento intramural do CEA por meio de uma incisão na parede compartilhada pelo CEA e a aorta, criando assim um novo orifício maior no seio apropriado.61,62 Há uma grande controvérsia em relação à revascularização cirúrgica nestes pacientes, especialmente em jovens. A cirurgia de revascularização do miocárdio tem sido fortemente criticada7,63 devido à sua patência “limitada” e ao inevitável fluxo competitivo entre o bypass e a AAC. Assim, a técnica de desobstrução, que parece mais fisiológica,62 está sendo cada vez mais adotada.
Intervenção percutânea, com implante de stents na região de compressão entre os grandes vasos e no óstio anômalo, tem sido realizada em vários casos, em adultos, com sucesso a curto prazo.64 Até hoje, a revascularização cirúrgica é preferida em pacientes jovens e o procedimento percutâneo é realizado apenas em adultos.26,62-64 Evidentemente, em ambos os casos, é necessário um seguimento a longo prazo.
SUA OPÇÃO DE TRATAMENTO MÉDICO?
A falta de séries e estudos controlados dificulta a resposta a esta questão. Há relatos envolvendo o seguimento de 2 anos e 5 anos em pacientes que ou pacientes que recusaram a cirurgia, nos quais a abordagem foi ou o manejo expectante ou o tratamento com beta-bloqueadores, e entre os quais não houve casos de morte súbita.65-68 Entretanto, alguns autores argumentam contra a decisão de iniciar tratamento “vitalício” em crianças e adolescentes.7
MAIOR PROBLEMAS NÃO SOLVADOS
O verdadeiro risco de morte súbita associada a cada anomalia é desconhecido.5 A razão para isso é que o risco é calculado com base em estudos de autópsia, que não indicam o risco real de uma pessoa morrer como resultado de uma CAA, mas sugerem a possibilidade de uma pessoa que tenha experimentado morte súbita ter uma CAA.7 Além disso, os riscos calculados podem ser superestimados em relação à população em geral, uma vez que são obtidos de séries de atletas competitivos que, como foi relatado, têm um risco duas vezes maior de morte súbita do que uma pessoa sedentária.69 Sabemos que o risco de morte súbita devido a uma AAC é maior em jovens; de fato, uma ou outra abordagem terapêutica é recomendada, dependendo se o paciente tem menos de 30 ou 35 anos de idade. Estes pontos de corte são baseados nos poucos estudos que tratam deste assunto23,25 e, portanto, devem ser considerados meramente indicativos. Por este motivo, a abordagem terapêutica deve ser sempre decidida individualmente.
Se a solução cirúrgica descrita acima for adotada, deve-se levar em conta que não há séries em que o curso dos pacientes tenha sido estudado por mais de dois anos. À incerteza quanto à patência do bypass acrescenta-se o possível dano à válvula aórtica que o procedimento de desenrolamento pode produzir. A esse respeito, há relatos de insuficiência aórtica ou mesmo troca valvar após esse procedimento.7,70 Devemos lembrar que a cirurgia cardíaca sempre acarreta risco de complicações neurológicas, cuja incidência em jovens tem sido estimada em torno de 2,3%.71
Finalmente, as diretrizes para a seleção de atletas competitivos com anomalias cardiovasculares recomendam a exclusão de pacientes com AAC de todos os esportes competitivos.51 Mais uma vez, os dados de uma população de atletas foram extrapolados para a população geral. Em um adolescente, o termo “competitivo” pode ser difícil de definir. Além disso, proibir um adolescente ou jovem adulto de participar de aulas de ginástica ou do esporte de que ele ou ela pode desfrutar pode causar mais danos do que benefícios. Talvez esportes extenuantes devam ser evitados, mas não um esporte menos exigente.7
CONCLUSÃO
Artérias coronárias originadas no seio errado de Valsalva constituem o grupo de AAC mais comumente associado à isquemia miocárdica e, em particular, à morte súbita.
O índice de suspeita desta anomalia deve ser alto em pacientes jovens que apresentem sinais clínicos de angina, dispnéia ou síncope de esforço. Nestes casos, o TTE deve ser realizado na tentativa de identificar os óstios e o curso inicial de ambas as artérias coronárias.
Devemos definir claramente o curso inicial de cada artéria coronária anômala, utilizando técnicas de imagem como TTE, ETE ou, preferencialmente, TC multidetectores ou RM, de acordo com as características do nosso hospital.
Devemos dar prioridade ao estabelecimento de registros nacionais e internacionais que nos permitam determinar a incidência dessas anomalias, bem como as taxas associadas de morbidade e mortalidade, prognóstico, tratamento, possíveis influências genéticas ou ambientais e, em suma, aprender o máximo sobre isso.
É necessário realizar um acompanhamento a longo prazo dos pacientes que foram submetidos à cirurgia para AAC, especialmente os jovens. Em qualquer caso, a revascularização (cirúrgica ou percutânea) pode ser válida para pacientes com este tipo de doença.
ACONHECIMENTOS
Agradecemos ao Dr. Joaquín Alonso e ao Dr. Gabriel C. Fernández pela ajuda na obtenção das imagens de tomografia computadorizada multidetectores.