Introdução
ß amilóide e proteínas tau fosforiladas são marcas patológicas da doença de Alzheimer (DA) que se acumulam e se espalham de forma previsível através de redes neurais distribuídas, causando anormalidades metabólicas progressivas, lesão neuronal e morte celular. A neuroimagem facilita uma avaliação detalhada dessas alterações patológicas em pacientes submetidos a exercícios para o declínio cognitivo. Anteriormente, o diagnóstico definitivo da DA só era possível pela observação post-mortem e estadiamento neuroanatômico desses agregados protéicos. Avanços recentes em imagem molecular, entretanto, permitem a visualização de depósitos amilóides e tau no cérebro humano vivo e nos aproximaram de um diagnóstico definitivo in vivo da DA.
Imagens estruturais
As diretrizes da Academia Americana de Neurologia (AAN) para o trabalho diagnóstico de pessoas com queixas cognitivas1 recomendam imagens estruturais do cérebro com TC ou RM não-contraste em qualquer pessoa com história clínica positiva e alterações cognitivas objetivas. Neste contexto, o papel principal da imagem cerebral é descartar lesões estruturais não degenerativas, 5% das quais podem não ser evidentes na história clínica ou no exame físico2 e são potencialmente tratáveis. A AAN também recomenda excluir clinicamente a demência vascular (VaD), a demência com corpo de Lewy (DLB) e a demência frontotemporal (FTD). A imagem estrutural pode melhorar a certeza diagnóstica e alterar o diagnóstico clínico em 19% a 28%, bem como o manejo de 15% dos casos clínicos.2
As modalidades de imagem de escolha ao avaliar a atrofia estrutural são a TC e a RM. Os padrões de atrofia específicos da doença têm sido descritos e validados minuciosamente usando essas modalidades. Embora a atrofia seja observável na TC, a resolução espacial inerentemente mais baixa e o contraste cinza/matéria branca inferior resultam na perda de observações sutis potencialmente úteis em relação às alterações neurodegenerativas. Portanto, os clínicos frequentemente confiam na RM para avaliar o padrão e gravidade das alterações estruturais, para descartar causas não neurodegenerativas do declínio cognitivo e para avaliar a gravidade e extensão das alterações de matéria branca como discutido em maiores detalhes abaixo.
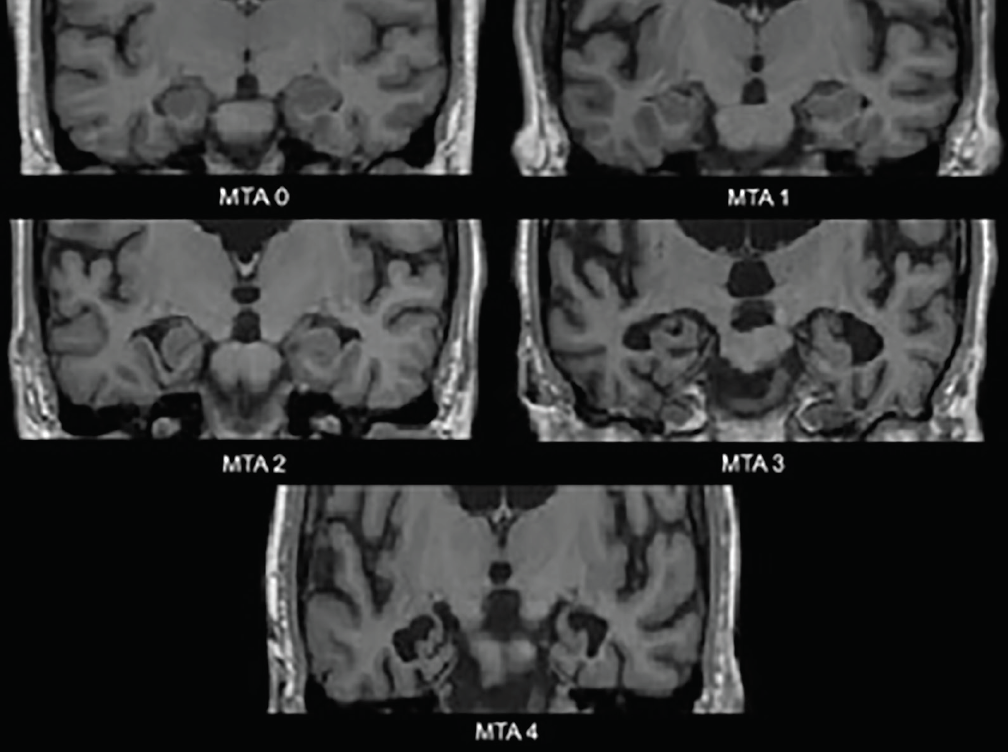
As primeiras alterações neurodegenerativas na DA ocorrem nos lobos temporais mediais – hipocampo, córtex entorhinal e giro parahipocampal. À medida que a atrofia se instala, a fissura coróide e o corno temporal do ventrículo lateral tornam-se dilatados; estas alterações são melhor avaliadas no plano coronal. Uma escala de avaliação visual comumente usada com base nessas estruturas – a escala de atrofia temporal medial (ATM) (Figura 1) – foi clinicamente3 e neuropatologicamente4 validada. Vários estudos utilizando esta escala ou as estruturas que ela avalia têm demonstrado capacidade significativa de discriminar pessoas com DA a partir de controles de idade4 ou com DLB4 ou comprometimento cognitivo vascular (ICV).5 A atrofia temporal medial também é preditiva de conversão de um comprometimento cognitivo leve amnésico (ICM) para demência de Alzheimer.3
Click to view larger
Figure 1. Classificação da escala de atrofia temporal medial (MTA). MTA 0-não ao espaçamento mínimo da fissura coróide; MTA 1-alargamento da fissura coróide; MTA 2-alargamento adicional da fissura coróide que se funde com o corno temporal do ventrículo lateral, leve diminuição da altura da formação hipocampal; MTA 3-diminuição moderada da altura da formação hipocampal, aumento proeminente do corno temporal do ventrículo lateral; MTA 4-diminuição severa da altura da formação hipocampal, aumento proeminente do corno temporal do ventrículo lateral.
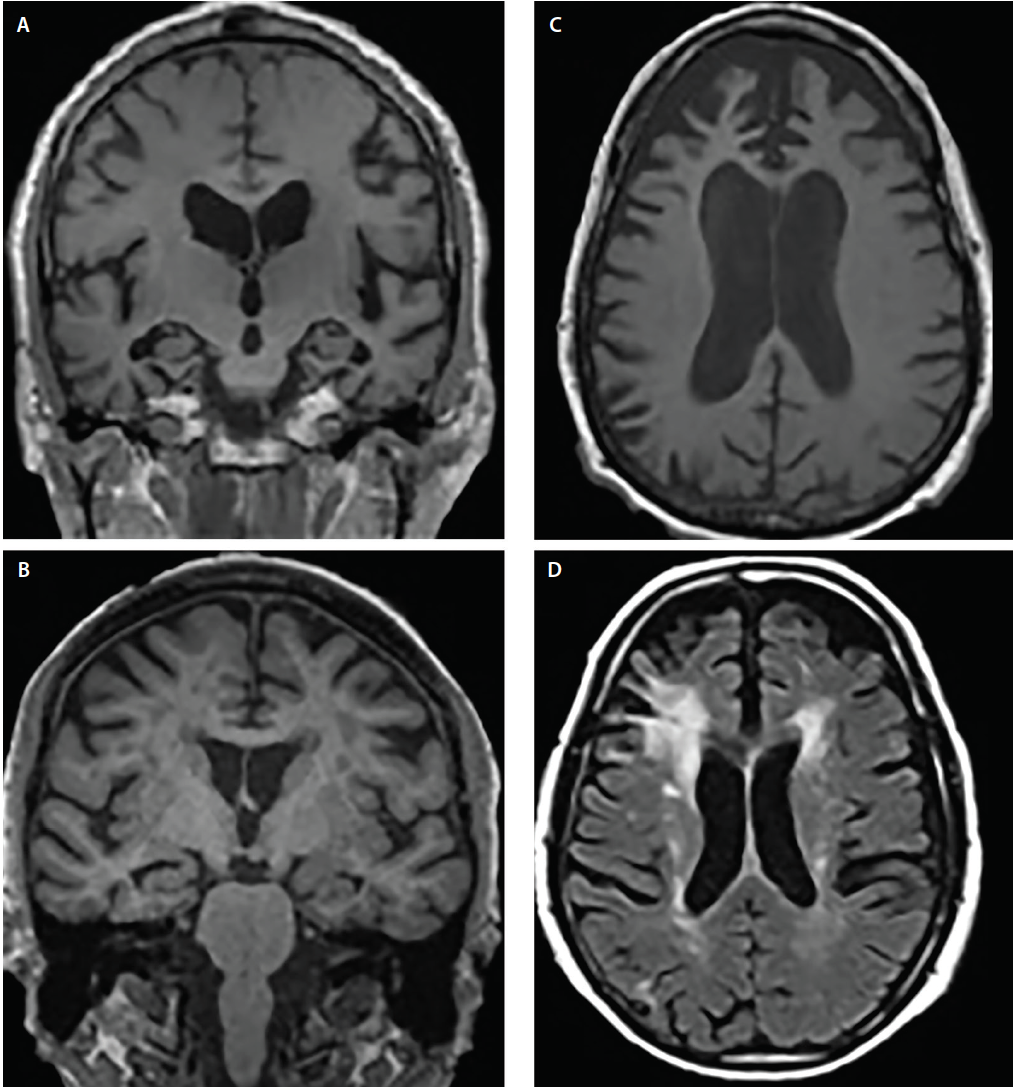
As síndromes de demência tipicamente exibem padrões de atrofia canônica6 que correspondem a sintomas cognitivos e comportamentais; entretanto, as estruturas envolvidas podem se sobrepor. Por exemplo, tanto o AD quanto a DLB mostram envolvimento do lobo temporal medial, mas vários estudos de imagem e neuropatológicos têm mostrado que, em relação ao AD, a DLB tem significativamente menos predileção pelas estruturas temporais mediais4,5 (Figura 2).
Click to view larger
Figure 2. Padrões de atrofia estrutural através da doença de Alzheimer (AD) (A), demência com corpos de Lewy (DLB) (B), demência frontotemporal (FTD) (C) e demência vascular (VaD) (D). A RM coronal em T1 demonstra atrofia cortical generalizada, mas diferentes graus de atrofia hipocampal em DA (A) e DLB (B). A RM axial em T1 demonstra atrofia bvFTD com predileção focal para os corticais prefrontais medial e lateral (C). A ressonância magnética axial em T2 demonstra hipointensidades confluentes da capa periventricular e halo da matéria branca (WMH) envolvendo a coroa radiada e estendendo-se para o neocórtex pré-frontal lateral, WMHs discretamente dispersos e WMHs do revestimento ventricular subependymal e septum pelúcido em VaD (D).
ADA e a degeneração lobar frontotemporal (DfT) têm regiões de atrofia sobrepostas, incluindo áreas de corticais prefrontal, orbitofrontal e anterior, assim como os lobos temporal anterior e medial.6 Em relação umas às outras, entretanto, a DA mostra significativamente mais atrofia nos corticais parietal lateral e occipital, enquanto a DFP mostra mais atrofia nos lobos frontais (Figura 2).6
É importante avaliar sistematicamente todas as áreas do cérebro, observando regiões de atrofia estrutural e poupador anatômico para se fazer o máximo uso de imagens diagnósticas. Um grande estudo multicêntrico avaliou recentemente a capacidade de 6 escalas de classificação visual para classificar corretamente 186 casos patologicamente confirmados de DA, DLB e FTLD.6 Este estudo mostrou que a avaliação simultânea de múltiplas regiões específicas da doença proporcionou uma discriminação significativamente melhor do que o foco em uma única área.4
Dano vascular é uma consideração importante ao avaliar indivíduos com comprometimento cognitivo. A alteração isquêmica é comum no envelhecimento normal e é acelerada por comorbidades comuns (por exemplo, hipertensão, diabetes e hipercolesterolemia). As contribuições vasculares ao comprometimento cognitivo são frequentemente inferidas quando são detectadas hiperintensidades significativas de matéria branca (WMH), derrames corticais ou lacunas estrategicamente localizadas em sequências ponderadas em T2 ou recuperação de inversão atenuada por fluido (FLAIR). Os AVCs lacunares dos gânglios basais e WMH no semiovale central e na corona radiata são indicadores de lesão isquêmica crônica de pequenos vasos (Figura 2). Em contraste, as tampas periventriculares são frequentemente de origem não isquêmica e refletem gliose subependymal.7 Existem várias escalas de gravidade WMH (por exemplo, a escala de Fazekas)7 que podem ser usadas em ambientes clínicos. Tais algoritmos de pontuação concordam todos que a WMH confluente generalizada e os infartos lacunares subcorticais são, pelo menos em parte, provavelmente fatores que contribuem para o declínio cognitivo.7
Diffusion tensor imaging (DTI) é uma nova sequência de RMN sensível à difusão de água através de tecidos que avalia a integridade da matéria branca porque a arquitetura dos axônios restringe o fluxo de água. Medidas de difusividade média e anisotropia fracionária são frequentemente usadas para caracterizar alterações neurodegenerativas no DTI. A primeira mede a magnitude da difusão e a segunda mede se a água está fluindo preferencialmente em uma única direção, como esperado em axônios saudáveis. Diminuição da difusividade média e redução da anisotropia fracionária têm sido consistentemente relatadas tanto na população de ICM quanto na população de DA demência.8 Vários estudos também identificaram alterações do DTI em indivíduos assintomáticos em risco de desenvolver DA9 indicando que essas alterações ocorrem precocemente no curso da doença. Além de avaliar a integridade da matéria branca, o DTI pode ser usado para modelar a conectividade estrutural bruta entre regiões corticais usando algoritmos de tractografia. Isso tem ganho tração no campo da DA, pois evidências sugerem que a amilóide e a tau patologia podem se propagar via conexões cerebrais.10 Embora o DTI mostre potencial como medida de integridade da matéria branca, sua sensibilidade ao movimento e outras restrições técnicas limitam, pelo menos por enquanto, sua aplicação clínica.
Functional Imaging
O hipometabolismo cerebral é prontamente observado em distúrbios neurodegenerativos e pode auxiliar no diagnóstico diferencial. A função neuronal é dependente do oxigênio e da glicose do sangue, cujo fornecimento é facilitado pela vasodilatação regional. A tomografia por emissão de fluorodeoxiglicose pósitron (FDG-PET) reflete indiretamente o grau de atividade cortical e pode ser facilmente utilizada para visualizar alterações neurodegenerativas, explorando esta dependência metabólica da glicose.
A assinatura cortical hipometabólica característica da DA consiste em alterações precoces no cingulado posterior (PCC); precuneus; córtices temporal, parietal e, em estágios posteriores, frontal. Este padrão manifesta-se de forma precoce, mesmo pré-sintomática11 e é clinicamente útil para distinguir o AD do TCE.12 Ao contrário do AD, a assinatura metabólica do TCE revela hipometabolismo frontal, temporal anterior, gangliar basal e talâmico com relativa escassez de corticais de associação posterior13. Em situações clinicamente incertas, os clínicos podem usar essas assinaturas metabólicas para desambiguar a DA da TCE.12 Da mesma forma, embora a assinatura metabólica neocortical da DLB possa ter uma sobreposição confusa com a da DA, os casos de DLB também podem mostrar hipometabolismo occipital.14
O Center for Medicare &Os Serviços Médicos consideram a FDG-PET “razoável e necessária” apenas para aqueles que atendem aos critérios tanto para a DA quanto para a TCE, nos quais o trabalho diagnóstico completo de acordo com as diretrizes da AAN1 não estabeleceu definitivamente uma etiologia.15
Ressonância magnética funcional (RMF) também pode medir a atividade cerebral usando seqüências sensíveis a mudanças temporais na hemoglobina oxigenada/deoxigenada devido à atividade cerebral. Desta forma, a fMRI está relacionada à FDG-PET porque as alterações na hemoglobina são impulsionadas pelo metabolismo da glicose necessário para a atividade cerebral. As dependências temporais entre regiões podem ser usadas para inferir a conectividade funcional (ou seja, quais regiões estão se comunicando ativamente). Em comparação com o FDG-PET, a fMRI oferece melhor resolução espacial, permitindo um mapeamento mais preciso da conectividade. Outra vantagem do fMRI é que ele pode ser adquirido durante o desempenho de uma tarefa ou em repouso. O primeiro identifica padrões de conectividade impulsionados por estados ativos específicos, enquanto o segundo identifica padrões de conectividade presentes em repouso, conhecidos como rede de modo padrão (DMN). O DMN é definido pelos hubs funcionais, o PCC e o precuneus, que se conectam a um subsistema medial dorsal e a um subsistema temporal medial.16 Pensa-se que o depósito amilóide começa nos hubs funcionais do DMN. O DMN é conhecido por ser afetado no AD.16 Em contraste, o DMN é poupado na FTD enquanto a saliência ou redes de atenção são afetadas.17 Atualmente, a tecnologia fMRI está limitada a aplicações de pesquisa, mas caminhos para desenvolver algoritmos relevantes clinicamente aplicáveis estão sendo ativamente explorados.
Imagem molecular
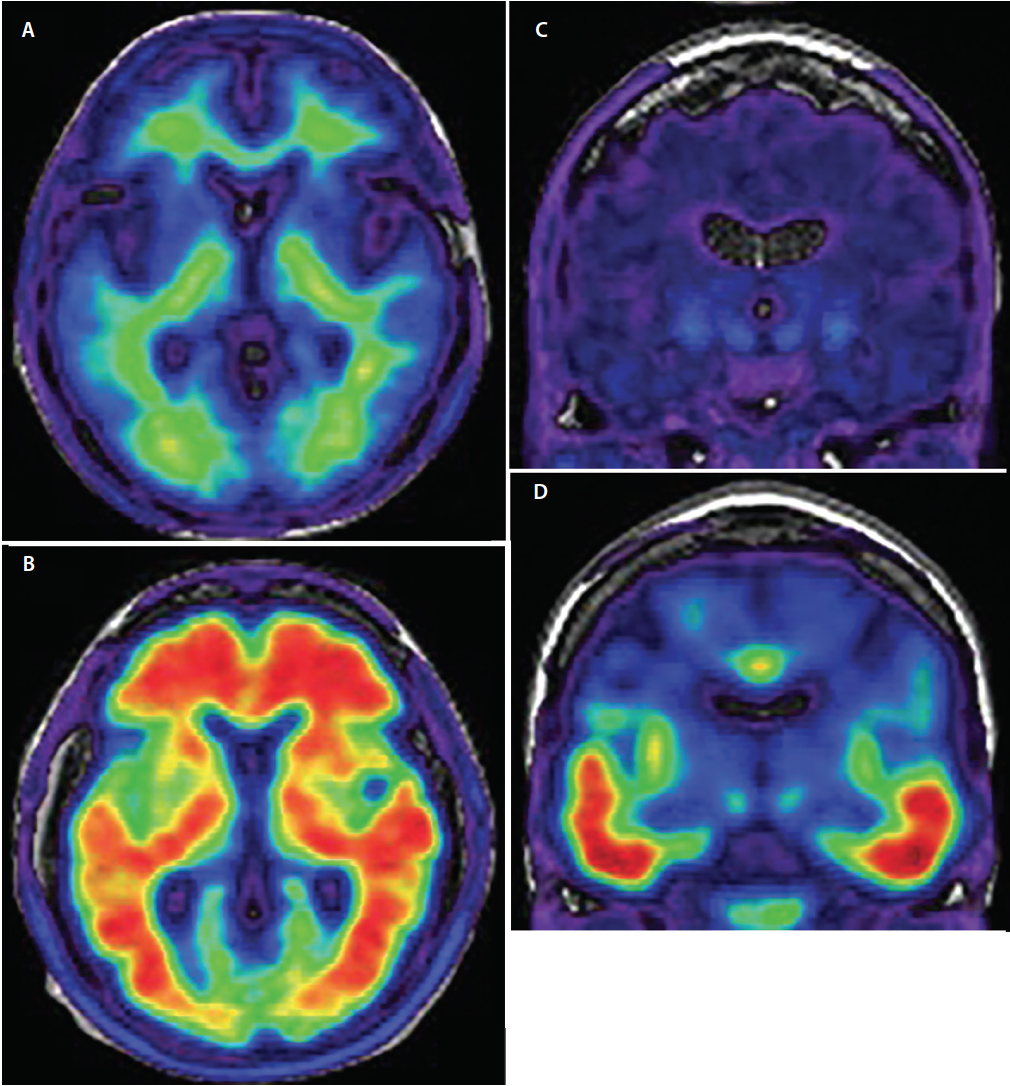
O critério padrão para um diagnóstico definitivo do AD é o exame neuropatológico cerebral post-mortem. Mesmo nas mãos de experientes especialistas em demência, o diagnóstico clínico da DA atinge apenas a sensibilidade inquietante de 70,9% a 87,3% e a especificidade de 44,3% a 70,8%.18 O mais pertinente para melhorar a precisão diagnóstica clínica da DA tem sido o desenvolvimento de traçadores de imagem PET radiolabelados com afinidade específica para agregados ß amilóides e tau fosforilados relacionados à DA (Figura 3), que permitem a demonstração in vivo da neuropatologia subjacente (Tabela) uma vez apenas possível após a morte.
Click to view larger
Figure 3. Axial amilóide-PET demonstrando amilóide negativo (A) e amilóide positivo (B). Em imagens negativas amilóides (A) o sinal do radiotraçador mostra baixa intensidade e é limitado à ligação não específica de matéria branca. A junção cinza/matéria branca é preservada. Em imagens positivas amilóides (B) o sinal do radiotraçador é de alta intensidade e se estende difusamente para as regiões de matéria cinzenta cortical obscurecendo a junção cinza/matéria branca. O tau-PET coronal demonstra varreduras tau negativas (C) e tau positivas (D). Nas varreduras tau negativas há sinal mínimo, não específico de baixa intensidade do radiotraçador nas regiões temporal medial, basal forebrain e gânglios basais. Em varreduras tau-positivas (D) o sinal do radiotraçador é de maior intensidade e envolve os cortices temporais inferior e lateral seguindo a trajetória conhecida de progressão dos emaranhados neurofibrilares.
Tomografia por emissão de pósitrons amyloid
Amyloid e, mais recentemente, a imagem tau revolucionou nossa capacidade de visualizar a patologia do AD mesmo em estágios pré-sinfibrilares.19 Os traçadores de imagens PET amilóides são válidos e confiáveis para detectar patologia do AD in vivo em vários estágios da doença. Esses traçadores de imagem ligam motivos conformacionais específicos da proteína amilóide e resultam em uma captação do traçador que é fortemente correlacionada com a deposição amilóide pós-morte.20
Comparada com a tau, a patologia amilóide começa em um padrão regional mais difusamente distribuído, espalhando-se das porções basais dos lobos frontal, temporal e occipital até as áreas de associação neocortical dorsal com envolvimento apenas do estágio tardio dos cortices sensoriais e motores primários.21 As áreas mais notáveis de captação do traçador são os corticais temporais frontal, parietal e lateral (Figura 3), com captação 1,5 a 2 vezes maior em pessoas com DA vs grupos controle22 ou com outras demências.23
As imagens do PET amilóide são avaliadas para captação do traçador cortical em áreas características da distribuição amilóide DA. Varreduras positivas mostram perda da distinção entre cinza/matéria branca à medida que a captação do traçador se estende ao neocórtex. Varreduras negativas retêm a distinção cinza/matéria branca, mostrando apenas a ligação de matéria branca fora do alvo.24 Os padrões de imagens PET amilóides podem prever com segurança o declínio cognitivo tanto em pessoas saudáveis quanto naquelas com ICM.20
18F-florbetapir, 18F-florbetaben, e 18F-flutemetamol são aprovados pela Food and Drug Administration (FDA) para uso clínico.20 As seguradoras, no entanto, não adotaram a tecnologia, devido a despesas e risco de uso excessivo clínico na ausência de terapias modificadoras de doenças e custo benefício estabelecido. Uma meta-análise relatou 95% de sensibilidade e 57% de especificidade de uma PET amilóide positiva para prever a conversão de ICM para AD.25
A relação incerta entre custo, risco e benefício levou ao desenvolvimento de critérios de uso apropriado para a imagem amilóide, atribuindo a necessidade de avaliação da PET amilóide a pessoas com ICM inexplicado, apresentações atípicas de AD e demência de início precoce.26 Especialistas também identificaram indicações inadequadas para a aquisição de imagens amilóides que incluem a avaliação independente para preocupações cognitivas antes de um trabalho completo de neuroimagem clínica, cognitiva, laboratorial e estrutural; na ausência de comprometimento cognitivo objetivo; na alta probabilidade de DC (ou seja, na ausência de um equipoise clínico); e para o estadiamento da gravidade da demência.
O estudo IDEAS (imaging dementia-evidence for amyloid scanning) – um estudo em andamento do Center for Medicare and Medicaid Services – está atualmente validando os critérios de uso apropriados e avaliando o impacto do estado amilóide determinado pelo PET no gerenciamento da doença e resultados a longo prazo para beneficiários do Medicare com MCI ou apresentações atípicas. A análise provisória revelou que a integração do PET amilóide no trabalho clínico resultou em mudanças no manejo da doença em 60,2% das pessoas com ICM e 63,5% daquelas com demência.27 Resultados a longo prazo ainda estão sendo determinados.
Tau Positron Emission Tomography
Tau é a segunda proteína que é depositada no cérebro daqueles com DC. Os traçadores de imagem Tau PET estão atualmente em desenvolvimento e já mostram promessa. Similar ao amilóide PET, os traçadores tau PET têm como alvo determinados motivos conformacionais do tau fosforilado. A especificidade dos traçadores de tau foi validada postmortem28 e o sinal observado de tau PET coincide estreitamente com a distribuição anatômica dos emaranhados neurofibrilares atualmente usados para o diagnóstico neuropatológico do AD.29 Os primeiros estágios da patologia tau que podem ser visualizados com a imagem de tau PET são os depósitos emaranhado neurofibrilares no córtex entorhinal e no hipocampo. Em seguida, os depósitos de tau tornam-se detectáveis no temporal inferior e lateral (Figura 3), seguidos pelo parietal e occipital, e finalmente os corticais frontais seguindo o bem estabelecido estadiamento patológico de Braak e Braak da deposição de tau através do cérebro.21 Os traçadores de tau não estão sem limitações diagnósticas e estão passando por um maior desenvolvimento para melhor definir seu papel clínico. Entretanto, dado que o tau-traçador se liga dinamicamente durante todo o curso clínico da DA, esta modalidade de imagem provavelmente desempenhará um papel significativo no estadiamento da gravidade da doença in vivo.30
Direções Futuras
Dado que a patologia da DA pode ser prontamente detectada até 20 anos antes do diagnóstico de demência19 e segue uma distribuição por estágios previsível, a pesquisa está agora focada na detecção precoce pré-sintomática e na melhoria da precisão diagnóstica através do uso de biomarcadores (Tabela).31 Uma proposta de estrutura de pesquisa de amilóide-tau-neurodegeneração (ATN) focada na detecção de 3 mudanças de biomarcadores no cérebro prevê a relevância clínica da imagem multimodal.31 O sistema de classificação ATN é agnóstico de síndromes clínicas e captura todo o espectro das doenças neurodegenerativas através de uma lente biomarcador AD. Após um maior desenvolvimento e refinamento, espera-se que a RTA, através de uma categorização objetiva dos biomarcadores in vivo, melhore drasticamente a precisão do diagnóstico clínico e melhore a qualidade dos cuidados.
Conclusão
Neuroimagem oferece informação única sobre a etiologia subjacente do comprometimento cognitivo e facilita a orientação para pacientes e famílias através de uma experiência temerosa e incerta. Todas as doenças neurodegenerativas mostram significativa heterogeneidade clínica, e antes dos avanços mais recentes da imagem molecular, nenhuma pôde ser diagnosticada definitivamente antes da morte. A moderna tecnologia de imagem do cérebro é capaz de detectar epifenômenos múltiplos, refletindo a neuropatologia subjacente, alguns dos quais são bastante próximos à fonte da doença. O diagnóstico clínico mais confiante atualmente é baseado na integração da história clínica, observações médicas, exame físico, exames médicos, testes neuropsicológicos e interpretação informada da neuroimagem diagnóstica. Como os biomarcadores da ATN são mais refinados, os diagnósticos clínicos serão feitos mais cedo e mais definitivamente em pacientes vivos, confiam menos na classificação dos sintomas e oferecem oportunidades para intervenções de tratamento mais precoces que podem alterar a trajetória da doença neurodegenerativa.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Parâmetro de prática: diagnóstico de demência (uma revisão baseada em evidências). Relatório do Subcomité de Padrões de Qualidade da Academia Americana de Neurologia. Neurologia. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurologia. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. Comparação 3D da atrofia hipocampal baixa, intermediária e avançada em ICM. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. Escalas de classificação visual por RM no diagnóstico de demência: avaliação em 184 casos confirmados post-mortem. Cérebro. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. A atrofia do lobo temporal medial na RM diferencia a doença de Alzheimer da demência com corpos de Lewy e comprometimento cognitivo vascular: um estudo prospectivo com verificação patológica do diagnóstico. Cérebro. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in patologically confirmed dementias: a voxelwise analysis. J Neurol Neurocirurgia Psiquiatria. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Correlatos patológicos de hiperintensidades de sinal incidental de matéria branca por ressonância magnética. Neurologia. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion tensor imaging of normal-appearing white matter in mild cognitive impairment and early Alzheimer disease: preliminary evidence of axonal degeneration in the temporal lobe. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment. Alzheimer Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Alterações estruturais do trato predizem acúmulo de tau a jusante em indivíduos idosos amilóides positivos. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Mapeamento superficial de alterações metabólicas cerebrais em idosos cognitivamente normais e moderadamente deficientes. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET melhora a precisão na distinção entre demência frontotemporal e doença de Alzheimer. Cérebro. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Metabolismo da glicose cerebral em pacientes com demência frontotemporal. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter padronizou o diagnóstico PET 18F-FDG de comprometimento cognitivo leve, doença de Alzheimer, e outras demências. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Nota de Decisão para Tomografia por Emissão de Pósitrons (FDG) e Outros Dispositivos de Neuroimagem para Suspeita de Demência (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Acesso 4 de Maio de 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Hubs corticais revelados pela conectividade funcional intrínseca: mapeamento, avaliação da estabilidade e relação com o mal de Alzheimer. J Neuroci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. As doenças neurodegenerativas visam redes de cérebro humano em larga escala. Neurônio. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. O valor diagnóstico do FDG e do PET amilóide na doença de Alzheimer – uma revisão sistemática. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Estágio neuropatológico de alterações relacionadas com o Alzheimer. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalência de positividade de PET amilóide em síndromes de demência: uma meta-análise. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Precisão preditiva da imagem do amilóide para a progressão da deficiência cognitiva leve à doença de Alzheimer com diferentes durações de seguimento: uma meta-análise. . Medicina (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimer Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Validação autoradiográfica do novo traçador tau PET -MK-6240 em tecido cerebral pós-morte humano. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Early clinical PET imaging results with the novel PHF-tau radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluation of tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Para uma definição biológica da doença de Alzheimer. Alzheimers Dement. 2018;14(4):535-562.
MRA e DS não relatam nenhuma revelação.
LGA serviu como membro do conselho consultivo da Eli Lilly.