O princípio Aufbau
Para determinar a configuração de elétrons para qualquer átomo em particular, podemos “construir” as estruturas na ordem dos números atômicos. Começando pelo hidrogénio, e continuando ao longo dos períodos da tabela periódica, adicionamos um próton de cada vez ao núcleo e um electrão à subesfera própria até termos descrito as configurações dos electrões de todos os elementos. Este procedimento é chamado de princípio Aufbau, a partir da palavra alemã Aufbau (“construir”). Cada elétron adicionado ocupa a subesfera de menor energia disponível (na ordem mostrada na Figura 3), sujeito às limitações impostas pelos números quânticos permitidos de acordo com o princípio de exclusão Pauli. Os elétrons entram nas sub-camadas de alta energia somente após as sub-camadas de baixa energia terem sido preenchidas até a capacidade. A figura {3} ilustra a forma tradicional de lembrar a ordem de preenchimento das orbitais atômicas.
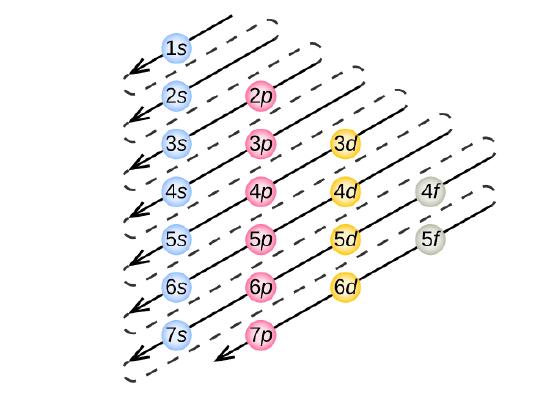
Desde que a disposição da tabela periódica é baseada nas configurações dos electrões, a Figura \PageIndex{4}} fornece um método alternativo para determinar a configuração dos electrões. A ordem de enchimento começa simplesmente com hidrogênio e inclui cada sub-camada à medida que você avança na ordem Z crescente. Por exemplo, depois de preencher o bloco 3p até Ar, vemos que o orbital será 4s (K, Ca), seguido pelos orbitais 3d.
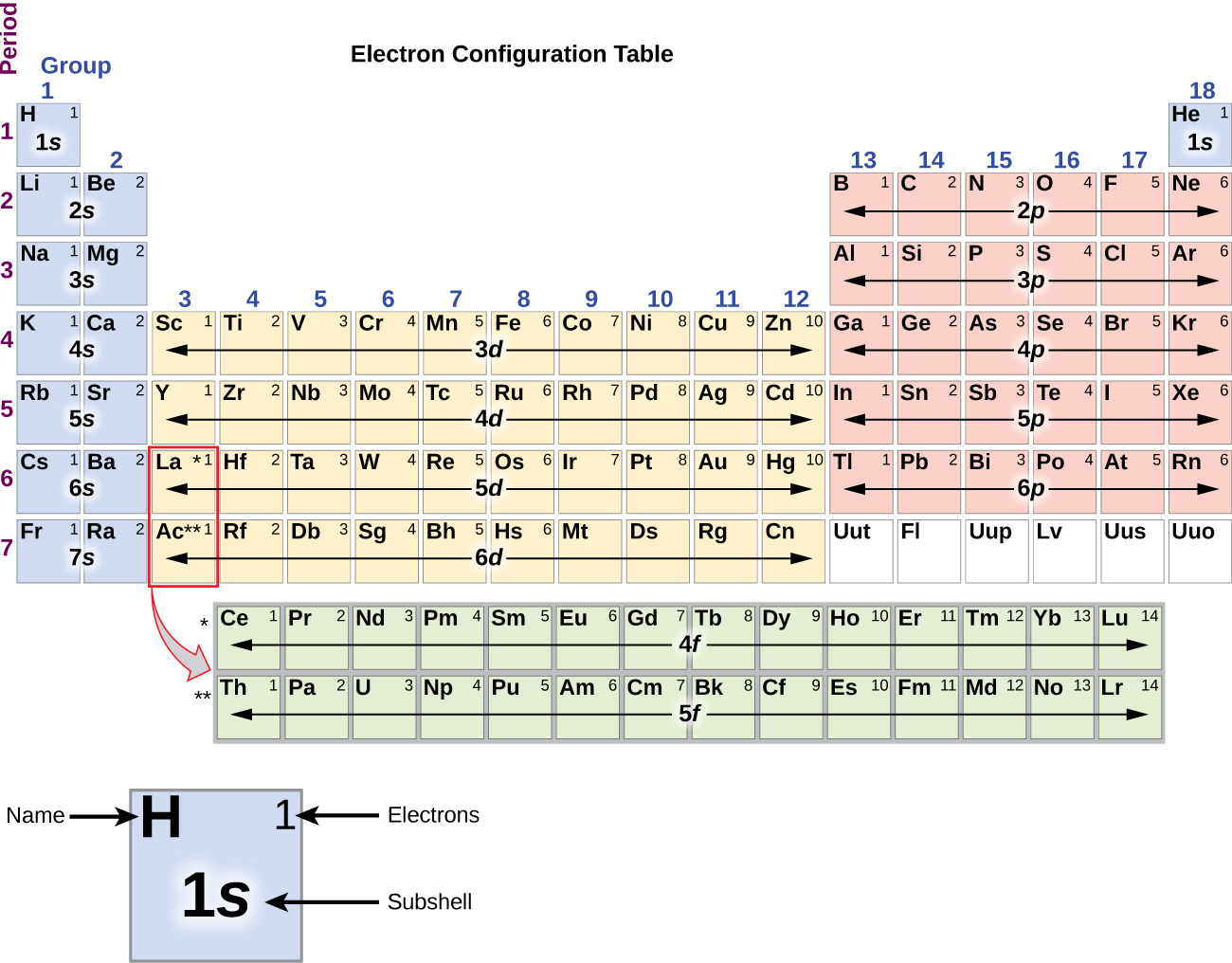 Figure \(\PageIndex{4}}): Esta tabela periódica mostra a configuração eletrônica para cada sub-camada. Ao “construir” a partir do hidrogênio, esta tabela pode ser usada para determinar a configuração eletrônica para qualquer átomo na tabela periódica.
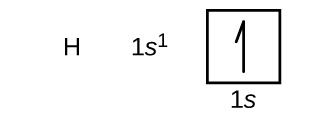
Figure \(\PageIndex{4}}): Esta tabela periódica mostra a configuração eletrônica para cada sub-camada. Ao “construir” a partir do hidrogênio, esta tabela pode ser usada para determinar a configuração eletrônica para qualquer átomo na tabela periódica.Vamos agora construir a configuração eletrônica em estado estacionário e o diagrama orbital para uma seleção de átomos no primeiro e segundo períodos da tabela periódica. Os diagramas orbitais são representações pictóricas da configuração eletrônica, mostrando os orbitais individuais e a disposição emparelhada dos elétrons. Começamos com um único átomo de hidrogênio (número atômico 1), que consiste em um próton e um elétron. Referindo-nos à Figura 3 ou à Figura 4, esperaríamos encontrar o electrão no orbital 1s. Por convenção, o valor {m_s=+dfrac{1}{2} é normalmente preenchido primeiro. A configuração dos electrões e o diagrama orbital são:
O hidrogénio é o hélio gasoso nobre, que tem um número atómico de 2. O átomo de hélio contém dois prótons e dois electrões. O primeiro elétron tem os mesmos quatro números quânticos que o elétron do átomo de hidrogênio (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}})). O segundo elétron também entra no orbital 1s e preenche esse orbital. O segundo elétron tem os mesmos números quânticos de n, l e ml, mas deve ter o número quântico de spin oposto, \(m_s=-\dfrac{1}{2}}). Isto está de acordo com o princípio de exclusão Pauli: Nenhum dois elétrons no mesmo átomo pode ter o mesmo conjunto de quatro números quânticos. Para diagramas orbitais, isto significa que duas setas vão em cada caixa (representando dois elétrons em cada orbital) e as setas devem apontar em direções opostas (representando giros emparelhados). A configuração eletrônica e o diagrama orbital de hélio são:
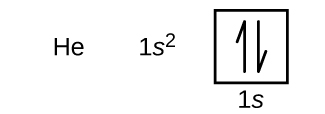
O n = 1 concha é completamente preenchido em um átomo de hélio.
O próximo átomo é o lítio metálico alcalino com um número atômico de 3. Os dois primeiros elétrons em lítio preenchem o orbital de 1s e têm os mesmos conjuntos de quatro números quânticos que os dois elétrons em hélio. O elétron restante deve ocupar o orbital da próxima energia mais baixa, o orbital 2s (Figura 3) ou 4). Assim, a configuração eletrônica e o diagrama orbital do lítio são:
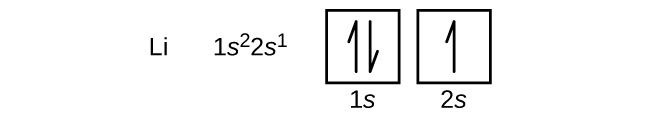
Um átomo do berílio metálico alcalino terrestre, com um número atômico de 4, contém quatro prótons no núcleo e quatro elétrons ao redor do núcleo. O quarto elétron preenche o espaço restante no orbital 2s.
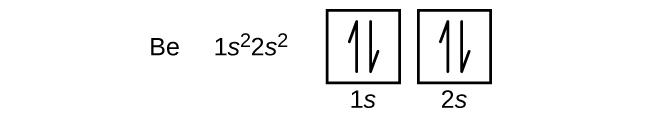
Um átomo de boro (número atômico 5) contém cinco elétrons. O n = 1 shell é preenchido com dois electrões e três electrões ocuparão o n = 2 shell. Como qualquer subesfera pode conter apenas dois elétrons, o quinto elétron deve ocupar o próximo nível de energia, que será um orbital de 2p. Existem três orbitais 2p degenerados (ml = -1, 0, +1) e o elétron pode ocupar qualquer um destes orbitais p. Ao desenhar os diagramas orbitais, incluímos caixas vazias para representar qualquer orbital vazio na mesma subesfera que estamos preenchendo.
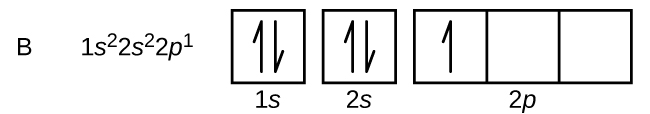
Carbono (número atômico 6) tem seis elétrons. Quatro deles preenchem os orbitais 1s e 2s. Os dois elétrons restantes ocupam a subcarapaça 2p. Temos agora a opção de preencher uma das orbitais 2p e emparelhar os elétrons ou de deixar os elétrons não emparelhados em duas orbitais p diferentes, mas degeneradas. Os orbitais são preenchidos como descrito pela regra de Hund: a configuração de energia mais baixa para um átomo com elétrons dentro de um conjunto de orbitais degenerados é aquela que tem o número máximo de elétrons não pareados. Assim, os dois elétrons nas orbitais de carbono 2p têm números quânticos n, l e ms idênticos e diferem em seu número quântico de ml (de acordo com o princípio de exclusão Pauli). A configuração eletrônica e o diagrama orbital do carbono são:
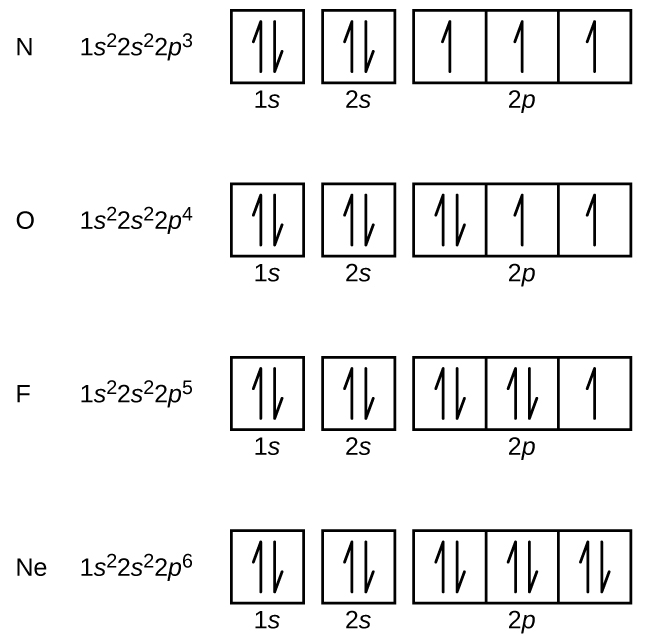
Nitrogênio (número atômico 7) preenche as subesferas 1s e 2s e tem um elétron em cada uma das três orbitais 2p, de acordo com a regra de Hund. Estes três elétrons têm giros não pareados. O oxigênio (número atômico 8) tem um par de elétrons em qualquer uma das orbitais de 2p (os elétrons têm giros opostos) e um único elétron em cada um dos outros dois. O flúor (número atómico 9) tem apenas um orbital de 2p contendo um electrão não emparelhado. Todos os elétrons do néon de gás nobre (número atômico 10) estão emparelhados, e todos os orbitais do n = 1 e o n = 2 estão preenchidos. As configurações dos elétrons e diagramas orbitais destes quatro elementos são:
O metal álcali sódio (número atômico 11) tem um elétron a mais do que o átomo de néon. Este elétron deve ir para a subesfera de menor energia disponível, a orbital 3s, dando uma configuração de 1s22s22p63s1. Os elétrons que ocupam o(s) orbital(is) externo(s) (valor mais alto de n) são chamados de elétrons de valência, e os que ocupam os orbitais internos da casca são chamados de elétrons de núcleo ( Figura \PageIndex5\PageIndex5\PageIndex5). Como os conchas dos elétrons do núcleo correspondem a configurações de elétrons de gás nobre, podemos abreviar configurações de elétrons escrevendo o gás nobre que corresponde à configuração dos elétrons do núcleo, juntamente com os elétrons de valência em um formato condensado. Para nosso exemplo do sódio, o símbolo representa os elétrons do núcleo, (1s22s22p6) e nossa configuração abreviada ou condensada é 3s1.

Similiarmente, a configuração abreviada do lítio pode ser representada como 2s1, onde representa a configuração do átomo de hélio, que é idêntica à da concha interna cheia de lítio. Escrever as configurações desta forma enfatiza a similaridade das configurações de lítio e sódio. Ambos os átomos, que estão na família do metal alcalino, têm apenas um electrão numa subesfera de valência fora de um conjunto preenchido de conchas interiores.
,2s^1\\\ce{Na:{Na:},3s^1\]
A terra alcalina do metal magnésio (número atómico 12), com os seus 12 electrões numa configuração de 3s2, é análoga ao seu membro da família berílio, 2s2. Ambos os átomos têm uma sub-casca cheia fora das suas conchas internas cheias. O alumínio (número atómico 13), com 13 electrões e a configuração electrónica 3s23p1, é análogo ao boro, 2s22p1, do seu membro de família.
As configurações eletrônicas de silício (14 elétrons), fósforo (15 elétrons), enxofre (16 elétrons), cloro (17 elétrons) e argônio (18 elétrons) são análogas nas configurações eletrônicas de suas conchas externas aos seus correspondentes membros da família carbono, nitrogênio, oxigênio, flúor e neônio, respectivamente, exceto que o número quântico principal da concha externa dos elementos mais pesados aumentou de um para n = 3. A figura \i(6) mostra a menor configuração de energia, ou estado da terra, dos elétrons para estes elementos, bem como a dos átomos de cada um dos elementos conhecidos.
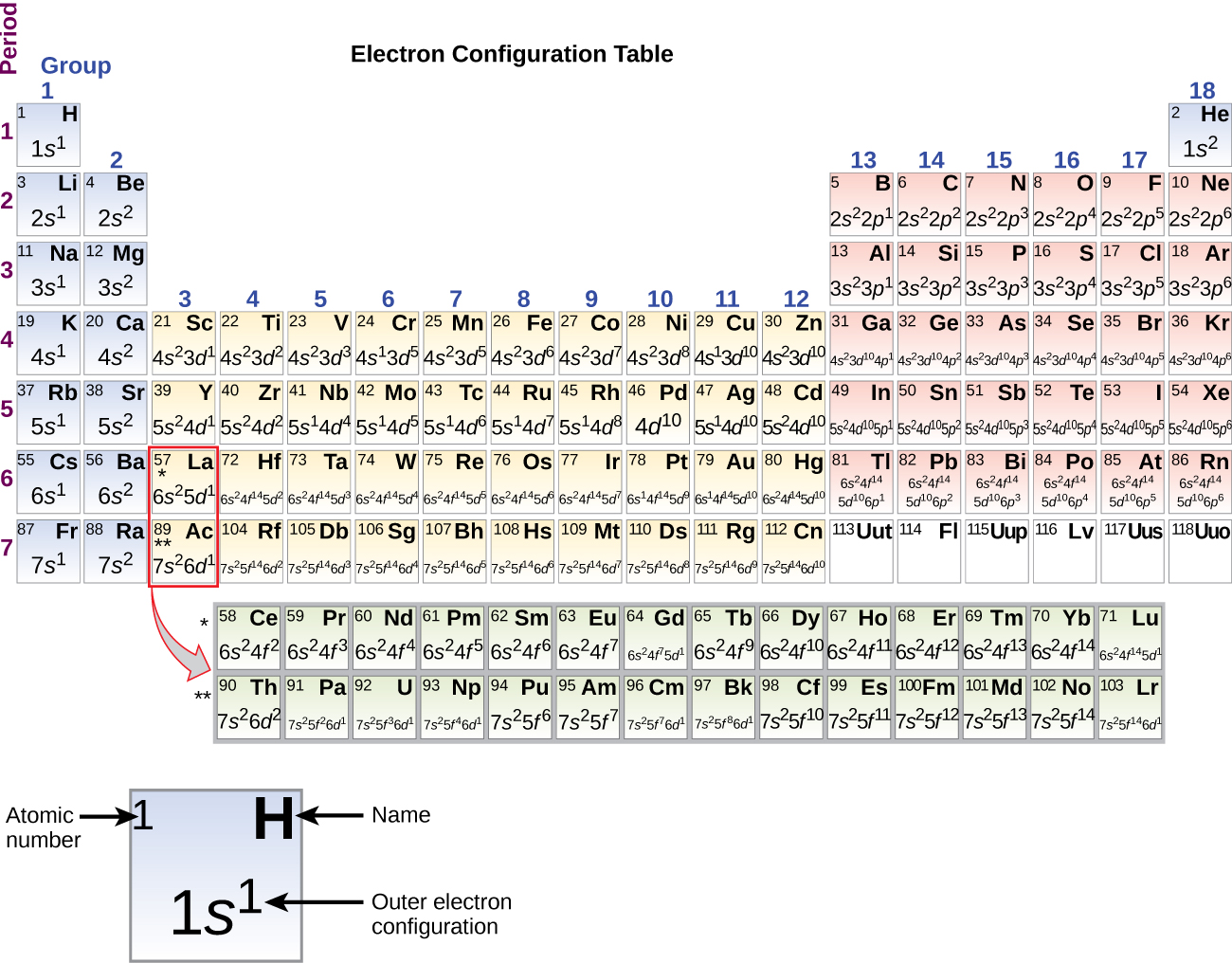
Quando chegamos ao próximo elemento da tabela periódica, o potássio alcalino metálico (número atômico 19), poderíamos esperar que começaríamos a adicionar elétrons à subesfera 3d. Entretanto, todas as evidências químicas e físicas disponíveis indicam que o potássio é como lítio e sódio, e que o próximo elétron não é adicionado ao nível 3d, mas sim ao nível 4s (Figura \PageIndex{3} ou \PageIndex{4}). Como discutido anteriormente, o orbital 3d sem nós radiais é maior em energia porque é menos penetrante e mais protegido do núcleo do que o 4s, que tem três nós radiais. Assim, o potássio tem uma configuração eletrônica de 4s1. Assim, o potássio corresponde a Li e Na na sua configuração de concha de valência. O próximo elétron é adicionado para completar a subesfera do 4s e o cálcio tem uma configuração eletrônica de 4s2. Isto dá ao cálcio uma configuração de elétron de concha externa correspondente à de berílio e magnésio.
Começando com o escândio metálico de transição (número atômico 21), elétrons adicionais são adicionados sucessivamente à concha 3d. Esta subesfera é preenchida até a sua capacidade com 10 elétrons (lembre-se que para l = 2 , existem 2l + 1 = 5 valores de ml, significando que existem cinco d orbitais que têm uma capacidade combinada de 10 elétrons). A subesfera de 4p preenche-se a seguir. Note que para três séries de elementos, scandium (Sc) através do cobre (Cu), yttrium (Y) através da prata (Ag), e lutetium (Lu) através do ouro (Au), um total de 10 d elétrons são adicionados sucessivamente à concha (n – 1) ao lado da concha n para trazer aquela (n – 1) concha de 8 a 18 elétrons. Para duas séries, lantânio (La) através do lutécio (Lu) e actínio (Ac) através do lawrencium (Lr), 14 f electrões (l = 3, 2l + 1 = 7 ml; assim, sete orbitais com uma capacidade combinada de 14 electrões) são adicionados sucessivamente à concha (n – 2) para trazer aquela concha de 18 electrões para um total de 32 electrões.
Exemplo \(\PageIndex{1}}): Números Quânticos e Configurações Elétricas
Qual é a configuração dos elétrons e diagrama orbital para um átomo de fósforo? Quais são os quatro números quânticos para o último elétron adicionado?
Solução
O número atômico do fósforo é 15. Assim, um átomo de fósforo contém 15 elétrons. A ordem de enchimento dos níveis de energia é 1s, 2s, 2p, 3s, 3p, 4s, . . Os 15 elétrons do átomo de fósforo irão encher até o orbital de 3p, que conterá três elétrons:
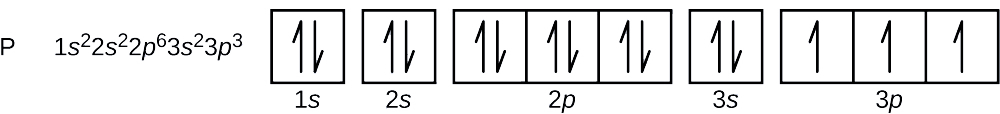
O último elétron adicionado é um elétron de 3p. Portanto, n = 3 e, para um orbital do tipo p, l = 1. O valor do ml pode ser -1, 0, ou +1. Os três orbitais de p são degenerados, portanto qualquer um destes valores de ml está correto. Para elétrons não pareados, a convenção atribui o valor de \(+\dfrac{1}{2}) para o número quântico do spin; assim, \(m_s=+\dfrac{1}{2}).
Exercício \(\PageIndex{1})
Identificar os átomos a partir das configurações de electrões dadas:
- 4s23d5
- 5s24d105p6
Resposta a
Mn
Resposta b
Xe
A tabela periódica pode ser uma poderosa ferramenta na predição da configuração electrónica de um elemento. Entretanto, encontramos exceções à ordem de preenchimento dos orbitais que são mostradas na Figura {3}(PageIndex{4}} ou {4}PageIndex}. Por exemplo, as configurações eletrônicas dos metais de transição cromo (Cr; número atômico 24) e cobre (Cu; número atômico 29), entre outros, não são aquelas que esperaríamos. Em geral, tais exceções envolvem subconchas com energia muito semelhante, e pequenos efeitos podem levar a mudanças na ordem de enchimento.
No caso do Cr e do Cu, encontramos que subconchas meio cheias e completamente cheias aparentemente representam condições de estabilidade preferenciais. Esta estabilidade é tal que um electrão passa do 4s para o orbital 3d para ganhar a estabilidade extra de uma sub-camada 3d meio cheia (em Cr) ou uma sub-camada 3d cheia (em Cu). Outras exceções também ocorrem. Por exemplo, prevê-se que o nióbio (Nb, número atómico 41) tenha a configuração electrónica 5s24d3. Experimentalmente, observamos que a sua configuração de electrões em estado de terra é na realidade 5s14d4. Podemos racionalizar esta observação dizendo que as repulsões elétron-eletrônicos experimentadas pelo emparelhamento dos elétrons no orbital 5s são maiores que a brecha de energia entre os orbitais 5s e 4d. Não há um método simples para prever as exceções para átomos onde a magnitude das repulsões entre elétrons é maior do que as pequenas diferenças de energia entre as subcasas.