Objetivos de aprendizado
- Extender conceitos de equilíbrio introduzidos anteriormente para ácidos e bases que podem doar ou aceitar mais de um próton
Podemos também usar as forças relativas dos pares ácido-base conjugados para entender as propriedades ácido-base das soluções de sais. Uma reação de neutralização pode ser definida como a reação de um ácido e uma base para produzir um sal e água. Ou seja, outro catião, como o Na^+, substitui o próton no ácido. Um exemplo é a reacção de um ácido fraco, com uma base forte:
Dependente das propriedades ácido-base dos seus iões componentes, contudo, um sal pode dissolver-se em água para produzir uma solução neutra, uma solução básica, ou uma solução ácida.
Quando um sal como o NaCl se dissolve na água, ele produz iões. Usando uma abordagem de Lewis, o íon Na^+ pode ser visto como um ácido porque é um par de elétrons aceito, embora sua baixa carga e seu raio relativamente grande o torne um ácido muito fraco. O ião é a base conjugada do ácido forte (HCl), por isso não tem essencialmente carácter básico. Consequentemente, a dissolução em água não tem efeito sobre o pH de uma solução, e a solução permanece neutra.
Agora vamos comparar este comportamento com o comportamento de soluções aquosas de cianeto de potássio e acetato de sódio. Novamente, os cátions (K^+) e Na^+) não têm essencialmente caráter ácido, mas os ânions (CN^-) e CH_3CO_2^-) são bases fracas que podem reagir com a água porque são as bases conjugadas dos ácidos fracos (HCN) e ácido acético, respectivamente.
>
>
Nem qualquer reacção prossegue muito para a direita como escrito porque a formação do par ácido-base mais fraco é favorecida. Tanto o HCN como o ácido acético são ácidos mais fortes do que a água, e o hidróxido é uma base mais forte do que o acetato ou o cianeto, portanto, em ambos os casos, o equilíbrio está à esquerda. No entanto, cada uma destas reacções gera iões de hidróxido suficientes para produzir uma solução básica. Por exemplo, o pH de uma solução 0,1 M de acetato de sódio ou cianeto de potássio a 25°C é de 8,8 ou 11,1, respectivamente. Da tabela E1 e E2, podemos ver que \(CN^-\) é uma base mais forte (\(pK_b = 4,79\)) do que o acetato (\(pK_b = 9,24\)), o que é consistente com a produção de uma solução mais básica do que o acetato de sódio na mesma concentração.
Em contraste, o ácido conjugado de uma base fraca deve ser um ácido fraco. Por exemplo, cloreto de amônio e cloreto de piridínio são sais produzidos pela reação de amônia e piridina, respectivamente, com \(HCl). Como você já sabe, o íon cloreto é uma base tão fraca que não reage com a água. Em contraste, os cátions dos dois sais são ácidos fracos que reagem com a água da seguinte forma:
Figure \\(PageIndex{2}) mostra que o \i(H_3O^++) é um ácido mais forte que o \i(NH_4^+) ou o \i(C_5H_5NH^++), e inversamente, o amoníaco e a piridina são ambas bases mais fortes que a água. O equilíbrio ficará, portanto, muito à esquerda em ambos os casos, favorecendo o par ácido-base mais fraco. A concentração de H_3O^+) produzida pelas reacções é suficientemente grande, no entanto, para diminuir significativamente o pH da solução: o pH de uma solução de 0,10 M de cloreto de amónio ou cloreto de piridínio a 25°C é de 5,13 ou 3,12, respectivamente.
O que acontece com soluções aquosas de um sal como o acetato de amónio, onde tanto o catião como o anião podem reagir separadamente com água para produzir um ácido e uma base, respectivamente? De acordo com a Figura 16.10, o íon de amônia irá baixar o pH, enquanto que de acordo com a Figura 16.9, o íon de acetato irá aumentar o pH. Este caso particular é incomum, na medida em que o cátion é um ácido tão forte quanto o ânion é uma base (pKa ≈ pKb). Consequentemente, os dois efeitos cancelam, e a solução permanece neutra. Com sais em que o catião é um ácido mais forte que o ânion é uma base, a solução final tem um pH < 7,00. Pelo contrário, se o cátion é um ácido mais fraco que o ânion é uma base, a solução final tem um \(pH\) > 7.00.
Iões metálicos ácidos
Soluções de sais simples de iões metálicos também podem ser ácidas, mesmo que um ião metálico não possa doar um próton directamente à água para produzir \(H_3O^+\). Em vez disso, um íon metálico pode agir como um ácido Lewis e interagir com a água, uma base de Lewis, coordenando-se com um par único de elétrons no átomo de oxigênio para formar um íon metálico hidratado (Figura \PageIndex{1a}}). Uma molécula de água coordenada com um íon metálico é mais ácida que uma molécula de água livre por duas razões. Primeiro, as interacções electrostáticas repulsivas entre o ião metálico carregado positivamente e os átomos de hidrogénio parcialmente carregados positivamente da molécula coordenada da água facilitam a perda de um protão pela água coordenada.
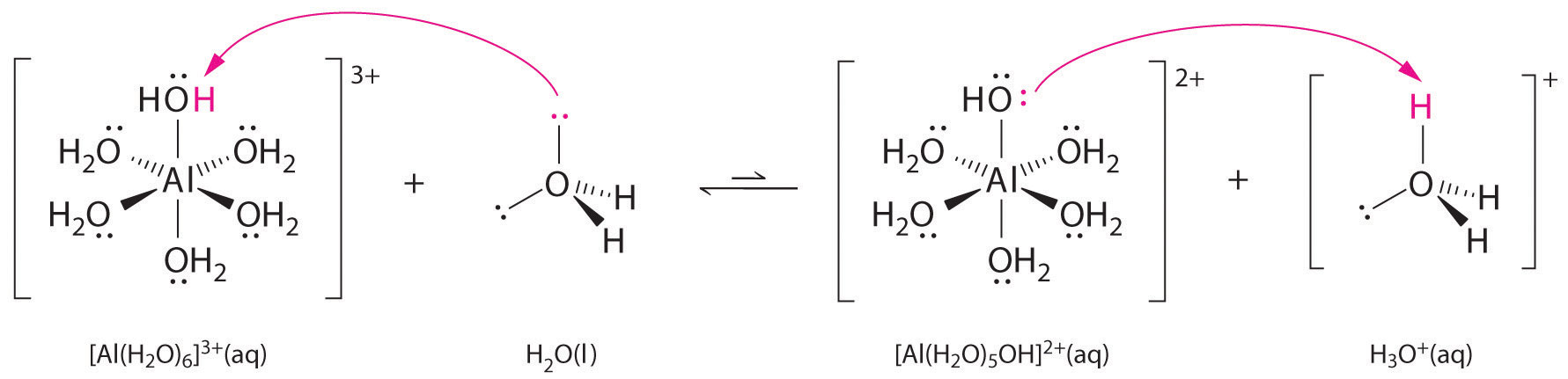
Segundo, a carga positiva no íon \(Al^{3+}) atrai a densidade de elétrons dos átomos de oxigênio das moléculas de água, o que diminui a densidade de elétrons nas ligações, como mostrado na Figura \PageIndex{1b}). Com menos densidade de electrões entre os átomos O e H, as ligações são mais fracas do que numa molécula livre, tornando mais fácil a perda de um ião H: Efeito de um íon metálico na acidez da água (a) A reação do íon metálico com a água para formar o íon metálico hidratado é um exemplo de reação à base de ácido de Lewis. (b) A carga positiva sobre o íon de alumínio atrai a densidade de elétrons dos átomos de oxigênio, que desloca a densidade de elétrons para longe das ligações O-H. A diminuição da densidade de electrões enfraquece as ligações O-H nas moléculas de água e facilita a perda de um próton.
A magnitude deste efeito depende dos dois factores seguintes (Figura \PageIndex{3}}:
- A carga sobre o ião metálico. Um íon divalente (^(M^{2+}}) tem aproximadamente duas vezes mais forte um efeito na densidade de elétrons em uma molécula coordenada de água do que um íon monovalente (^(M^+})) do mesmo raio.
- O raio do íon metálico. Para iões metálicos com a mesma carga, quanto menor o ião, menor a distância internuclear ao átomo de oxigénio da molécula da água e maior o efeito do metal na distribuição da densidade de electrões na molécula da água.
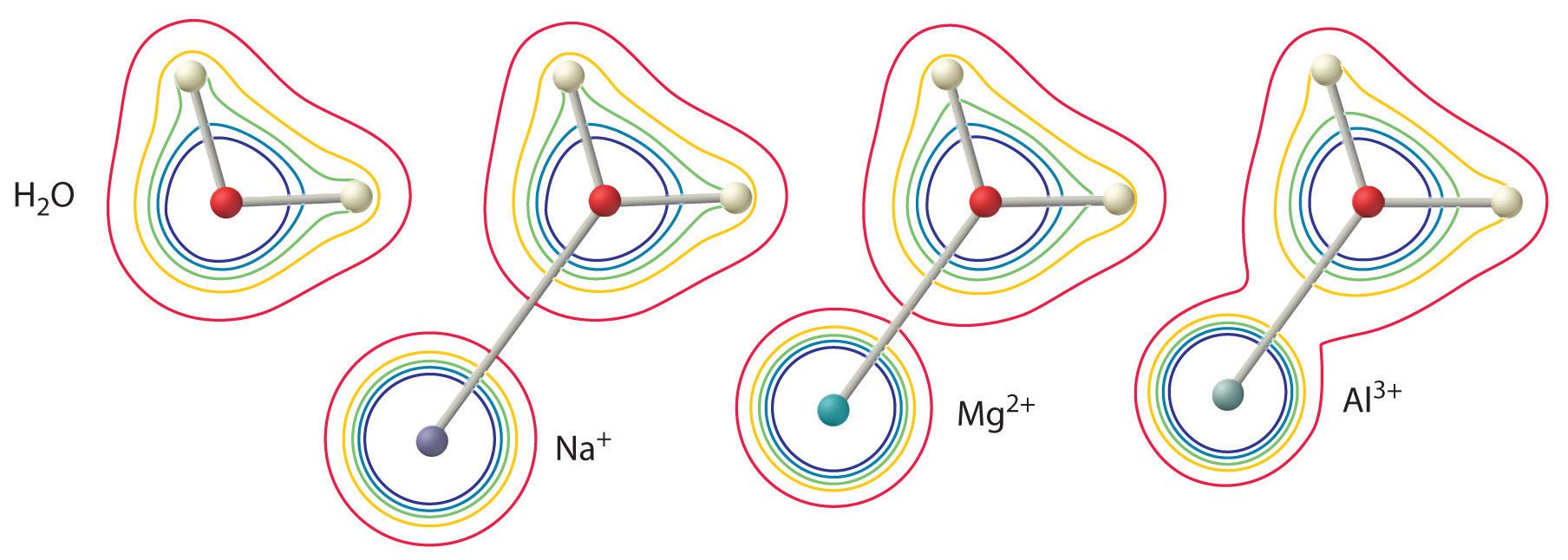
Assim, soluções aquosas de íons metálicos pequenos e altamente carregados, como ^(Al^{3+}} e ^(Fe^{3+}}), são ácidas:
^{3+}_{(aq)}. \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \O ião tem um 5.0, tornando-o quase tão forte como o ácido acético. Devido aos dois fatores descritos anteriormente, o parâmetro mais importante para prever o efeito de um íon metálico sobre a acidez de moléculas coordenadas de água é a relação carga-radius do íon metálico. Um número de pares de íons metálicos que se encontram em uma linha diagonal na tabela periódica, tais como ^(Li^++) e ^(Mg^{2+}} ou ^(Ca^{2+}) e ^(Y^{3+}), têm tamanhos e cargas diferentes, mas proporções de carga em relação ao rádio semelhantes. Como resultado, estes pares de íons metálicos têm efeitos similares na acidez de moléculas coordenadas de água, e freqüentemente exibem outras similaridades significativas também na química.
Ions metálicos ácidos
Soluções de pequenos íons metálicos altamente carregados em água são ácidas.
Reações como as discutidas nesta seção, nas quais um sal reage com água para dar uma solução ácida ou básica, são freqüentemente chamadas reações de hidrólise. Usar um nome separado para este tipo de reação é lamentável porque sugere que elas são de alguma forma diferentes. Na verdade, as reacções de hidrólise são apenas reacções ácido-base nas quais o ácido é um catião ou a base é um ânion; obedecem aos mesmos princípios e regras que todas as outras reacções ácido-base.
Hidrólise
Uma reacção de hidrólise é uma reacção ácido-base.
Exemplo \(\PageIndex{1})
Prever se as soluções aquosas destes compostos são ácidas, básicas, ou neutras.
- (KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Dado: composto
Passado para: acidez ou basicidade da solução aquosa
Estratégia:
- Avaliar as propriedades ácido-base do catião e do ânion. Se o catião for um ácido Lewis fraco, ele não afetará o pH da solução. Se o cátion for o ácido conjugado de uma base fraca ou um cátion metálico relativamente carregado, no entanto, ele reagirá com água para produzir uma solução ácida.
- Se o ânion for a base conjugada de um ácido forte, ele não afetará o \(pH) da solução. Se, entretanto, o ânion for a base conjugada de um ácido fraco, a solução será básica.
Solução:
a
- O \(K^+\) catião tem uma carga positiva pequena (+1) e um raio relativamente grande (porque está na quarta fila da tabela periódica), portanto é um ácido de Lewis muito fraco.
- O ^(NO_3-) anião é a base conjugada de um ácido forte, por isso não tem essencialmente nenhum carácter básico (Tabela 16.1). Portanto nem o cátion nem o ânion reagirão com água para produzir \(H^++) ou \(OH^-), e a solução será neutra.
b.
- O \(Cr^{3+}}) íon é um cátion metálico relativamente carregado que deve comportar-se de forma semelhante ao íon \(Al^{3+}} e formar o complexo 3+, que se comportará como um ácido fraco: \O que é um ácido fraco. \{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_(aq)}]
- O ânion é uma base muito fraca (é a base conjugada do ácido forte), por isso não afecta o pH da solução. Portanto, a solução será ácida.
c.
- O íon ^(Na^+\), como o ^(K^+\), é um ácido muito fraco, portanto não deve afetar a acidez da solução.
- Em contraste, ^(SO_4^{2-}}) é a base conjugada do ^(HSO_4^-\), que é um ácido fraco. Assim o íon \(SO_4^{2-}}) reagirá com água como mostrado na Figura 16.6 para dar uma solução ligeiramente básica.
Exercitar \(\PageIndex{1})
Prever se as soluções aquosas a seguir são ácidas, básicas, ou neutras.
- (KI\)
- (Mg(ClO_4)_2\)
- (NaHS\)
Resposta a
neutro
Resposta b
ácido
Resposta c
básico (devido a a reacção de \(HS^-) com água para formar \(H_2S) e \(OH^-))
Sumário
Um sal pode dissolver-se na água para produzir um neutro, uma solução básica, ou ácida, dependendo se ela contém a base conjugada de um ácido fraco como o ânion (A^-), o ácido conjugado de uma base fraca como o cátion (BH^+), ou ambos. Sais que contêm pequenos iões metálicos altamente carregados produzem soluções ácidas na água. A reação de um sal com água para produzir um ácido ou uma solução básica é chamada reação de hidrólise.