Czym jest wrodzona anomalia tętnic wieńcowych?
Nieustannie toczy się debata na temat tego, co należy uznać za prawidłowe, a co za anomalię tętnic wieńcowych (CAA). Według Angeliniego,1 CAA rozpoznaje się przez wykluczenie, co oznacza, że w tych przypadkach, w których morfologia tętnic wieńcowych nie jest prawidłowa, definiuje się normalność według kryteriów statystycznych (przedział pomiędzy plus lub minus 2 odchyleniami standardowymi od wartości średniej). W ten sposób CAA to morfologia tętnic wieńcowych obserwowana u mniej niż jednego procenta populacji ogólnej.1,2 CAA mogą powstawać podczas normalnej lub patologicznej kardiogenezy: w pierwszym przypadku wynikiem byłyby izolowane CAA, na których skupiamy się w tym artykule, natomiast w drugim przypadku byłyby one związane z innymi wadami serca.
KLASYFIKACJA
Istnieje kilka klasyfikacji.1-3 Ostatnio zaproponowano nową, która stara się ujednolicić kryteria diagnostyczne i grupuje CAA według 7 kategorii4 (tab. 1).


Międzynarodowe grupy wzywają do prowadzenia rejestrów obejmujących co najmniej te anomalie, które są przyczyną większości zdarzeń klinicznych (nagłego zgonu i niedokrwienia mięśnia sercowego) przypisywanych CAA,5-7 stanowią te, które pochodzą z kontralateralnej lub „niewłaściwej” zatoki Valsalvy. Do tej grupy należą tętnice wieńcowe z pojedynczym naczyniem („hiperdominacja” w klasyfikacji Rigatellego i wsp.4), ponieważ muszą one dostarczać krew do mięśnia sercowego z jednego ostium wieńcowego i ustanawiają drogi, które czasami są podobne do tych, jakie mają CAA pochodzące z nieprawidłowej zatoki Valsalvy (ryc. 1).

Rycina 1. Koronarografia w projekcji skośnej przedniej lewej, przedstawiająca jednonaczyniową prawą tętnicę wieńcową.
Występowanie
Różne definicje lub klasyfikacje oraz analiza serii angiograficznych8,9 i autopsyjnych10 , a w ostatnich latach także serii echokardiograficznych11 , powodują, że zgłaszana częstość występowania CAA waha się od 0,1% do 8,4%,1,8,11 co utrudnia ustalenie dokładnej skali problemu, jaki stanowią. Ogólnie rzecz biorąc, częstość występowania może być dość podobna do częstości występowania innych chorób, które udało się dokładniej zdefiniować, takich jak
kardiomiopatia przerostowa (0,2%)12 lub zespół Wolffa-Parkinsona-White’a (0,1% do 0,3%).13
Częstość występowania anomalii tętnic wieńcowych z początkiem w niewłaściwej zatoce oraz tętnic wieńcowych z pojedynczym naczyniem w badaniach koronarograficznych wynosi od 0.28% do 1,74%.2,3,8,9,14-16 Biorąc pod uwagę ich znaczenie kliniczne, w naszym przeglądzie skupimy się właśnie na tych anomaliach.
PREZENTACJE KLINICZNE
Początkowo anomalie te rozpoznawano podczas koronarografii wykonywanej u pacjentów z wadą zastawkową lub chorobą niedokrwienną serca i uważano, że nie mają one znaczenia klinicznego. W późniejszym okresie zaczęły pojawiać się doniesienia o nagłych zgonach młodych sportowców, u których jedynym objawem choroby była anomalia mająca swoje źródło w tętnicach wieńcowych.8,17
Zakres kliniczny w momencie rozpoznania jest zróżnicowany: u niektórych pacjentów przebiega bezobjawowo, a u innych występuje dławica piersiowa, duszność, omdlenia, ostry zawał serca, niewydolność serca i nagły zgon.1,2,5,8,17-20 Uważa się, że CAA są drugą najczęstszą przyczyną nagłego zgonu u sportowców w Stanach Zjednoczonych.21
Czy to oznacza, że wszystkie CAA powinny być uważane za wskazujące na duże ryzyko? Absolutnie nie, ale ze strategicznego punktu widzenia należy je traktować jako „potencjalnie złośliwe” do czasu wykonania dodatkowych badań w celu wykluczenia niedokrwienia mięśnia sercowego wywołanego anomalią.
Poważne obawy budzi określenie, które CAA mogą przebiegać z nagłym zgonem. Obecnie wiemy, że te, które mają przebieg międzynaczyniowy (lub śródścienny), te, w których anomalna tętnica wieńcowa jest tętnicą dominującą i te, które dają objawy kliniczne u pacjentów poniżej 30 lub 35 roku życia, są tymi, w których częstość występowania nagłego zgonu jest największa.22-26
Z tego powodu nasze podejście do CAA powinno być różne w zależności od wieku pacjenta. U osób młodych, poniżej 35. roku życia, będziemy „skupiać się” na zapobieganiu nagłej śmierci, natomiast u osób powyżej 35. roku życia głównym celem będzie leczenie niedokrwienia mięśnia sercowego (ryc. 2).
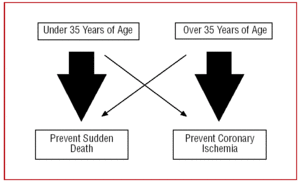
Rycina 2. Zróżnicowane podejście w zależności od wieku pacjenta.
Często, ze względu na swoje pochodzenie i anomalny przebieg, CAA mogą być uszkodzone podczas operacji wymiany zastawki, ale może to również nastąpić podczas przezskórnego zamykania otworu owalnego. Z tego powodu przed tego typu interwencjami należy wykluczyć obecność CAA.27-30
PATHOPHYSIOLOGY OF ISCHEMIA IN CORONARY ANOMALIES
Istnieje wiele teorii31 wyjaśniających mechanizmy wywołujące niedokrwienie w CAA, ale żadna z nich nie została jednoznacznie udowodniona. W jednej z nich uważa się, że przyczyną jest wyraźna angulacja anomalnej tętnicy w miejscu, w którym wychodzi ona z aorty. W przeciwieństwie do prawidłowej tętnicy wieńcowej, która u swego początku jest prostopadła do aorty, anomalna tętnica wieńcowa, aby dotrzeć z przeciwległej zatoki Valsalvy do swojego normalnego obszaru zaopatrzenia, musi się zagiąć. Z tego powodu ostium anomalnej tętnicy wieńcowej byłoby mniejsze, z grzbietami przypominającymi zastawkę, w porównaniu z prawidłowym ostium okrężnym i mogłoby ulec uciskowi w przypadku znacznego poszerzenia aorty, takiego jak obserwowane podczas intensywnego wysiłku fizycznego.32
Inna teoria dotyczy początkowego przebiegu CAA. Jeśli jest on śródtętniczy, między aortą a tętnicą płucną, wzrost ciśnienia w tych dwóch naczyniach, występujący podczas wysiłku, mógłby spowodować ucisk anomalnej tętnicy wieńcowej.33 Ponadto, jeśli początkowa droga jest śródścienna, niedrożność może być większa, ponieważ tętnica wieńcowa może ulec deformacji w obrębie ściany aorty w okresach nadciśnienia tętniczego.34
Niektórzy autorzy uważają, że mechanizm prowadzący do niedokrwienia polega na wytworzeniu skurczu w anomalnej tętnicy wieńcowej w wyniku uszkodzenia śródbłonka spowodowanego przez anomalną drogę,35 a inni, że doszłoby do wytworzenia intussusception proksymalnej części CAA w ścianie aorty.31
Wreszcie, wszystkie omówione mechanizmy mogą powodować ostre lub przewlekłe niedokrwienie (drobne zdarzenia niedokrwienne) prowokujące zwłóknienie mięśnia sercowego, które z kolei może być przyczyną generowania śmiertelnych arytmii.36
JAK DIAGNOZUJE SIĘ ANOMALIĘ KORONARNĄ?
Rozpoznanie wymaga wysokiego wskaźnika podejrzliwości i oceny jej obecności w określonych okolicznościach. Jak już wspomnieliśmy, większość CAA jest wykrywana przypadkowo podczas koronarografii wykonywanej u pacjentów z chorobą niedokrwienną serca lub wadą zastawkową poddawanych temu badaniu przed operacją wymiany zastawki.
Największe wyzwanie diagnostyczne stanowią osoby młode, u których nie stwierdza się czynników ryzyka choroby wieńcowej ani towarzyszącej jej wady zastawkowej. Powinniśmy podejrzewać CAA w przypadku omdleń związanych z wysiłkiem, duszności lub bólu w klatce piersiowej wskazujących na dławicę piersiową.24,26,35 Oczywiście pierwszym badaniem diagnostycznym, które wszyscy wykonujemy, jest standardowa ergometria. Wykazano jednak, że nie jest ona zbyt przydatna u tego typu pacjentów, ponieważ zwykle jest ujemna, co świadczy o tym, że niedokrwienie spowodowane CAA występuje sporadycznie.35,36
W związku z tym, biorąc pod uwagę, że testy „czynnościowe” nie są zbyt pomocne, musimy zdecydować się na badanie obrazowe, które umożliwia zbadanie anatomii naczyń wieńcowych. Początkowo zalecanym badaniem nieinwazyjnym jest echokardiografia przezklatkowa (TTE).7,26,37-40 U większości tych chorych wykonanie prostego TTE w projekcji przymostkowej w osi krótkiej w płaszczyźnie korzenia aorty pozwala na odróżnienie obu ostiów wieńcowych, a nawet na określenie początkowego przebiegu CAA. Pellicia i wsp. przebadali 1360 sportowców elity za pomocą echokardiografii, uwidaczniając ostium i proksymalny odcinek lewej głównej tętnicy wieńcowej w 97% przypadków i prawej głównej tętnicy wieńcowej w 80%.41
Ostatnio Frommelt i wsp.34 wykonali badanie echokardiograficzne u wszystkich dzieci i młodzieży (zakres wieku od 3 miesięcy do 20 lat) skierowanych do ich szpitala (1997-2002) z objawami niedokrwienia mięśnia sercowego, podejrzeniem wrodzonej choroby serca lub bólami mięśniowo-szkieletowymi. U wszystkich wykonano konwencjonalne badanie TTE z zastosowaniem dopplerowskiego kolorowego mapowania przepływu w celu określenia kierunku przepływu krwi. Zidentyfikowano 10 pacjentów z anomalią pochodzenia tętnicy wieńcowej w niewłaściwej zatoce (6 pacjentów z lewą tętnicą wieńcową pochodzącą z prawej zatoki Valsalvy i 4 z prawą tętnicą wieńcową pochodzącą z lewej zatoki Valsalvy). Stosując technikę TTE z kolorowym Dopplerem, zaobserwowali u 9 chorych przebieg śródścienny w obrębie ściany aorty, a u pozostałej osoby przebieg wewnątrzsercowy. Gdy przebieg CAA pochodzącego z niewłaściwej zatoki jest śródścienny, może się wydawać, że wyłania się on z prawidłowego ostium. Autorzy zalecają więc wykorzystanie kolorowego Dopplera do określenia kierunku przepływu, gdy konieczne jest wykluczenie obecności anomalii.
Doskonałość technik obrazowania echokardiograficznego pozwala na określenie pochodzenia i śledzenie początkowego przebiegu CAA w pewnych grupach chorych. Badania przeprowadzono u dzieci, młodzieży i elitarnych sportowców, ale duże serie obejmujące prawidłową populację osób dorosłych nie zostały jeszcze przebadane. Dlatego u młodych pacjentów z tą symptomatologią należy systematycznie przeprowadzać identyfikację ostróg wieńcowych w badaniu TTE.7,26
W przypadku pacjentów ze słabym oknem echokardiograficznym lub gdy mimo wskazań klinicznych utrzymują się wątpliwości diagnostyczne, aby umożliwić uwidocznienie początku i początkowego przebiegu CAA, można wykonać echokardiografię przezprzełykową (TEE),7,26,42,43 tomografię komputerową (CT)26,44-46–z wiązką elektronów lub wielowarstwową–(ryc. 3) lub rezonans magnetyczny serca (CMRI)26,47,48 (ryc. 4).

Rycina 3. Obraz wielorzędowej tomografii komputerowej przedstawiający tętnicę wieńcową okalającą (Cx) wywodzącą się z prawej tętnicy wieńcowej (CD), biegnącą za aortą i dochodzącą do swojego normalnego terytorium dystrybucji. Ao oznacza aortę; AP, tętnica płucna. Dzięki uprzejmości Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Hiszpania.
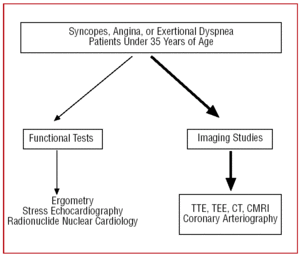
Rycina 4. Protokół diagnostyczny proponowany u pacjentów poniżej 35 roku życia z podejrzeniem anomalii tętnic wieńcowych. CMRI oznacza rezonans magnetyczny serca; CT – tomografię komputerową; TEE – echokardiografię przezprzełykową; TTE – echokardiografię przezklatkową.
Którą technikę powinniśmy zastosować i w jakiej kolejności? Każdy zespół medyczny powinien odpowiedzieć na to pytanie zgodnie z dostępnymi technikami i własnym doświadczeniem. To, co powinniśmy zrobić, to zidentyfikować CAA i jego początkowy przebieg za pomocą najmniej inwazyjnej z dostępnych nam technik. Chociaż TEE był wykorzystywany w diagnostyce i identyfikacji początkowego przebiegu niektórych CAA, uważamy, że ze względu na jego półinwazyjny charakter powinien być stosowany tylko wtedy, gdy inne techniki zawiodły. Obecnie, dzięki coraz większej dostępności i doskonałym trójwymiarowym obrazom, które można uzyskać, rozsądne wydaje się wybranie wielodetektorowej TK (ryc. 5) lub CMRI.49,50 Standardowa koronarografia byłaby wskazana, gdyby inne badania nie doprowadziły do ostatecznego rozpoznania. W związku z tym w opublikowanym w kwietniu 2005 roku dokumencie 36th Bethesda Conference51 dotyczącym selekcji sportowców wyczynowych z anomaliami układu sercowo-naczyniowego zalecono: „Anomalie wieńcowe powinny być brane pod uwagę u sportowców z omdleniami wysiłkowymi lub objawową komorową arytmią i powinny być badane za pomocą odpowiednich badań, takich jak echokardiografia, CMR lub obrazowanie ultraszybką tomografią komputerową. Angiografia wieńcowa jest wskazana, jeśli inne badania nie są diagnostyczne.” W skrócie, nie optują za 1 badaniem diagnostycznym lub innym.
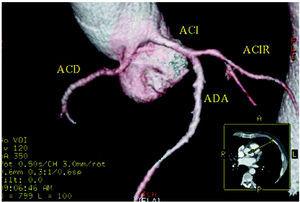
Rycina 5. Wielorzędowa tomografia komputerowa (16 warstw); rekonstrukcja trójwymiarowa ukazująca prawą tętnicę wieńcową (ACD) wychodzącą z lewej zatoki Valsalvy. ACI indiactes left coronary artery; ACIR, circumflex coronary artery; ADA, anterior descending coronary artery. Dzięki uprzejmości dr Joaquína Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spain.
W przypadku pacjentów w wieku powyżej 35 lat, którzy zgłaszają się z klinicznymi objawami dławicy piersiowej lub powtarzającymi się omdleniami, po przeprowadzeniu testu czynnościowego (ergometria, echokardiografia wysiłkowa itp.) zwykle wykonuje się cewnikowanie, ponieważ większa częstość występowania miażdżycy prowadzi do podejrzenia choroby wieńcowej. W niektórych ośrodkach dysponujących odpowiednią technologią pacjenci z nietypowym obrazem klinicznym mogą być poddani wstępnym badaniom przesiewowym za pomocą wielorzędowej tomografii komputerowej lub CRMI. W każdym z tych przypadków CAA będzie wynikiem badania (ryc. 6).
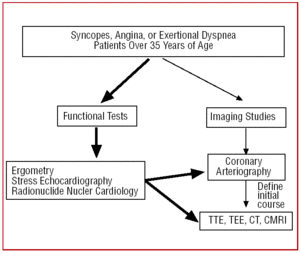
Ryc. 6. Protokół diagnostyczny proponowany u pacjentów powyżej 35 roku życia z podejrzeniem anomalii tętnic wieńcowych. CRM oznacza rezonans magnetyczny serca; CT – tomografię komputerową; TEE – echokardiografię przezprzełykową; TTE – echokardiografię przezklatkową.
JAK IDENTYFIKUJE SIĘ WSTĘPNY KIERUNEK ANOMALII WIEŃCOWEJ?
Jest to jeden z najbardziej złożonych punktów badania CAA i stanowi podstawowy aspekt identyfikacji ryzyka.
Na wstępie należy wziąć pod uwagę fakt, że nazwa i charakter tętnicy wieńcowej są określane na podstawie terytorium, które zaopatruje, a nie na podstawie jej pochodzenia. Tak więc tętnica wieńcowa, która powstaje w prawej zatoce Valsalvy i odgałęzia się, zaopatrując terytoria tętnic przednich zstępujących i okalających (Cx), nie jest prawą tętnicą wieńcową, ale lewą główną tętnicą wieńcową, której początek znajduje się w niewłaściwej zatoce. Kiedy tętnica wieńcowa powstaje w nieprawidłowej zatoce, jej nazwa, charakter, a nawet funkcja pozostają takie same; jedynie jej początek i początkowy przebieg są anomalne.2
Po powstaniu w nieprawidłowej zatoce Valsalvy anomalna tętnica wieńcowa może dotrzeć do swojego prawidłowego terytorium zaopatrzenia co najmniej pięcioma różnymi drogami2,52:
1. Siatkowatą, za zastawką mitralną i trójdzielną.
2. Zaaortalny, zwykle z Cx pochodzącym z prawej zatoki Valsalvy lub prawej tętnicy wieńcowej, przylegający do tylnej ściany aorty, w bruździe między przedsionkiem a aortą (zatoka poprzeczna) (ryc. 3).
3. przedaortalny lub międzypłucny (pomiędzy aortą a tętnicą płucną), w którym anomalna prawa tętnica wieńcowa, lewa przednia zstępująca lub lewa główna tętnica wieńcowa przecinają przegrodę międzykomorową lub przestrzeń aortalno-płucną. Jest to przebieg, który najczęściej był związany z objawami niedokrwienia i/lub nagłego zgonu (ryc. 7 i 8).
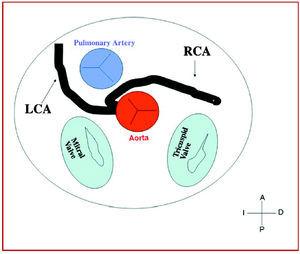
Ryc. 7. Schemat przedstawiający przebieg międzytętniczy prawej tętnicy wieńcowej (RCA) wywodzącej się z zatoki kontrolno-bocznej.
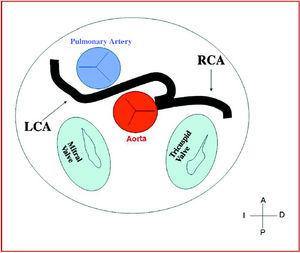
Rycina 8. Schemat przedstawiający przebieg międzytętniczy lewej tętnicy wieńcowej (LCA) wywodzącej się z zatoki kontrolno-bocznej.
4. Śródściennie, przez górną część przegrody międzykomorowej. W większości przypadków ma charakter wewnątrzsercowy i jest rozpoznawana w badaniu angiograficznym z powodu skurczowego zwężenia, podobnego do mostka mięśniowego, oraz dlatego, że w tej strefie zwykle występują 1 lub 2 gałęzie perforatora przegrodowego (ryc. 9).

Ryc. 9. Schemat przedstawiający wewnątrzprzegrodowy przebieg lewej tętnicy wieńcowej (CI) wywodzącej się z prawej zatoki Valsalvy.
5. Przedsercowa lub przedpłucna, charakteryzuje się lokalizacją podwsierdziową, w przedniej ścianie drogi odpływu prawej komory lub infundibulum. Po tym przejściu zwykle występuje anomalia prawej tętnicy wieńcowej, pnia głównego lewej tętnicy wieńcowej lub przedniej zstępującej lewej tętnicy wieńcowej.
Donoszono o innych możliwych przebiegach lub nawet kilku przebiegach u danego pacjenta.2
Jak można zidentyfikować te początkowe przebiegi za pomocą koronarografii? Początkowo uważano, że wprowadzenie prowadnika do tętnicy płucnej, a następnie wykonanie koronarografii w projekcji bocznej będzie wystarczające do określenia relacji między anomalią a dużymi naczyniami. Technika ta ma jednak ograniczoną wartość, ponieważ na przykład w projekcji bocznej zarówno przebieg przegrodowy, jak i międzypłacikowy wydają się być położone za tętnicą płucną i przed aortą, podczas gdy w rzeczywistości przebieg przegrodowy znajduje się ogonowo w stosunku do obu naczyń.53
Donoszono również o różnych cechach koronarografii umożliwiających rozpoznanie anomalii i jej początkowego przebiegu, nawet przed wizualizacją. W związku z tym Page i wsp.54 proponują dwie oznaki umożliwiające rozpoznanie anomalnego pochodzenia Cx i jej początkowego przebiegu:
1. Objaw „unperfused myocardium”. Podczas selektywnej opakeracji lewej tętnicy wieńcowej w tylno-bocznej strefie lewej komory można zaobserwować awaskularny obszar, który wskazuje na anomalne pochodzenie Cx. W pierwszej kolejności konieczne jest podanie środka kontrastowego do lewej zatoki wieńcowej, aby wykluczyć zajęcie ostiów niezależnych od tętnicy przedniej zstępującej i Cx. Jeśli jednak identyfikacja Cx nie jest jednoznaczna, należy pamiętać, że częściej obserwuje się Cx pochodzącą z prawej zatoki wieńcowej lub z prawej tętnicy wieńcowej niż obecność oddzielnych ostiów w lewej zatoce wieńcowej.55
2. Objaw „korzenia aorty”. W wentrykulografii w projekcji skośnej przedniej prawej uwidacznia się kontur anomalii Cx i śledzi jej przebieg, przechodząc za prawą zatokę wieńcową (ryc. 10).
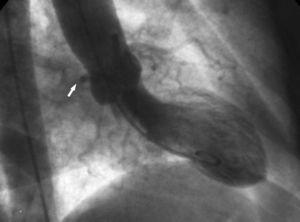
Ryc. 10. Wentrikulografia w projekcji skośnej przedniej prawej ukazująca kontur anomalnej tętnicy okalającej (strzałka) przechodzącej za prawą zatoką wieńcową; jest to objaw korzenia aorty lub objaw Page’a.
W 1985 roku Ishikawa i wsp,56 a następnie Serota i wsp. w 1990 roku,57 zaproponowali szereg kryteriów koronarograficznych mających na celu określenie relacji, wzdłuż początkowego przebiegu, pomiędzy anomalnym naczyniem a aortą i tętnicą płucną (ryc. 11). Autorzy ci podjęli próbę identyfikacji różnych przebiegów na podstawie orientacji „pętli” utworzonej przez anomalną tętnicę wieńcową z resztą drzewa wieńcowego56 lub stosując koncepcję „kropki” (wizualizacja kolumny kontrastowej CAA, która ze względu na wykonywany przez nią skręt przyjmuje morfologię kropki57).
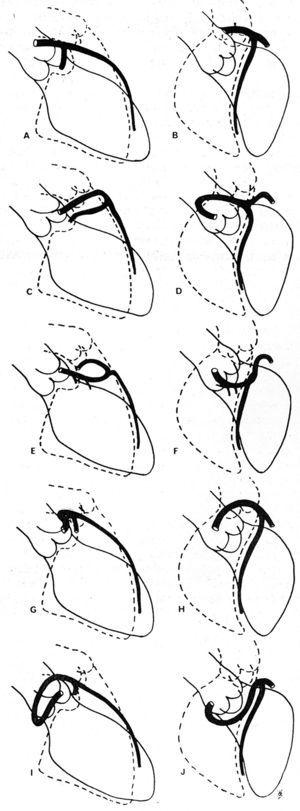
Ryc. 11. Ilustracje obrazów koronarografii lewej tętnicy wieńcowej przedniej zstępującej i proksymalnej okalającej w projekcji skośnej przedniej prawej (A, C, E, G, I) oraz w projekcji skośnej przedniej lewej (B, D, F, H, J), przedstawiające różne możliwe początkowe przebiegi lewej tętnicy wieńcowej, rozpoczynającej się w prawej zatoce Valsalvy. A i B przedstawiają prawidłową tętnicę wieńcową; C i D pokazują „pętlę” przedczaszkową, opisaną w przebiegu przednim; E i F: „pętlę” przednio-czaszkową, przebieg przegrodowy; G i H: „pętlę” tylno-czaszkową, przebieg międzyprzegrodowy; I i J: „pętlę” tylno-czaszkową, przebieg zaaortalny. Taken from Ishikawa et al.56
W wielu przypadkach identyfikacja początkowego przebiegu CAA za pomocą koronarografii jest trudna, ponieważ technika ta zapewnia dwuwymiarowy widok drzewa wieńcowego, które jest złożoną strukturą trójwymiarową. Kardiologowi interwencyjnemu doświadczonemu w rozpoznawaniu CAA, koronarografia może wystarczyć do prawidłowej identyfikacji przebiegu. Jednak ze względu na małą częstość ich występowania, większość kardiologów interwencyjnych ma ograniczone doświadczenie w badaniu CAA. Dlatego w zdecydowanej większości przypadków nie są one prawidłowo opisywane. W niedawno przeprowadzonym rejestrze obejmującym 13 hiszpańskich szpitali w większości przypadków nie zidentyfikowano początkowego przebiegu zgłaszanych CAA.16
W związku z tym w wielu przypadkach identyfikacja początkowego przebiegu CAA mającego początek w niewłaściwej zatoce wymaga zastosowania dodatkowej techniki obrazowania. Jak już wspomnieliśmy, do tego celu można wykorzystać zarówno TTE, jak i TEE, ale ze względu na coraz większą dostępność w naszych szpitalach technik nieinwazyjnych, które pozwalają na bardziej prawidłowe i dokładne określenie anatomii naczyń wieńcowych i ich relacji do struktur przyległych u pacjentów, którzy mogą być kandydatami do zabiegu, wybieramy CMRI lub wielorzędową tomografię komputerową.35,37,47,49
JAKIE JEST NAJLEPSZE PODEJŚCIE TERAPEUTYCZNE?
Jest to jeden z najbardziej kontrowersyjnych aspektów tego schorzenia, ponieważ nie ustalono oficjalnych wytycznych w tym zakresie.
Po rozpoznaniu i scharakteryzowaniu CAA logiczna wydaje się próba określenia, czy nie prowokuje on niedokrwienia mięśnia sercowego. Jeżeli pacjent przebył zawał mięśnia sercowego (bez uchwytnego związku z miażdżycą) lub przeszedł resuscytację z powodu nagłego zgonu spowodowanego anomalią i jest w wieku poniżej 35 lat, większość autorów zaleca rewaskularyzację.24,26,35
W procesie decyzyjnym pomocna będzie talowa próba wysiłkowa lub badanie echokardiograficzne w warunkach stresu farmakologicznego lub wysiłkowego, wykazujące odwracalne niedokrwienie w obszarze anomalii.36
Co należy zrobić w przypadku młodych, bezobjawowych osób, u których CAA wykryto przypadkowo, jeśli spełnione są kryteria ryzyka, ale próba wysiłkowa nie wykazała niedokrwienia? Po pierwsze, pacjent powinien prowadzić siedzący tryb życia.26,35
Corrado i wsp. porównali nagłe zgony u młodych sportowców i osób nieuprawiających sportu i tylko te, które przypisano CAA lub arytmogennej dysplazji prawej komory, były związane z wysiłkiem.58 Co do leczenia, rewaskularyzacja jest kontrowersyjna, ale są autorzy, którzy opowiadają się za tym podejściem, ponieważ u tych pacjentów nagły zgon jest nieprzewidywalny i może być pierwszym objawem CAA.24,26,34,35 Niektórzy autorzy są zwolennikami corocznych wizyt kontrolnych w tych przypadkach, z wykonywaniem echokardiogramów lub testów wysiłkowych z talem, i opierają swoje decyzje na ich wynikach.7,36 Po leczeniu chirurgicznym chorzy prowadzą normalny tryb życia, w tym uprawiają sport.25,34,49
W przypadku chorych powyżej 35. roku życia decyzje należy podejmować indywidualnie. Ryzyko nagłego zgonu jest mniejsze, ale ponieważ CAA może prowokować objawowe niedokrwienie mięśnia sercowego, w niektórych przypadkach wykonuje się rewaskularyzację (ryc. 12).24,26
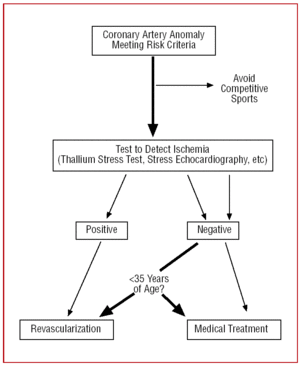
Rycina 12. Protokół terapeutyczny proponowany dla anomalii wieńcowych z początkiem w kontralateralnej zatoce Valsalvy w obecności czynników ryzyka.
Niektóre grupy badają wykorzystanie pewnych protokołów diagnostycznych (echokardiografia wewnątrzwieńcowa w celu oceny anomalnego ostium wieńcowego w spoczynku i po infuzji dobutaminy lub przeciążeniu płynami)59 lub wykorzystanie wewnątrzwieńcowych przewodów ciśnieniowych w celu wykrycia niedokrwienia.60
Jak można zauważyć, do czasu ustalenia oficjalnych wytycznych w tej kwestii najrozsądniejszym podejściem wydaje się, po pierwsze, potwierdzenie, czy wiek pacjenta i anatomia CAA wiążą się z ryzykiem, a po drugie, sprawdzenie, czy niedokrwienie wieńcowe (prezentowane przez pacjenta lub wykazane) jest wyraźnie prowokowane przez anomalię.
JAK NALEŻY WYKONYWAĆ REWASKULARYZACJĘ?
Logicznie rzecz biorąc, każdy przypadek należy traktować indywidualnie, zgodnie z anatomią naczyń wieńcowych, dlatego rewaskularyzacja może być chirurgiczna lub przezskórna.
Rewaskularyzacja chirurgiczna obejmuje pomostowanie aortalno-wieńcowe, reimplantację ostialną lub technikę unroofing, która uwalnia śródścienny segment CAA poprzez nacięcie ściany wspólnej dla CAA i aorty, tworząc w ten sposób nowy, większy otwór w odpowiedniej zatoce.61,62 Istnieje wiele kontrowersji dotyczących rewaskularyzacji chirurgicznej u tych chorych, zwłaszcza u młodych osób. Pomostowanie aortalno-wieńcowe jest mocno krytykowane7,63 z powodu jego „ograniczonej” drożności i nieuniknionego konkurencyjnego przepływu między bypassem a CAA. Dlatego coraz częściej stosuje się technikę odbarczenia, która wydaje się być bardziej fizjologiczna62.
Przezskórną interwencję z implantacją stentów w miejscu ucisku między dużymi naczyniami i w anomalnym ostium wykonano w kilku przypadkach u dorosłych, z krótkotrwałym powodzeniem64. Jak dotąd rewaskularyzacja chirurgiczna jest preferowana u młodych pacjentów, a zabieg przezskórny wykonuje się tylko u dorosłych.26,62-64 W obu przypadkach konieczna jest długoterminowa obserwacja.
CZY LECZENIE MEDYCZNE JEST OPCJĄ?
Brak serii i badań kontrolowanych utrudnia odpowiedź na to pytanie. Istnieją doniesienia obejmujące 2-letnią i 5-letnią obserwację pacjentów, u których lub pacjentów, którzy odmówili leczenia operacyjnego, zastosowano postępowanie wyczekujące lub leczenie beta-blokerami, i wśród których nie odnotowano przypadków nagłego zgonu.65-68 Niektórzy autorzy opowiadają się jednak przeciwko decyzji o rozpoczęciu „dożywotniego” leczenia u dzieci i młodzieży.7
MAJOR UNSOLVED PROBLEMS
Nieznane jest rzeczywiste ryzyko nagłego zgonu związane z każdą anomalią.5 Powodem tego jest fakt, że ryzyko to oblicza się na podstawie badań autopsyjnych, które nie wskazują na rzeczywiste ryzyko zgonu osoby w wyniku CAA, ale sugerują możliwość, że osoba, u której wystąpił nagły zgon, ma CAA.7 Ponadto obliczone ryzyko może być zawyżone w stosunku do populacji ogólnej, ponieważ uzyskano je na podstawie serii badań sportowców wyczynowych, u których, jak stwierdzono, ryzyko nagłego zgonu jest 2-krotnie większe niż u osób prowadzących siedzący tryb życia.69 Wiemy, że ryzyko nagłego zgonu z powodu CAA jest większe u ludzi młodych; w rzeczywistości zaleca się takie czy inne postępowanie terapeutyczne w zależności od tego, czy pacjent ma mniej niż 30 czy 35 lat. Te punkty odcięcia opierają się na nielicznych badaniach zajmujących się tym zagadnieniem23,25 i dlatego należy je traktować jedynie jako orientacyjne. Z tego powodu decyzja o sposobie leczenia powinna być zawsze podejmowana indywidualnie.
Jeśli zostanie przyjęte opisane powyżej rozwiązanie chirurgiczne, należy wziąć pod uwagę, że nie ma serii, w których przebieg chorych byłby badany przez ponad dwa lata. Do niepewności co do drożności by-passu dochodzi jeszcze możliwe uszkodzenie zastawki aortalnej, jakie może wywołać zabieg udrożnienia. W związku z tym istnieją doniesienia o niewydolności aortalnej lub nawet wymianie zastawki po tym zabiegu.7,70 Należy pamiętać, że operacje kardiochirurgiczne zawsze wiążą się z ryzykiem powikłań neurologicznych, których częstość występowania u młodych ludzi szacuje się na około 2,3%.71
Wreszcie, wytyczne dotyczące selekcji sportowców wyczynowych z anomaliami układu sercowo-naczyniowego zalecają wykluczenie pacjentów z CAA ze wszystkich sportów wyczynowych.51 Po raz kolejny dane z populacji sportowców ekstrapolowano na populację ogólną. U młodocianych pojęcie „wyczynowy” może być trudne do zdefiniowania. Co więcej, zakazywanie nastolatkowi lub młodemu dorosłemu uczestnictwa w zajęciach gimnastycznych lub uprawiania sportu, który może mu sprawiać przyjemność, może spowodować więcej szkód niż korzyści. Być może należy unikać forsownych sportów, ale nie mniej wymagającego sportu.7
Podsumowanie
Tętnice wieńcowe wywodzące się z nieprawidłowej zatoki Valsalvy stanowią grupę CAA najczęściej związanych z niedokrwieniem mięśnia sercowego, a w szczególności z nagłym zgonem.
Wskaźnik podejrzenia tej anomalii powinien być wysoki u młodych pacjentów wykazujących kliniczne objawy dławicy piersiowej, duszności lub omdleń wysiłkowych. W tych przypadkach należy wykonać TTE w celu identyfikacji ujść i początkowego przebiegu obu tętnic wieńcowych.
Powinniśmy jasno określić początkowy przebieg każdej anomalii tętnicy wieńcowej, stosując techniki obrazowania, takie jak TTE, TEE, a najlepiej wielorzędową tomografię komputerową lub CMRI, zgodnie z charakterystyką naszego szpitala.
Musimy nadać priorytet tworzeniu krajowych i międzynarodowych rejestrów, które umożliwią nam określenie częstości występowania tych anomalii, a także związanych z nimi wskaźników zachorowalności i śmiertelności, rokowania, leczenia, możliwych wpływów genetycznych lub środowiskowych i, krótko mówiąc, dowiedzenie się jak najwięcej na ten temat.
Niezbędne jest prowadzenie długoterminowej obserwacji pacjentów, którzy przeszli operację z powodu CAA, zwłaszcza osób młodych. W każdym przypadku rewaskularyzacja (chirurgiczna lub przezskórna) może być ważna dla pacjentów z tym typem choroby.
ACKNOWLEDGEMENTS
Dziękujemy dr Joaquín Alonso i dr Gabriel C. Fernández za pomoc w uzyskaniu obrazów wielodetektorowej tomografii komputerowej.