Gdy wodór jest związany kowalencyjnie z wysoce elektronegatywnym atomem, takim jak fluor, chlor, tlen lub azot, atom H ma częściowy ładunek dodatni, napisany Hδ+.
Hδ+ jest fizycznie bardzo mały, więc gęstość ładunku na nim jest niezwykle wysoka.
Wyobraź sobie, że inny ujemny lub elektronegatywny atom, powiedzmy w innej cząsteczce, zbliża się do Hδ+; nastąpi wzajemne przyciąganie, w wyniku czego powstanie szczególnie silne przyciąganie dipol-dipol.To przyciąganie nazywa się wiązaniem wodorowym.
Ogólnie rzecz biorąc, wiązania wodorowe są słabsze niż wiązania jonowe i kowalencyjne, ale są silniejsze niż siły van der Waalsa.

Wiązanie wodorowe w wodzie
Najlepiej znanym przykładem wiązania wodorowego jest woda:
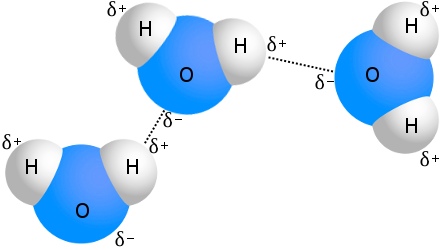
Każda cząsteczka wody może być związana wodorem aż z czterema innymi cząsteczkami wody.W wodzie w temperaturze pokojowej, średnia liczba wiązań wodorowych na cząsteczkę wody wynosi 3,6.
Przypadkowy ruch termiczny cząsteczek zapewnia, że czas życia każdego pojedynczego wiązania wodorowego w wodzie jest krótki, średnio tylko 10 pikosekund.Jednak czas tworzenia nowego wiązania jest jeszcze krótszy.
Trwałe przerwanie pojedynczego wiązania wodorowego w wodzie wymaga 21 kJ mol-1, znacznego nakładu energii.W rezultacie temperatury topnienia i wrzenia wody są znacznie wyższe niż można by się spodziewać dla cząsteczek o tak małej masie cząsteczkowej.
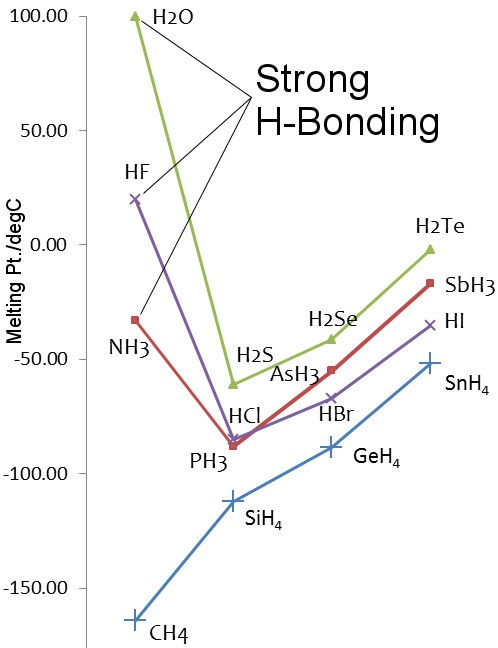
Rozważmy wodę vs metan.Cząsteczki wody są raczej silnie przyciągane do siebie przez wiązania wodorowe, podczas gdy w metanie przeważają siły van der Waalsa.Tak więc, chociaż ich masy cząsteczkowe są podobne, na poziomie 18 dla wody i 16 dla metanu, ich właściwości fizyczne są bardzo różne.Na przykład, woda topi się w temperaturze 0,00 °C i wrze w temperaturze 99,98 °C; metan topi się w temperaturze -182,5 °C i wrze w temperaturze -161,5 °C.
Wiązanie wodorowe w wodzie vs siarkowodór
Siarka jest w grupie 16 układu okresowego, tak samo jak tlen. Siarka jest cięższa od tlenu, więcH2S powinna mieć wyższe temperatury topnienia i wrzenia niż H2O.Jednak tak nie jest, ponieważ siarka jest mniej elektroujemna niż tlen, a zatem wiązanie wodorowe w H2S jest słabe.

Mol. Mass: 16
Pt. topnienia: 0,00 °C
Pt. wrzenia: 99,98 °C
Elektronegatywność O (Paulinga): 3,44
Intalpia wiązania wodoru: 21 kJ mol-1

Mol. Mass: 34
Melt Pt.: -82 °C
Boil Pt.: -60 °C
Elektronegatywność S (Pauling): 2.58
Intalpia wiązania wodorowego: ≅ 3 kJ mol-1
Wiązanie wodorowe w amoniaku i fluorowodorze
Fluor i azot są najbardziej elektronegatywnymi pierwiastkami w swoich grupach układu okresowego, a wiązanie wodorowe obserwuje się we fluorowodorze i amoniaku.
Tak jak w przypadku wody, temperatury topnienia i wrzenia fluorowodoru i amoniaku są wyższe niż wodorków cięższych pierwiastków w ich grupach.
Punkty topnienia wodorków pierwiastków grupy 14-17
Wiązanie wodorowe w DNA
Pary zasad DNA łączą jego dwa łańcuchy helisy.pary zasad przenoszą informację genetyczną DNA.
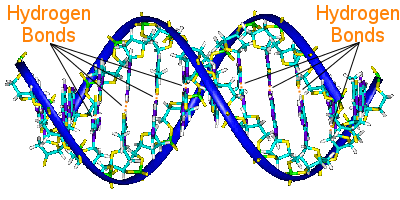
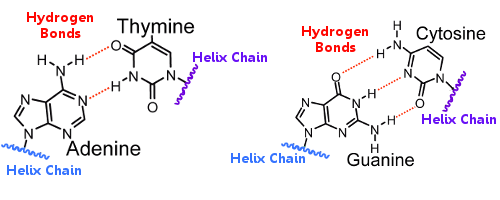
Pary zasad na jednej helisie są połączone z parami zasad na drugiej helisie za pomocą wiązań wodorowych.W ten sposób wiązanie wodorowe utrzymuje helisy razem, tworząc słynną podwójną helisę.
Gdy DNA replikuje się, wiązania wodorowe pękają, pozwalając dwóm helisom się rozdzielić.W ten sposób wiązanie wodorowe odgrywa zasadniczą rolę w mechanizmie blokowania par zasad w replikacji DNA.
Wiązanie wodorowe w wełnie
Podobnie jak inne włókna białkowe, wełna posiada wiązanie wodorowe.Poniższy obraz pokazuje, jak wiązania wodorowe (pomarańczowe kropki) łączą zwoje łańcucha α-helisy wełny (zielone).
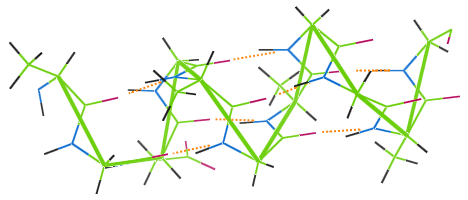
Jeśli wełniane ubranie jest prane w wysokiej temperaturze, wiązania wodorowe są niszczone, spirale tracą elastyczność, a ubranie staje się nietrwałe.

.