- Układ odpornościowy
- Wrodzona i adaptacyjna odpowiedź immunologiczna
- Komponenty układu odpornościowego
- Komórki limfoidalne
- Komórki T
- Komórki B
- Komórki NK
- Komórki mieloidalne
- Makrofagi
- Komórki dendrytyczne
- Inne komórki wrodzonego układu odpornościowego i sygnalizacja
- Immunologia w zdrowiu i chorobie
- Immunologia nowotworów
Układ odpornościowy
Układ odpornościowy składa się z tkanek, komórek i cząsteczek, których podstawową funkcją jest wykrywanie, reagowanie i eliminowanie patogenów i przekształconych komórek.
Wrodzona i adaptacyjna odpowiedź immunologiczna
Istnieją dwa główne składniki układu odpornościowego-1) wrodzony układ odpornościowy i 2) adaptacyjny układ odpornościowy. Wrodzony układ odpornościowy działa jako pierwsza linia obrony i wykrywa patogeny za pośrednictwem zakodowanych w linii zarodkowej receptorów rozpoznawania wzorców, nie tworzy pamięci i reaguje szybko (w ciągu minut do godzin). Adaptacyjny układ odpornościowy reaguje powoli (w ciągu kilku dni), wykorzystuje receptory swoiste dla antygenów, które w trakcie rozwoju przechodzą wielokrotne rearanżacje genów, i tworzy pamięć immunologiczną – „uczy się” na podstawie początkowego urazu i przygotowuje organizm do walki z przyszłym narażeniem na podobny szkodliwy materiał. Oba typy odpowiedzi immunologicznej mogą być wywołane przez makrocząsteczki znajdujące się w płynie pozakomórkowym lub przez aktywację specyficznych komórek odpornościowych. Te odpowiedzi są znane odpowiednio jako odporność humoralna i odporność pośredniczona przez komórki.
Pod parasolem odpowiedzi immunologicznej pośredniczonej przez komórkę, komórki odpornościowe najczęściej dzielą się na podstawie tego, czy odpowiedź jest wrodzona czy adaptacyjna. Wrodzony układ odpornościowy składa się głównie z komórek fagocytujących, takich jak neutrofile, makrofagi, naturalne komórki zabójcze, bazofile i inne, które zwalczają niebezpieczne organizmy inwazyjne. Komórki adaptacyjnego układu odpornościowego to limfocyty T i komórki B. Naturalnie zabójcze (NK) limfocyty T posiadają cechy zarówno wrodzonych, jak i adaptacyjnych komórek odpornościowych. Ponadto, większość innych typów komórek, które nie są specyficzne dla układu odpornościowego, może posiadać wewnętrzne wrodzone funkcje odpornościowe w postaci cytoplazmatycznych receptorów oraz cząsteczek sygnalizacyjnych i efektorowych, takich jak członkowie rodzin RIG-I, STING i NLR. Jak wyjaśnimy dalej, komórki obu systemów powstają z różnych linii mieloidalnych i limfoidalnych hematopoetycznych komórek macierzystych.
Komponenty układu odpornościowego
Dojrzałe komórki odpornościowe różnicują się z tego, co jest znane jako hematopoetyczne komórki macierzyste. Są to pluripotencjalne, niezróżnicowane komórki progenitorowe występujące w szpiku kostnym, krwi obwodowej i łożysku. Te hematopoetyczne komórki macierzyste mogą różnicować się we wspólne mieloidalne komórki progenitorowe lub wspólne limfoidalne komórki progenitorowe.
Komórki limfoidalne
Wspólne limfoidalne komórki progenitorowe mogą różnicować się w cztery główne populacje limfocytów, które można wyróżnić na podstawie ekspresji receptorów na powierzchni komórki: komórki T, komórki B, komórki NK (natural killer) i komórki NK-T.
Komórki T
Komórki T odgrywają krytyczną rolę w odporności pośredniej. Komórki te są identyfikowane na podstawie ekspresji łańcuchów sygnałowych CD3 komórek T.
Komórki T powstają z limfoidalnych komórek progenitorowych, które pierwotnie rozwijają się z hematopoetycznych komórek macierzystych w szpiku kostnym. Gdy limfoidalny progenitor zdecyduje się przekształcić w komórkę T, migruje ze szpiku kostnego do grasicy (stąd nazwa komórki T). Grasica zapewnia odpowiednie mikrośrodowisko, w którym limfocyty T mogą rozwijać się w różne podtypy, określone przez specyficzne receptory znajdujące się na powierzchni komórek. Dojrzewające limfocyty T we wczesnych stadiach, czyli tymocyty, nie posiadają receptorów zarówno dla CD4 jak i CD8 i dlatego nazywane są komórkami podwójnie ujemnymi (DN). Komórki DN ulegają następnie genetycznym rearanżacjom i mutacjom genów kodujących receptory komórek T alfa i beta (TCR), co rozpoczyna ich drogę zaangażowania w linię, w wyniku czego powstaje receptor komórek T o specyficznym powinowactwie do unikalnego antygenu.
Tymocyty są następnie wybierane, zarówno pozytywnie jak i negatywnie, aby zapewnić, że rozpoznają „obce” antygeny, ale nie antygeny gospodarza, które są prezentowane jako peptydy przez MHC na powierzchni komórki. Tylko komórki, które przejdą oba testy, zostaną pobudzone do ekspresji CD4 i CD8, stając się komórkami podwójnie dodatnimi. Pod koniec dojrzewania limfocyty T będą wykazywać ekspresję CD4 lub CD8 (i stracą ekspresję drugiej z nich), stając się komórkami jednododatnimi. Te dojrzałe komórki T CD4 lub CD8-dodatnie są następnie uwalniane do krwioobiegu i początkowo znajdują się w stanie naiwnym, co oznacza, że nie zobowiązały się jeszcze do określonego podtypu komórek T.
Jeśli dojrzewający tymocyt wykazuje pośrednią ilość powinowactwa do własnych peptydów MHC podczas dojrzewania, wówczas może zostać wybrany, aby stać się komórką T regulatorową (Treg) ze względu na zdolność do rozpoznawania szkodliwych antygenów „ja”. Komórki T we krwi lub w tkankach obwodowych mogą być również lokalnie indukowane do przekształcenia się w Tregs. Głównym zadaniem Tregs jest utrzymanie tolerancji na antygeny własne, jak również ograniczenie funkcji i proliferacji komórek efektorowych T.
Po przybyciu do krwi lub tkanki obwodowej, naiwne komórki T mogą być indukowane do przekształcenia się w komórki T-helper. Komórki prezentujące antygen (APCs), takie jak makrofagi, komórki dendrytyczne i komórki B, pokażą antygen komórce T i jeśli ich receptor ma powinowactwo, komórka T rozpozna antygen. Zazwyczaj komórki T CD4+ są przystosowane do rozpoznawania antygenów peptydowych związanych z białkami MHC klasy II. Po rozpoznaniu kompleksu peptyd-MHC, komórka T aktywuje szereg wewnętrznych szlaków, które pozwalają na weryfikację rozpoznania antygenu. Tylko wtedy komórka T-helper będzie proliferować, rozszerzając pulę dostępnych komórek, które są specyficzne dla szkodliwego antygenu, takiego jak różne bakterie i pasożyty.
Po rozpoznaniu antygenu przez komórki T-helper i ich aktywacji, będą one uwalniać różne cytokiny, które są cząsteczkami sygnalizującymi innym komórkom układu odpornościowego, jak właściwie reagować na szkodliwą cząsteczkę. Istnieje kilka podzbiorów limfocytów T pomocniczych, w tym Th1, Th2 i Th17. Te podzbiory produkują i wydzielają różne cytokiny, które pomagają dostosować odpowiedź immunologiczną w zależności od rodzaju patogenu. Na przykład, komórki Th1 polegają na cytokinie efektorowej IFN-γ, która sygnalizuje makrofagom, aby strawiły i zniszczyły szkodliwy materiał, podczas gdy komórki Th2 wydzielają kombinację IL-4, IL-5, IL-9, IL-10 i IL-13, aby wyzwolić bazofile, eozynofile i inne komórki do zaatakowania infekcji. Konkretna ilość i odmiany cytokin określają właściwą odpowiedź na infekcję lub szkodliwą komórkę. Komórki T mogą również reagować na komórki własne, stając się cytotoksycznymi komórkami T (lub naturalnymi zabójczymi komórkami T). Zazwyczaj są to komórki CD8+, które rozpoznają komórki zainfekowane wirusem lub komórki nowotworowe. Naturalnie zabójcze limfocyty T (NKT) zostaną omówione bardziej szczegółowo w dalszej części rozdziału. Te i inne typy komórek T wykonują swoje różne obowiązki lub funkcje efektorowe na różne sposoby, aby rozpoznać szkodliwy materiał i zwerbować inne komórki odpornościowe do jego zniszczenia, a także zbudować trwałą odpowiedź immunologiczną na ten sam rodzaj obrażeń.
Interaktywna ścieżka sygnalizacji receptora komórki T jest szczegółowo opisana tutaj.
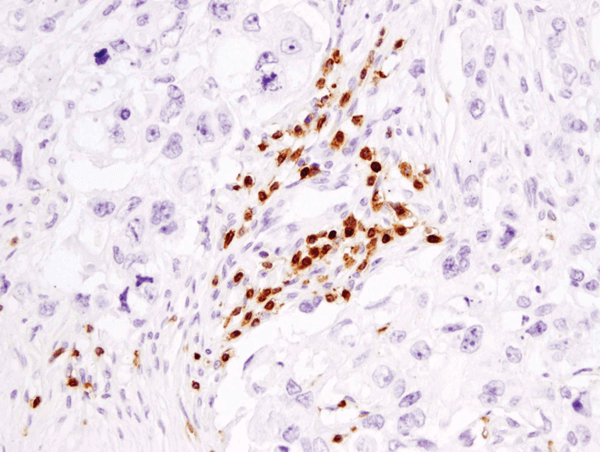
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Analiza IHC ludzkiego raka piersi zatopionego w parafinie z użyciem #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Analiza IHC ludzkiego raka piersi z warstwą parafinową przy użyciu #85061.
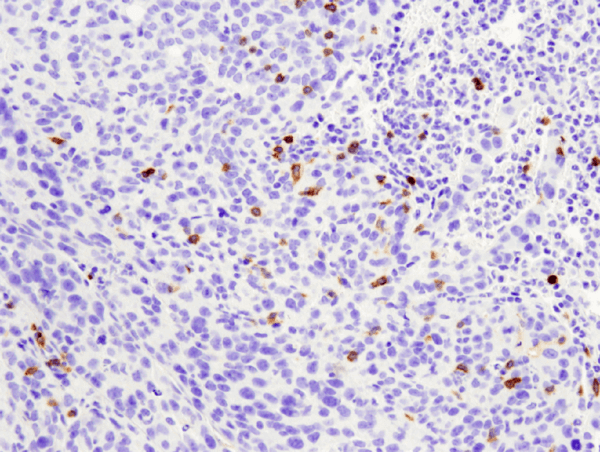
CD4 (D7D2Z) Rabbit mAb #25229: Analiza IHC zembedytowanego parafinowo guza przerzutowego 4T1 w płucach myszy przy użyciu #25229.
CD4 (D7D2Z) Rabbit mAb #25229: IHC analysis of paraffin-embedded 4T1 metastatic tumor in mouse lung using #25229.
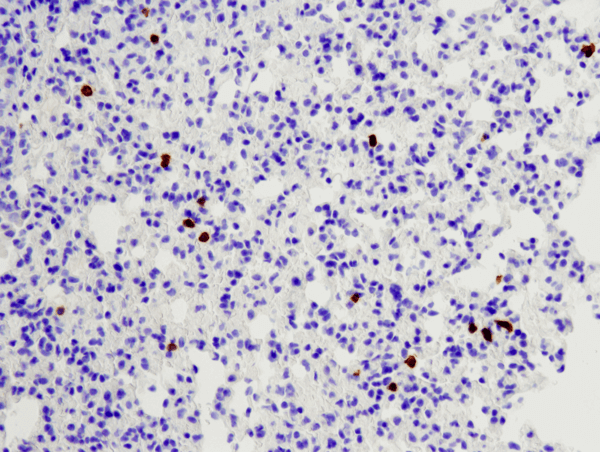
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC analiza parafinowoembededded płuc myszy przy użyciu #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC analysis of paraffin-embedded mouse lung using #98941.
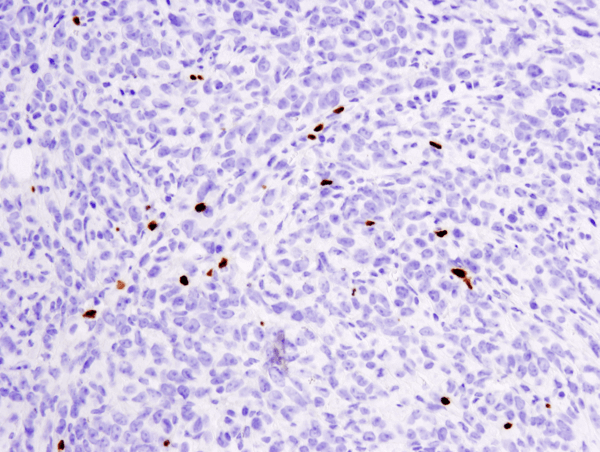
FoxP3 (D6O8R) Rabbit mAb #12653: Analiza IHC zembedded paraffin-embedded 4T1 metastatic tumor in mouse lung using #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: IHC analysis of paraffin-embedded 4T1 metastatic tumor in mouse lung using #12653.
Komórki B
Komórki B są krytycznymi komórkami we krwi, które pośredniczą w wytwarzaniu przeciwciał. Kiedy w krwiobiegu znajduje się szkodliwy materiał, jest on rozpoznawany jako antygen przez specyficzne receptory na komórkach B. Następnie, po przetworzeniu antygenu, komórki B produkują przeciwciała. Następnie, po przetworzeniu antygenu i z pomocą limfocytów T, komórki B dojrzewają do komórek plazmatycznych, które wydzielają przeciwciała. Komórki B mogą również odgrywać rolę w prezentowaniu antygenów i wydzielaniu cytokin. Zarówno rozwój, jak i różne funkcje komórek B zostaną omówione.
15% leukocytów znajdujących się we krwi obwodowej to komórki B. Komórki B wytwarzają immunoglobuliny (Ig), które są białkami wiążącymi antygen (zwanymi również przeciwciałami), składającymi się z dwóch identycznych łańcuchów ciężkich i dwóch identycznych łańcuchów lekkich. Te immunoglobuliny zawierają specyficzne miejsca wiążące antygen, które różnią się sekwencją aminokwasów w poszczególnych cząsteczkach przeciwciał. Miejsca te nadają specyficzność każdemu przeciwciału do rozpoznawania odrębnego antygenu.
Jak wspomniano powyżej, komórki B różnicują się z komórek hematopoetycznych znajdujących się w szpiku kostnym. To właśnie w szpiku kostnym receptory powierzchniowe Ig (przeciwciała) są montowane poprzez proces rearanżacji genów. Komórki B wykorzystują somatyczne łączenie się różnych genów na wielu chromosomach, które kodują różne części ciężkich i lekkich łańcuchów tworzących Ig. Komórki B są popychane w kierunku różnicowania poprzez produkcję IL-7 przez komórki zrębu szpiku kostnego. Te rozwijające się komórki B realizują program sekwencyjnej rearanżacji łańcuchów ciężkich i lekkich, w czym pośredniczy zróżnicowana ekspresja receptorów na powierzchni komórki. Na przykład, ekspresja specyficznego receptora komórek pre-B zapobiega pewnej rearanżacji genów na niepowiązanych chromosomach, aby zapewnić, że dojrzała komórka B może wyrażać określony receptor powierzchniowy Ig zdolny do specyficznego rozpoznawania pojedynczego antygenu. Proces ten nazywany jest wykluczeniem allelicznym. Nieprawidłowy montaż łańcuchów ciężkich i lekkich Ig może wywołać wtórną rearanżację w celu edycji receptora.
Poza ekspresją receptora Ig na powierzchni komórki, komórki B zawierają również białka transmembranowe, które mogą wywoływać sygnały wewnątrzkomórkowe po związaniu antygenu z zewnątrzkomórkową częścią receptora Ig. Komórki B wykorzystują podobne do komórek T wewnątrzkomórkowe kaskady sygnalizacyjne, które indukują zmiany transkrypcyjne prowadzące do proliferacji i dojrzewania. W szczególności, wewnątrzkomórkowe domeny receptora Ig mogą być fosforylowane przez kinazy z rodziny src, inicjując kaskadę, która jest przekazywana przez kinazę tyrozynową Syk i białko łącznikowe znane jako BLINK do fosfolipazy C i czynników wymiany guaniny, ostatecznie aktywując kinazę białkową C, mobilizując wapń i aktywując kinazę MAP w sposób zależny od Ras/Rac.
Unikalną cechą komórek B jest ich zdolność do przełączania izotypów. Odnosi się to w szczególności do procesu rearanżacji DNA, który może generować nieco inne łańcuchy ciężkie. Dodatkowo, alternatywne splicing eksonów łańcucha ciężkiego może pozwolić Ig na pozostanie związaną z powierzchnią komórki lub na wydzielanie, jeśli ekson transmembranowy zostanie splicingowany. Alternatywny splicing i zmiana izotypu są indukowane przez cytokiny pochodzące z komórek T. Dodatkowo komórki T mogą wywoływać mutacje somatyczne, które prowadzą do zmian w miejscach wiązania antygenów przez Ig komórek B. Samokorygująca się funkcja komórek B może wykryć, czy te pozornie przypadkowe mutacje prowadzą do utraty powinowactwa do antygenu i zainicjować program śmierci komórki. Tak więc antygeny, które aktywują zarówno komórki T, jak i komórki B, wyzwalają pośredniczone przez komórki T dojrzewanie komórek B poprzez przełączanie izotypów i mutacje somatyczne, z których oba są silnie związane z pamięcią komórek B.
Odpowiedzi pamięciowe charakteryzują się szybką i rozległą produkcją Ig o wysokim powinowactwie do takich antygenów. Rozwój tych odpowiedzi pamięciowych jest krytyczny dla powodzenia szczepień. Jednakże mogą one również zwiększać autoimmunologię i reakcje alergiczne.
Aktywacja komórek T niezależnych od komórek B przez antygen może również mieć miejsce; jednak ten rodzaj aktywacji jest związany ze słabą pamięcią immunologiczną. Dodatkowo, antygeny te muszą być polimeryczne, aby aktywować komórki B.
NB: Cytokiny, lub interleukiny (ILs), są wydzielanymi cząsteczkami, które działają na transmembranowe receptory powierzchni komórki. Po związaniu, cytokiny te aktywują wewnątrzkomórkowe szlaki transdukcji sygnału, zwykle zależne od sygnalizacji Jak-STAT.
Interaktywna ścieżka sygnalizacji receptorów komórek B została szczegółowo omówiona tutaj.
CD19 (D4V4B) XP® Rabbit mAb #90176: analiza IHC ludzkiego raka płuca z użyciem #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC analysis of paraffin-embedded human lung carcinoma using #90176.
Komórki NK
Komórki NK (ang. natural killer, natural killer) są kolejnym typem komórek wywodzącym się z linii limfoidalnej. Podobnie jak komórki B, rozwijają się one w szpiku kostnym w sposób zależny od cytokin i komórek zrębu szpiku kostnego. Stanowią one niewielki odsetek krwi obwodowej i nie posiadają receptorów swoistych dla antygenów. Zamiast tego, komórki NK opierają się na złożonym zestawie receptorów transmembranowych. W szczególności, zawierają one hamujące receptory na powierzchni komórki, które rozpoznają cząsteczki HLA klasy I i są w ten sposób hamowane przez własne cząsteczki MHC, zabijając tylko te komórki, które mają obniżoną ekspresję HLA klasy I. Z tego powodu służą one do namierzania komórek zakażonych wirusem i komórek nowotworowych, których ekspresja HLA klasy I jest obniżona, aby uniknąć śmierci przez komórki T naturalnego zabójcy CD8+ (NK-T). Komórki NK mogą być również aktywowane w sposób zależny od przeciwciał, interferonu lub cytokin i dlatego mogą odgrywać dużą rolę w zwalczaniu nowotworów. Mechanizm działania komórek NK opiera się na uwalnianiu z ich cytoplazmy małych granulek zawierających granzymy i perforyny. Po ich uwolnieniu białka te mogą tworzyć pory i rozbijać białka wewnątrzkomórkowe w celu indukowania apoptozy. Jako takie, komórki NK są uważane za cytotoksyczne.
Komórki NK-T są specjalnym podtypem komórek T, które wyrażają pewne receptory i markery typowo wyrażane przez komórki NK w połączeniu z ograniczonym repertuarem receptorów komórek T. Dlatego ten unikalny podtyp posiada właściwości zarówno komórek T, jak i komórek NK. W przeciwieństwie do komórek NK, które rozwijają się w szpiku, komórki NK-T rozwijają się w grasicy.
Komórki mieloidalne
Wspólne mieloidalne komórki progenitorowe, które są potomkami hematopoetycznych komórek macierzystych, dają początek kilku różnym typom komórek mieloidalnych, w tym makrofagom, komórkom dendrytycznym i kilku innym komórkom odporności wrodzonej oraz komórkom krwi.
Makrofagi
Makrofagi mogą być pobudzane do rozpoznawania antygenów, takich jak uszkodzone komórki lub obcy materiał, w celu zniszczenia na żądanie. Makrofagi są obecne w większości tkanek i reagują w razie potrzeby na infekcje i umierające komórki. Rozpoznany materiał jest niszczony przez fagocytozę w makrofagach, co daje tym komórkom ich nazwę („wielki zjadacz” po grecku). Makrofagi przyjmują różne formy, gdy są obecne w różnych miejscach i mogą pełnić dodatkowe funkcje poza fagocytozą.
Po uszkodzeniu tkanki lub zakażeniu patogenem, monocyty we krwi będą rekrutowane do uszkodzonej tkanki i różnicują się, aby stworzyć makrofagi. W zależności od lokalizacji tkanki istnieją różne typy makrofagów, takie jak komórki Kupffera w wątrobie, makrofagi pęcherzykowe w płucach, mikroglej w mózgu itp. Wszystkie te różne typy makrofagów wywodzą się z monocytów, ale ich funkcje są dostosowane do tkanki, w której żyją. Większość ogólnej funkcji fagocytozy jest wykonywana przez makrofagi tkankowe. Oprócz fagocytowania martwych komórek i obcych materiałów, makrofagi mogą również wysyłać sygnały do innych komórek odpornościowych za pośrednictwem cytokin. Do pewnego stopnia makrofagi pełnią krytyczną funkcję prezentacji antygenów, odpowiednio współpracując z limfocytami T w celu wspierania odporności adaptacyjnej. Ponadto makrofagi mogą wydzielać cytokiny takie jak IL-12 i odgrywać rolę w lokalnych odpowiedziach immunologicznych, podczas gdy inne wydzielają duże ilości IL-10, która pośredniczy w ich roli w naprawie tkanek. Tak więc „wielcy zjadacze” odgrywają różne role w układzie odpornościowym oprócz głównego zadania, jakim jest fagocytoza.
CD68 (D4B9C) XP® Rabbit mAb #76437: Analiza IHC ludzkiego surowiczego raka brodawkowatego jajnika z użyciem #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: Analiza IHC zatopionego w parafinie ludzkiego surowiczego raka brodawkowatego jajnika przy użyciu #76437.
CD163 (D6U1J) Rabbit mAb #93498: Analiza IHC ludzkiego niedrobnokomórkowego raka płuca na podłożu parafinowym przy użyciu #93498 wykonana na aparacie Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: Analiza IHC ludzkiego niedrobnokomórkowego raka płuc przeprowadzona na podłożu parafinowym z użyciem #93498 na aparacie Leica® Bond™ Rx.
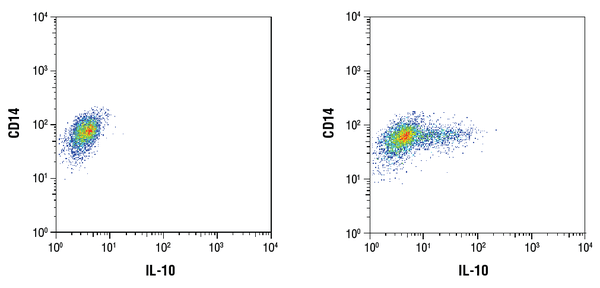
IL-10 (D13A11) XP® Rabbit mAb #12163: Analiza cytometryczna przepływu oczyszczonych CD14+ ludzkich komórek jednojądrzastych krwi obwodowej nie poddanych działaniu (po lewej) lub poddanych działaniu LPS (100ng/mL, 16 godz.; po prawej) przy użyciu przeciwciała CD14 i #12163. Brefeldyna A #9972 (300ng/mL) została dodana do komórek nieleczonych i leczonych po 1 godz. stymulacji LPS. Jako przeciwciała wtórnego użyto anty-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugate) #4414.
IL-10 (D13A11) XP® Rabbit mAb #12163: Analiza cytometryczna przepływu oczyszczonych CD14+ ludzkich komórek jednojądrzastych krwi obwodowej nie poddanych działaniu (po lewej) lub poddanych działaniu LPS (100ng/mL, 16 godz.; po prawej) przy użyciu przeciwciała CD14 i #12163. Brefeldyna A #9972 (300ng/mL) została dodana do komórek nieleczonych i leczonych po 1 godz. stymulacji LPS. Jako przeciwciała wtórnego użyto anty-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugate) #4414.
Komórki dendrytyczne
Podobne do makrofagów, komórki dendrytyczne mają zdolność pochłaniania materiału komórkowego i obcego, ale zamiast trawić go w celu usunięcia, komórki dendrytyczne przetwarzają materiał i przedstawiają go jako antygeny limfocytom T. Jako takie, komórki dendrytyczne służą jako komórki prezentujące antygen, lub komórki pomocnicze, i w ten sposób przekazują informacje o patogenach pomiędzy wrodzonym i adaptacyjnym układem odpornościowym. Komórki dendrytyczne otrzymały swoją nazwę od ich wyraźnych projekcji komórkowych, które sięgają na zewnątrz i chwytają szkodliwy materiał do strawienia.
Powstając z krwiotwórczych progenitorów szpiku kostnego, początkowo niedojrzałe komórki dendrytyczne przechodzą przez fazę „uczenia się”, w której pobierają próbki swojego lokalnego obszaru w poszukiwaniu obcego materiału i inicjują odpowiedź rozpoznawczą za pośrednictwem receptorów rozpoznawania wzorców (jednym wspólnym zestawem tych receptorów są receptory toll-podobne). Te niedojrzałe komórki dendrytyczne mogą rezydować w różnych miejscach z dostępem do środowiska zewnętrznego, takich jak wyściółka nosa, żołądka, płuc, a nawet w skórze. Po rozpoznaniu antygenu, komórki dendrytyczne migrują do węzła chłonnego, gdzie trenują limfocyty T do rozpoznawania antygenu i odpowiedniej odpowiedzi. Komórki dendrytyczne są jedynymi komórkami prezentującymi antygen, które aktywują zarówno limfocyty T pamięci, jak i naiwne. Receptory Toll-podobne to dobrze zbadana klasa receptorów obecnych na makrofagach i komórkach dendrytycznych, które pośredniczą w rozpoznawaniu i odpowiedzi na obce patogeny. Poza bezpośrednią interakcją z komórkami T, komórki dendrytyczne mogą również przekazywać sygnały za pośrednictwem cytokin, takich jak IL-12, która działa w celu przygotowania układu odpornościowego do późniejszego ataku na szkodliwy materiał. Inne typy komórek dendrytycznych mogą wydzielać cytokiny, które sygnalizują rekrutację większej liczby makrofagów w celu oczyszczenia organizmu z nadmiaru odpadów. Jako główne komórki pośredniczące w prezentacji antygenów, komórki dendrytyczne odgrywają niezbędną rolę w wymianie pomiędzy wrodzonym i adaptacyjnym układem odpornościowym.
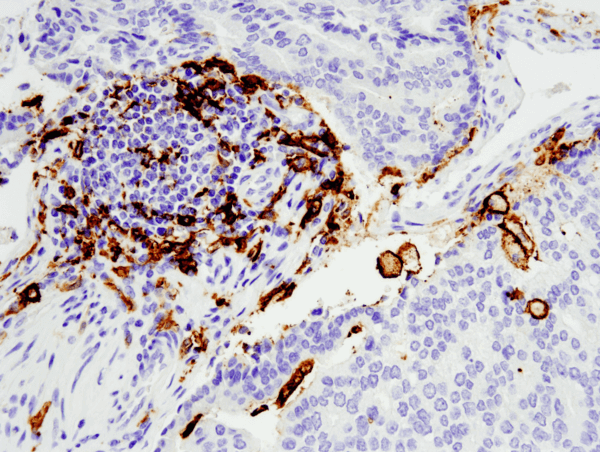
CD11c (D3V1E) XP® Rabbit mAb #45581: Analiza IHC zatopionego w parafinie ludzkiego gruczolakoraka prostaty z użyciem #455812 wykonana na aparacie Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: Analiza IHC zatopionego w parafinie ludzkiego gruczolakoraka prostaty z użyciem #455812 wykonana na aparacie Leica® Bond™ Rx.
Inne komórki wrodzonego układu odpornościowego i sygnalizacja
Inne komórki wrodzonego układu odpornościowego obejmują komórki tuczne, które funkcjonują w procesie gojenia się ran i pomagają zapewnić ochronę przed patogenami. Po pobudzeniu przez patogen komórki tuczne mogą wydzielać cytokiny, a także granulki zawierające histaminę i heparynę, które pośredniczą w dalszej odpowiedzi immunologicznej, takiej jak rekrutacja makrofagów i rozszerzenie naczyń krwionośnych. Neutrofile, eozynofile i bazofile określane są wspólnym mianem granulocytów ze względu na charakterystyczne ziarnistości w ich cytoplazmie. W neutrofilach, granulki działają w celu uwolnienia toksycznych związków, które zwalczają patogeny, takie jak grzyby i bakterie.
Immunologia w zdrowiu i chorobie
Immunologia nowotworów
Zaprzęganie komórek odpornościowych do walki z rakiem stało się bardzo gorącym tematem badań dzięki sukcesom w klinice. Ostatni nacisk w obecnej immunoterapii kładzie się na białka punktów kontrolnych sygnalizacji, takie jak PD-1, które normalnie zapobiegają aktywacji i odpowiedzi komórek T. Adoptywna terapia komórkowa jest kolejnym ekscytującym podejściem, które obejmuje immunoedytację komórek T pobranych od pacjenta. Komórki T są modyfikowane w taki sposób, aby wyrażały specyficzny chimeryczny receptor antygenowy, który jest specyficzny dla komórek nowotworowych pacjenta. Komórki T są następnie ponownie wszczepiane pacjentowi i są teraz zaprogramowane do wyszukiwania komórek nowotworowych i zabijania ich, zgodnie z normalną funkcją komórek T. Te i inne podejścia do manipulowania układem odpornościowym w celu zaatakowania szkodliwych komórek nowotworowych pacjenta stanowią przełomową klasę terapii w leczeniu raka.