Wprowadzenie
ß amyloid i fosforylowane białka tau są patologicznymi cechami choroby Alzheimera (AD), które gromadzą się i rozprzestrzeniają w sposób przewidywalny w rozproszonych sieciach neuronalnych, powodując postępujące nieprawidłowości metaboliczne, uszkodzenie neuronów i śmierć komórkową. Badania neuroobrazowe ułatwiają szczegółową ocenę tych zmian patologicznych u pacjentów poddawanych badaniom z powodu zaburzeń funkcji poznawczych. Dotychczas ostateczne rozpoznanie choroby Alzheimera było możliwe jedynie na podstawie obserwacji pośmiertnej i neuroanatomicznej oceny agregatów białkowych. Ostatnie postępy w obrazowaniu molekularnym pozwalają jednak na wizualizację złogów amyloidu i tau w żywym ludzkim mózgu i przybliżyły nas do ostatecznego rozpoznania AD in vivo.
Obrazowanie strukturalne
Wytyczne Amerykańskiej Akademii Neurologii (AAN) dotyczące diagnostyki osób z zaburzeniami funkcji poznawczych1 zalecają strukturalne obrazowanie mózgu za pomocą niekontrastowej tomografii komputerowej lub rezonansu magnetycznego u każdej osoby z pozytywnym wywiadem klinicznym i obiektywnymi zmianami poznawczymi. W tym kontekście podstawową rolą obrazowania mózgu jest wykluczenie zmian strukturalnych o charakterze niezwyrodnieniowym, z których 5% może nie wynikać z wywiadu klinicznego lub badania przedmiotowego2 i które są potencjalnie uleczalne. AAN zaleca również kliniczne wykluczenie otępienia naczyniopochodnego (vascular dementia, VaD), otępienia z ciałami Lewy’ego (dementia with Lewy bodies, DLB) i otępienia czołowo-skroniowego (frontotemporal dementia, FTD). Obrazowanie strukturalne może poprawić pewność diagnostyczną i zmienić rozpoznanie kliniczne w 19% do 28%, a także postępowanie w 15% przypadków klinicznych.2
Metodami obrazowania z wyboru przy ocenie zaników strukturalnych są tomografia komputerowa i rezonans magnetyczny. Przy użyciu tych metod dokładnie opisano i zweryfikowano specyficzne dla danej choroby wzorce zaników. Chociaż zanik jest możliwy do zaobserwowania w tomografii komputerowej, z natury niższa rozdzielczość przestrzenna i gorszy kontrast istoty szarej i białej powodują utratę potencjalnie użytecznych, subtelnych obserwacji dotyczących zmian neurodegeneracyjnych. Dlatego klinicyści często polegają na MRI w celu oceny wzorca i nasilenia zmian strukturalnych, wykluczenia nieneurodegeneracyjnych przyczyn pogorszenia funkcji poznawczych oraz oceny nasilenia i rozległości zmian w istocie białej, co szczegółowo omówiono poniżej.
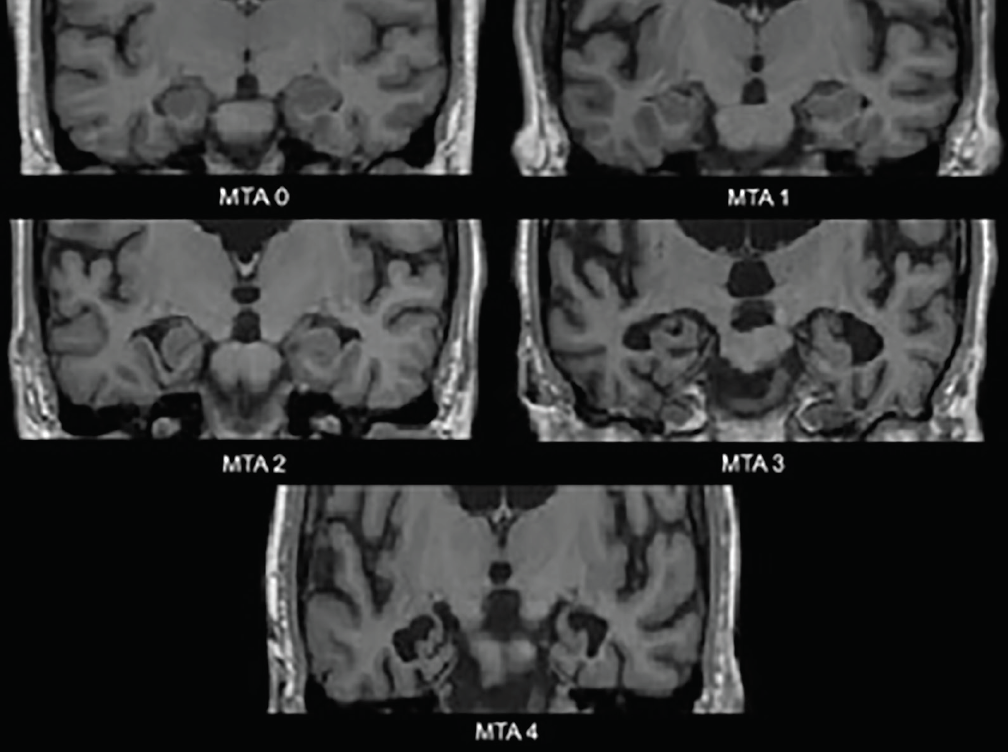
Najwcześniejsze zmiany neurodegeneracyjne w AD występują w przyśrodkowych płatach skroniowych – hipokampie, korze zakrętu obręczy i zakręcie przyhipokampowym. W miarę postępującej atrofii szczelina naczyniówki i róg skroniowy komory bocznej ulegają poszerzeniu; zmiany te najlepiej ocenia się w płaszczyźnie koronowej. Powszechnie stosowana skala oceny wizualnej oparta na tych strukturach – skala atrofii przyśrodkowej części skroniowej (medial temporal atrophy, MTA) (ryc. 1) – została potwierdzona klinicznie3 i neuropatologicznie4. Różne badania z zastosowaniem tej skali lub ocenianych w niej struktur wykazały znaczącą zdolność do odróżniania osób z chorobą Alzheimera od osób z grupy kontrolnej dobranej pod względem wieku4 lub osób z DLB4 lub naczyniowymi zaburzeniami poznawczymi (VCI).5 Przyśrodkowy zanik skroniowy jest również predyktorem przejścia z amnestycznych łagodnych zaburzeń poznawczych (MCI) do otępienia typu alzheimerowskiego.3
Click to view larger
Figura 1. Oceny w skali MTA (Medial temporal atrophy). MTA 0 – brak lub minimalne przerwanie szczeliny naczyniówkowej; MTA 1 – nieznaczne poszerzenie szczeliny naczyniówkowej; MTA 2 – dalsze poszerzenie szczeliny naczyniówkowej, która łączy się z rogiem skroniowym komory bocznej, łagodne obniżenie wysokości formacji hipokampa; MTA 3 – umiarkowane obniżenie wysokości formacji hipokampa, wyraźne powiększenie rogu skroniowego komory bocznej; MTA 4 – poważne obniżenie wysokości formacji hipokampa, wyraźne powiększenie rogu skroniowego komory bocznej.
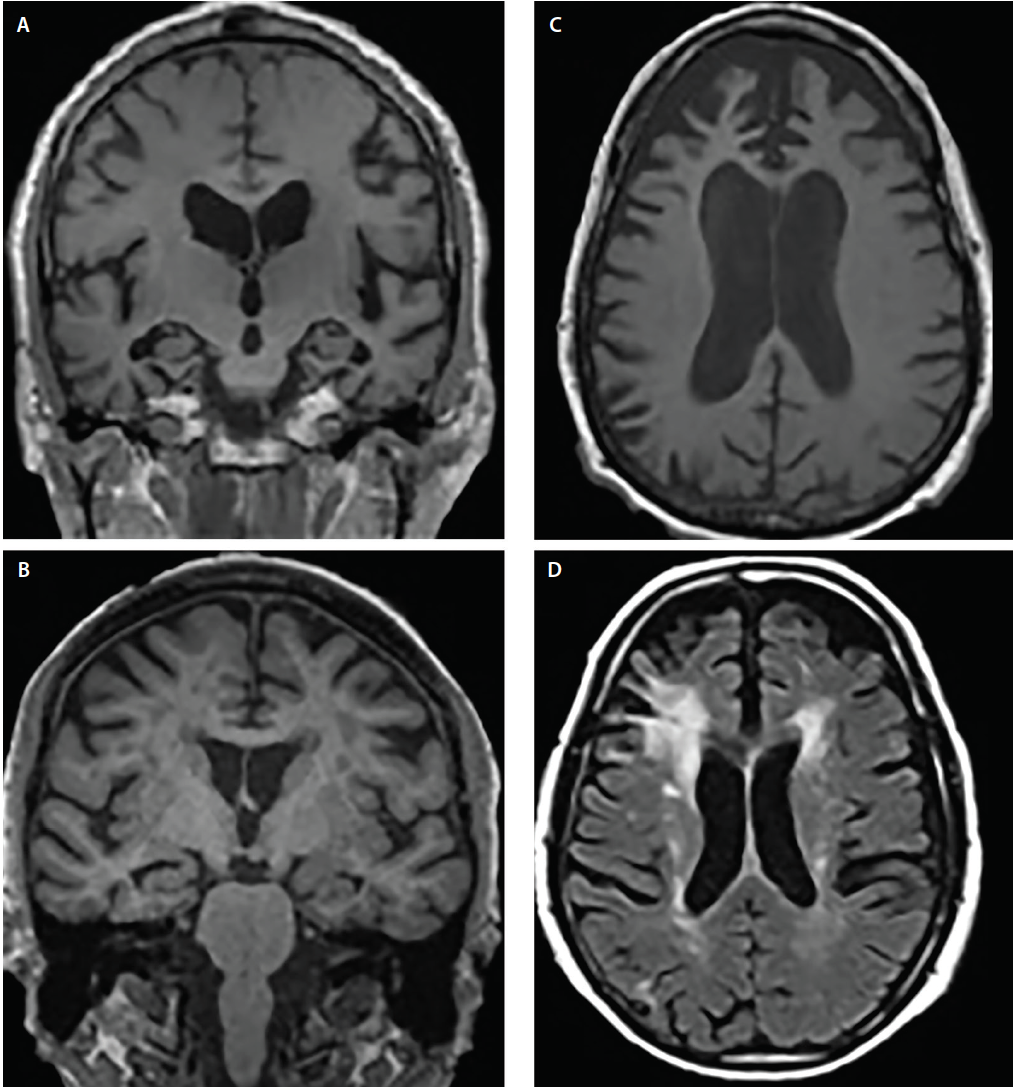
Zespoły otępienne zwykle wykazują kanoniczne wzorce atrofii6 , które odpowiadają objawom poznawczym i behawioralnym; jednak struktury, których dotyczą, mogą się nakładać. Na przykład, zarówno AD, jak i DLB wykazują zajęcie przyśrodkowego płata skroniowego, ale kilka badań obrazowych i neuropatologicznych wykazało, że w porównaniu z AD, DLB wykazuje znacznie mniejszą predylekcję do przyśrodkowych struktur skroniowych4,5 (ryc. 2).
Kliknij, aby powiększyć
Rysunek 2. Wzorce zaniku strukturalnego w chorobie Alzheimera (AD) (A), otępieniu z ciałami Lewy’ego (DLB) (B), otępieniu czołowo-skroniowym (FTD) (C) i otępieniu naczyniopochodnym (VaD) (D). Koronalny T1-ważony MRI wykazuje uogólniony zanik korowy, ale różne stopnie zaniku hipokampa w AD (A) i DLB (B). Osiowy T1-ważony MRI wykazuje atrofię w bvFTD z ogniskową predylekcją do przyśrodkowej i bocznej kory przedczołowej (C). Osiowy T2-zależny MRI wykazuje konfluentną periventryczną czapeczkę i halo hipointensywności istoty białej (WMHs) obejmujące corona radiata i rozciągające się na boczną neokorę przedczołową, łagodne rozproszone WMHs oraz WMHs podzależnej wyściółki komór i przegrody międzykomorowej w VaD (D).
Ważne jest, aby systematycznie oceniać wszystkie obszary mózgu, zwracając uwagę na regiony zarówno zaniku strukturalnego, jak i anatomicznego, aby jak najlepiej wykorzystać diagnostykę obrazową. W dużym, wieloośrodkowym badaniu oceniano ostatnio zdolność 6 skal wizualnej oceny do prawidłowej klasyfikacji 186 potwierdzonych patologicznie przypadków AD, DLB i FTLD.6 Badanie to wykazało, że jednoczesna ocena wielu regionów charakterystycznych dla danej choroby zapewniała znacznie lepszą dyskryminację niż koncentrowanie się na pojedynczym obszarze.4
Uszkodzenia naczyniowe są ważnym czynnikiem podczas oceny osób z zaburzeniami funkcji poznawczych. Zmiany niedokrwienne są powszechne w normalnym starzeniu się i są przyspieszone przez wspólne choroby współistniejące (np. nadciśnienie, cukrzyca i hipercholesterolemia). O naczyniowym wpływie zaburzeń poznawczych często wnioskuje się, gdy w sekwencjach T2-ważonych lub sekwencjach FLAIR (fluid attenuated inversion recovery) wykryte zostaną znaczne hiperintensywności istoty białej (WMH), udary korowe lub strategicznie zlokalizowane lakunarne obszary. Wylewy lakunarne w zwojach podstawy oraz WMH w centrum półksiężyca i koronie promienistej są wskaźnikami przewlekłego uszkodzenia niedokrwiennego małych naczyń (ryc. 2). W przeciwieństwie do tego, czapeczki okołokomorowe są często pochodzenia niedokrwiennego i odzwierciedlają glejozę subzależną.7 Istnieje kilka skal nasilenia WMH (np. skala Fazekasa)7 , które mogą być stosowane w warunkach klinicznych. Wszystkie te algorytmy punktacji zgadzają się, że rozległe, konfluentne WMH i podkorowe zawały lakunarne są, przynajmniej częściowo, prawdopodobnymi czynnikami przyczyniającymi się do pogorszenia zdolności poznawczych.7
Obrazowanie tensora dyfuzji (DTI) jest nową sekwencją MRI wrażliwą na dyfuzję wody przez tkankę, która ocenia integralność istoty białej, ponieważ architektura aksonów ogranicza przepływ wody. Średnia dyfuzyjność i miary anizotropii frakcyjnej są często używane do charakteryzowania zmian neurodegeneracyjnych w DTI. Pierwsza z nich mierzy wielkość dyfuzji, a druga – czy woda płynie preferencyjnie w jednym kierunku, jak to jest oczekiwane w zdrowych aksonach. Zmniejszoną średnią dyfuzyjność i zmniejszoną anizotropię frakcyjną konsekwentnie odnotowywano zarówno w populacji MCI, jak i demencji AD.8 W kilku badaniach zidentyfikowano również zmiany DTI u bezobjawowych osób zagrożonych rozwojem AD9 , wskazując, że zmiany te występują we wczesnym okresie choroby. Oprócz oceny integralności istoty białej, DTI może być wykorzystywana do modelowania strukturalnych połączeń między regionami korowymi za pomocą algorytmów traktografii. Zyskało to uznanie w dziedzinie choroby Alzheimera, ponieważ dowody sugerują, że patologia amyloidu i tau może rozprzestrzeniać się za pośrednictwem połączeń mózgowych.10 Chociaż DTI wykazuje potencjał jako miara integralności istoty białej, jej wrażliwość na ruch i inne ograniczenia techniczne ograniczają, przynajmniej na razie, jej zastosowanie kliniczne.
Obrazowanie czynnościowe
Hipometabolizm mózgu jest łatwo obserwowany w zaburzeniach neurodegeneracyjnych i może pomóc w diagnostyce różnicowej. Funkcja neuronów jest zależna od tlenu i glukozy z krwi, których dostarczanie jest ułatwione przez regionalne rozszerzenie naczyń. Pozytonowa tomografia emisyjna 18F-fluorodeoksyglukozy (FDG-PET) pośrednio odzwierciedla stopień aktywności korowej i może być z łatwością wykorzystana do wizualizacji zmian neurodegeneracyjnych poprzez wykorzystanie tej metabolicznej zależności od glukozy.
Charakterystyczna hipometaboliczna sygnatura korowa AD składa się z wczesnych zmian w tylnym zakręcie obręczy (PCC); precuneus; kory skroniowej, ciemieniowej i, w późniejszych stadiach, czołowej. Wzorzec ten ujawnia się wcześnie, nawet przedobjawowo,11 i jest klinicznie pomocny w odróżnianiu AD od FTD.12 W przeciwieństwie do AD, sygnatura metaboliczna FTD ujawnia hipometabolizm czołowy, przedni skroniowy, zwojów podstawy i wzgórza, przy względnym braku zmian w tylnych korach asocjacyjnych.13 W sytuacjach klinicznie niepewnych klinicyści mogą wykorzystać tę sygnaturę metaboliczną do odróżnienia AD od FTD.12 Podobnie, chociaż neokorowa sygnatura metaboliczna DLB może nakładać się na sygnaturę AD, przypadki DLB mogą również wykazywać hipometabolizm potyliczny.14
Center for Medicare & Medicaid Services uznaje FDG-PET za „uzasadnione i konieczne” tylko u osób spełniających kryteria zarówno AD, jak i FTD, u których pełna diagnostyka zgodnie z wytycznymi AAN1 nie pozwoliła na ostateczne ustalenie etiologii.15
Funkcjonalny rezonans magnetyczny (fMRI) może również mierzyć aktywność mózgu dzięki zastosowaniu sekwencji, które są wrażliwe na czasowe zmiany w utlenowanej/odtlenowanej hemoglobinie spowodowane aktywnością mózgu. W ten sposób, fMRI jest powiązany z FDG-PET, ponieważ zmiany w hemoglobinie są napędzane przez metabolizm glukozy wymagany dla aktywności mózgu. Zależności czasowe pomiędzy regionami mogą być wykorzystane do wnioskowania o funkcjonalnej łączności (tzn. które regiony aktywnie się komunikują). W porównaniu z FDG-PET, fMRI oferuje lepszą rozdzielczość przestrzenną, co pozwala na dokładniejsze mapowanie połączeń. Kolejną zaletą fMRI jest to, że może być przeprowadzony podczas wykonywania zadania lub w spoczynku. W pierwszym przypadku identyfikuje się wzorce połączeń wynikające z określonych stanów aktywnych, natomiast w drugim – wzorce połączeń obecne w stanie spoczynku, znane jako sieć trybu domyślnego (DMN). DMN jest definiowana przez węzły funkcjonalne, PCC i przedklinek, które łączą się z podsystemem grzbietowo-przyśrodkowym i podsystemem przyśrodkowo-skroniowym.16 Uważa się, że odkładanie amyloidu rozpoczyna się w węzłach funkcjonalnych DMN. Wiadomo, że DMN jest zaburzona w AD.16 Z kolei w FTD DMN jest oszczędzana, podczas gdy zaburzone są sieci wrażliwości lub uwagi.17 Obecnie technologia fMRI jest ograniczona do zastosowań badawczych, ale aktywnie poszukuje się możliwości opracowania odpowiednich algorytmów mających zastosowanie kliniczne.
Obrazowanie molekularne
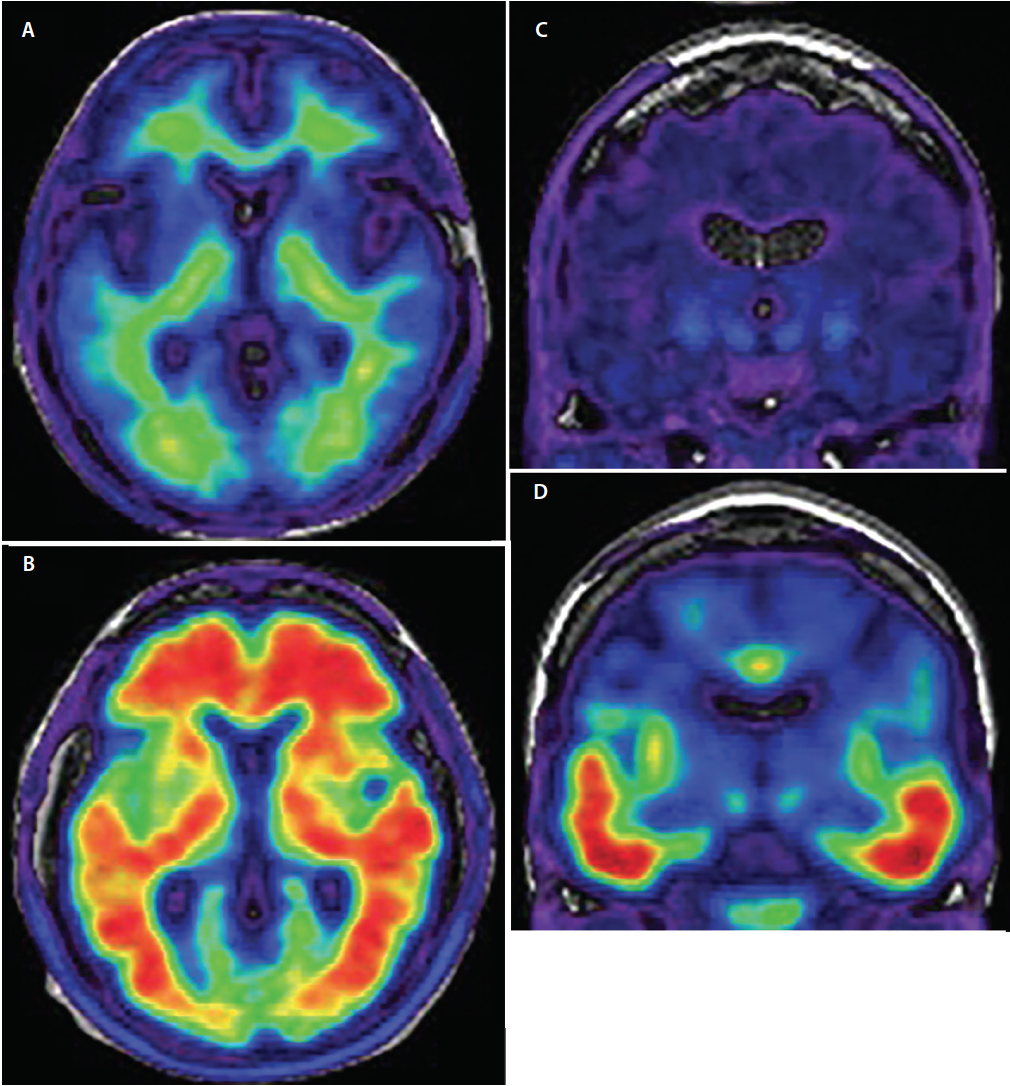
Standardem kryterium ostatecznego rozpoznania AD jest pośmiertne neuropatologiczne badanie mózgu. Nawet w rękach doświadczonych ekspertów w dziedzinie demencji, kliniczne rozpoznanie choroby Alzheimera osiąga jedynie niepokojącą czułość od 70,9% do 87,3% i swoistość od 44,3% do 70,8%.18 Największe znaczenie dla poprawy dokładności diagnostyki klinicznej choroby Alzheimera ma opracowanie znaczników obrazowania PET ze specyficznym powinowactwem do związanych z chorobą Alzheimera agregatów ß amyloidu i fosforylowanego tau (ryc. 3), które pozwalają na wykazanie in vivo neuropatologii leżącej u podstaw choroby (tabela), co kiedyś było możliwe tylko pośmiertnie.
Kliknij, aby powiększyć
Rysunek 3. Osiowe badanie amyloid-PET przedstawiające skany amyloidu ujemne (A) i amyloidu dodatnie (B). W obrazach amyloidu ujemnych (A) sygnał radiotraktera wykazuje niską intensywność i jest ograniczony do niespecyficznego wiązania z istotą białą. Połączenie istoty szarej z białą jest zachowane. W obrazach dodatnich amyloidu (B) sygnał radiotraktera ma wysoką intensywność i rozciąga się dyfuzyjnie na obszary istoty szarej kory, przesłaniając połączenie istoty szarej i białej. Koronalna tau-PET demonstrująca skany tau ujemne (C) i tau dodatnie (D). W skanach tau ujemnych widoczny jest minimalny, niespecyficzny sygnał radiotraktera o niskiej intensywności w przyśrodkowych obszarach skroniowych, przodomózgowiu podstawnym i zwojach podstawy. W skanach tau-dodatnich (D) sygnał radioizotopowy ma większą intensywność i obejmuje dolną i boczną część kory skroniowej, zgodnie ze znaną trajektorią progresji splątków neurofibrylarnych.
Pozytonowa emisyjna tomografia amyloidu
Obrazowanie amyloidu, a ostatnio także tau, zrewolucjonizowało naszą zdolność do obrazowania patologii choroby Alzheimera nawet w stadiach przedobjawowych.19 Znaczniki obrazowania PET amyloidu są ważne i wiarygodne do wykrywania patologii choroby Alzheimera in vivo w różnych stadiach choroby. Te znaczniki wiążą się ze specyficznymi motywami konformacyjnymi białka amyloidowego i powodują wychwyt znacznika, który jest ściśle skorelowany z pośmiertnym odkładaniem się amyloidu.20
W porównaniu z tau, patologia amyloidowa rozpoczyna się w bardziej rozproszonym regionalnym wzorcu, rozprzestrzeniając się od podstawnych części płatów czołowych, skroniowych i potylicznych do grzbietowych neokorowych obszarów asocjacyjnych, przy czym dopiero w późnym stadium choroby dochodzi do zajęcia pierwotnych kor czuciowych i ruchowych.21 Najbardziej godne uwagi obszary wychwytu znacznika to kora czołowa, ciemieniowa i boczna kora skroniowa (ryc. 3), przy czym wychwyt jest 1,5 do 2 razy większy u osób z AD w porównaniu z grupami kontrolnymi22 lub osobami z innymi demencjami.23
Obrazy PET z amyloidem są oceniane pod kątem wychwytu znacznika w korze w charakterystycznych obszarach rozmieszczenia amyloidu w AD. Pozytywne skany wykazują utratę rozróżnienia istoty szarej i białej, ponieważ wychwyt znacznika rozszerza się na neocortex. Skany negatywne zachowują rozróżnienie istoty szarej i białej, wykazując jedynie wiązanie poza celem w istocie białej.24 Wzorce obrazowania PET amyloidu mogą wiarygodnie przewidywać pogorszenie funkcji poznawczych zarówno u osób zdrowych, jak i z MCI.20
Niepewna relacja między kosztami, ryzykiem i korzyściami doprowadziła do opracowania kryteriów odpowiedniego stosowania obrazowania amyloidu, przypisujących potrzebę oceny PET z amyloidem osobom z niewyjaśnionym MCI, nietypowym obrazem AD i wczesnym początkiem demencji.26 Eksperci zidentyfikowali również niewłaściwe wskazania do obrazowania amyloidu, które obejmują samodzielną ocenę obaw dotyczących funkcji poznawczych przed przeprowadzeniem dokładnych badań klinicznych, poznawczych, laboratoryjnych i neuroobrazowania strukturalnego; przy braku obiektywnych zaburzeń funkcji poznawczych; przy wysokim prawdopodobieństwie AD (tj. przy braku ekwipotencjalności klinicznej); oraz w celu oceny stopnia zaawansowania demencji.
Tau Pozytonowa tomografia emisyjna
Tau jest drugim białkiem, które odkłada się w mózgach osób z AD. Znaczniki obrazowania PET Tau są obecnie w fazie rozwoju i już teraz wykazują obiecujące właściwości. Podobnie jak amyloid PET, znaczniki tau PET celują w określone motywy konformacyjne fosforylowanego tau. Swoistość znaczników tau została potwierdzona pośmiertnie,28 a obserwowany sygnał tau PET ściśle odpowiada anatomicznemu rozmieszczeniu splątków neurofibrylarnych, obecnie wykorzystywanemu do neuropatologicznej diagnostyki AD.29 Najwcześniejsze etapy patologii tau, które można uwidocznić za pomocą obrazowania tau PET, to złogi splątków neurofibrylarnych w korze entorhinalnej i hipokampie. Następnie złogi tau stają się wykrywalne w dolnej i bocznej części kory skroniowej (ryc. 3), potem w ciemieniowej i potylicznej, a w końcu w czołowej, zgodnie z dobrze ugruntowaną patologiczną klasyfikacją Braaka i Braaka odkładania się tau w mózgu.21 Znaczniki tau nie są pozbawione ograniczeń diagnostycznych i są w trakcie dalszego rozwoju w celu lepszego określenia ich roli klinicznej. Jednak biorąc pod uwagę, że wiązanie znacznika tau dynamicznie zmienia się w całym przebiegu klinicznym choroby Alzheimera, ta metoda obrazowania prawdopodobnie odegra znaczącą rolę w ocenie stopnia zaawansowania choroby in vivo.30
Przyszłe kierunki
Zważywszy, że patologię choroby Alzheimera można łatwo wykryć do 20 lat przed rozpoznaniem otępienia19 i ma ona przewidywalny rozkład etapowy, badania koncentrują się obecnie na wczesnym wykrywaniu przedobjawowym i poprawie dokładności diagnostycznej poprzez wykorzystanie biomarkerów (Tabela).31 Proponowane ramy badawcze amyloidu-tau-neurodegeneracji (ATN) koncentrujące się na wykrywaniu 3 zmian biomarkerów w mózgu prognozują znaczenie kliniczne obrazowania multimodalnego.31 System klasyfikacji ATN jest niezależny od zespołów klinicznych i ujmuje pełne spektrum chorób neurodegeneracyjnych przez pryzmat biomarkerów AD. Po dalszym rozwoju i udoskonaleniu ATN, dzięki obiektywnej kategoryzacji biomarkerów in vivo, oczekuje się radykalnej poprawy dokładności diagnostyki klinicznej i podniesienia jakości opieki.
Wniosek
Neuroobrazowanie oferuje unikalne informacje o etiologii leżącej u podstaw zaburzeń funkcji poznawczych i ułatwia pacjentom i ich rodzinom przejście przez pełne obaw i niepewności doświadczenie. Wszystkie choroby neurodegeneracyjne wykazują znaczną heterogenność kliniczną, a przed najnowszymi osiągnięciami obrazowania molekularnego żadna z nich nie mogła być ostatecznie zdiagnozowana przed śmiercią. Nowoczesna technologia obrazowania mózgu jest w stanie wykryć wiele epifenomenów odzwierciedlających podstawową neuropatologię, z których część znajduje się dość blisko źródła choroby. Najpewniejsze rozpoznanie kliniczne opiera się obecnie na integracji wywiadu klinicznego, obserwacji lekarskich, badania fizykalnego, badań lekarskich, testów neuropsychologicznych i świadomej interpretacji diagnostycznych badań neuroobrazowych. W miarę dalszego udoskonalania biomarkerów ATN, diagnozy kliniczne będą stawiane wcześniej i bardziej definitywnie u żyjących pacjentów, w mniejszym stopniu będą opierać się na klasyfikacji objawów i zapewnią możliwości wcześniejszej interwencji terapeutycznej, która może zmienić trajektorię choroby neurodegeneracyjnej.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporal lobe atrophy on MRI differentiates Alzheimer’s disease from dementia with Lewy bodies and vascular cognitive impairment: a prospective study with pathological verification of diagnosis. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion tensor imaging of normal-appearing white matter in mild cognitive impairment and early Alzheimer disease: preliminary evidence of axonal degeneration in the temporal lobe. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET improves accuracy in distinguishing frontotemporal dementia and Alzheimer’s disease. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebral glucose metabolism in patients with frontotemporal dementia. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardized 18F-FDG PET diagnosis of mild cognitive impairment, Alzheimer’s disease, and other dementias. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Dostęp 4 maja 2019 r.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerative diseases target large-scale human brain networks. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. The diagnostic value of FDG and amyloid PET in Alzheimer’s disease-a systematic review. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Dokładność predykcyjna obrazowania amyloidu dla progresji z łagodnych zaburzeń poznawczych do choroby Alzheimera przy różnej długości obserwacji: metaanaliza. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiography validation of novel tau PET tracer -MK-6240 on human postmortem brain tissue. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Early clinical PET imaging results with the novel PHF-tau radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluation of tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr, Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535-562.
MRA i DS zgłaszają brak ujawnień.
LGA służyła jako członek rady doradczej dla Eli Lilly.