Learning Objectives
- Relate the electron configurations of the elements to the shape of the periodic table.
- Określić oczekiwaną konfigurację elektronową pierwiastka na podstawie jego miejsca w układzie okresowym.
W rozdziale 3 „Atomy, cząsteczki i jony” wprowadziliśmy układ okresowy jako narzędzie do porządkowania znanych pierwiastków chemicznych. Układ okresowy jest pokazany na rysunku 8.11 „Układ okresowy”. Pierwiastki są wymienione według liczby atomowej (liczba protonów w jądrze), a pierwiastki o podobnych właściwościach chemicznych są zgrupowane razem w kolumnach.
Rysunek 8.11 Układ okresowy
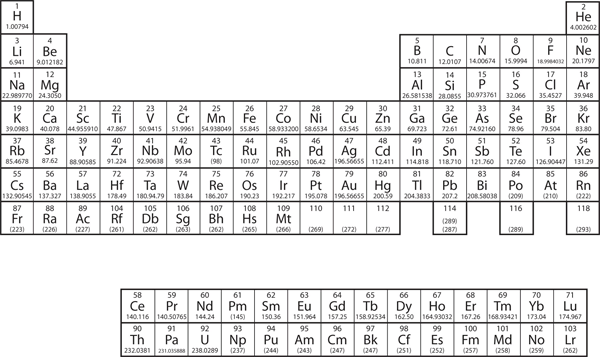
Dlaczego układ okresowy ma taką strukturę, jaką ma? Odpowiedź jest dość prosta, jeśli rozumie się konfiguracje elektronowe: kształt układu okresowego naśladuje wypełnianie podpowłok elektronami.
Zacznijmy od H i He. Ich konfiguracje elektronowe są 1s1 i 1s2, odpowiednio; z He, n = 1 powłoki jest wypełniony. Te dwa pierwiastki tworzą pierwszy rząd układu okresowego (patrz rysunek 8.12 „The 1”).
Rysunek 8.12 Powłoka 1s
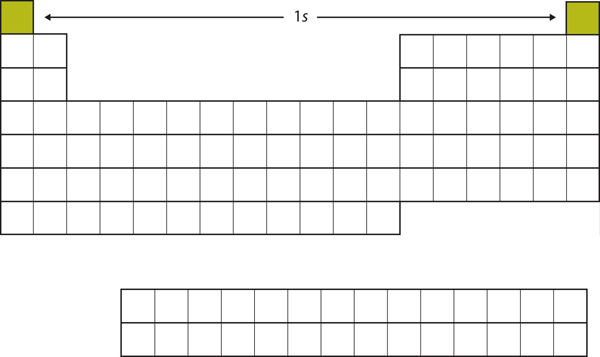
H i He reprezentują wypełnienie podpowłoki 1s.
Kolejne dwa elektrony, dla Li i Be, przeszłyby do podpowłoki 2s. Rysunek 8.13 „The 2” pokazuje, że te dwa pierwiastki sąsiadują ze sobą na układzie okresowym.
Rysunek 8.13 Powłoka 2s
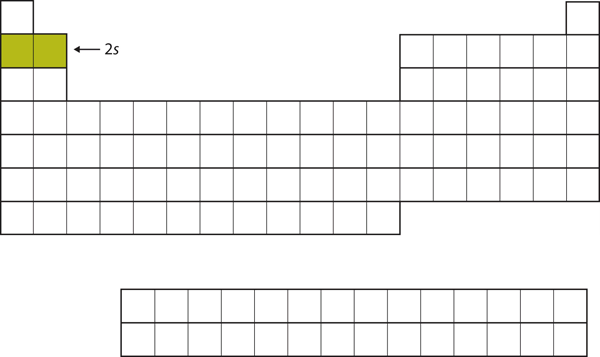
W Li i Be zapełniana jest podpowłoka 2s.
Dla następnych sześciu pierwiastków zajmowana jest elektronami podpowłoka 2p. Po prawej stronie układu okresowego te sześć pierwiastków (od B do Ne) jest zgrupowanych razem (rysunek 8.14 „The 2”).
Rysunek 8.14 Powłoka 2p
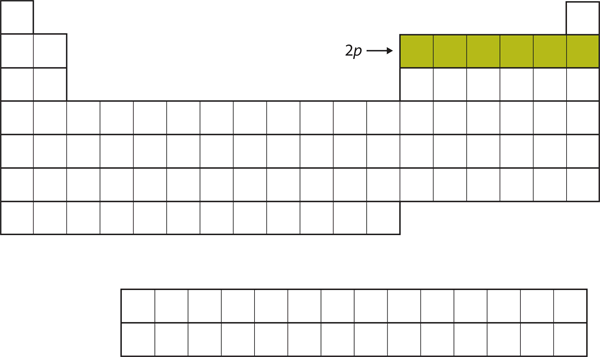
Dla pierwiastków od B do Ne zajęta jest podpowłoka 2p.
Kolejną podpowłoką, która jest zapełniana jest podpowłoka 3s. Pierwiastki, w których ta podpowłoka jest wypełniana, Na i Mg, znajdują się z powrotem po lewej stronie układu okresowego (Rysunek 8.15 „The 3”).
Rysunek 8.15 Podpowłoka 3s
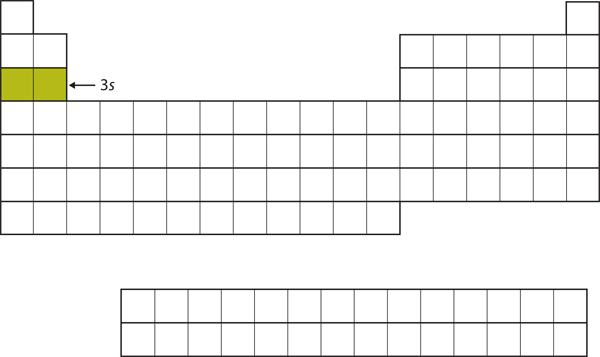
Teraz podpowłoka 3s jest zajęta.
Następnie, podpowłoka 3p jest wypełniana kolejnymi sześcioma pierwiastkami (Rysunek 8.16 „The 3”).
Rysunek 8.16 Podpowłoka 3p
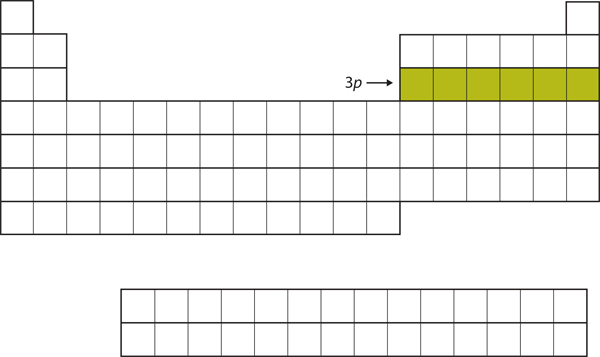
Następnie, podpowłoka 3p zostaje wypełniona elektronami.
Zamiast zapełnić w następnej kolejności podpowłokę 3d, elektrony przechodzą do podpowłoki 4s (Rysunek 8.17 „The 4”).
Rysunek 8.17 Podpowłoka 4s
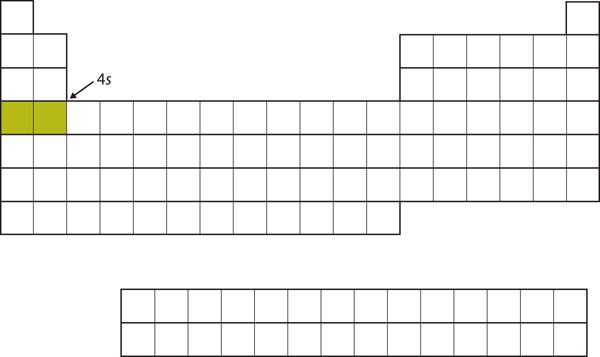
Powłoka 4s jest wypełniana przed podpowłoką 3d. Znajduje to odzwierciedlenie w strukturze układu okresowego.
Po zapełnieniu podpowłoki 4s, podpowłoka 3d jest zapełniana maksymalnie 10 elektronami. Wyjaśnia to sekcję 10 pierwiastków w środkowej części układu okresowego (Rysunek 8.18 „The 3”).
Rysunek 8.18 Podpowłoka 3d
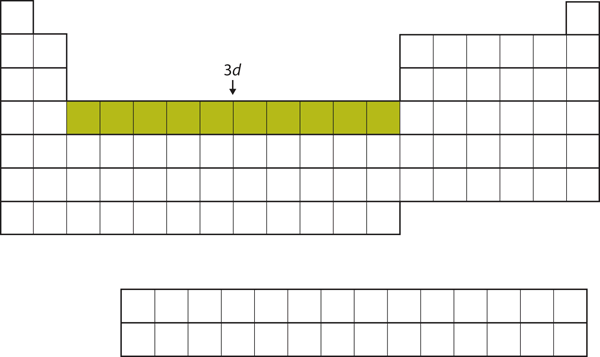
Powłoka 3d jest wypełniona w środkowej części układu okresowego.
I tak dalej. Jak idziemy przez wiersze układu okresowego, ogólny kształt tabeli nakreśla, jak elektrony są zajęte powłok i podpowłoki.
Pierwsze dwie kolumny po lewej stronie układu okresowego są gdzie podpowłoki s są zajęte. Z tego powodu, dwa pierwsze wiersze układu okresowego są oznaczone jako s blok. Podobnie, blok p to sześć najbardziej wysuniętych na prawo kolumn układu okresowego, blok d to środkowe 10 kolumn układu okresowego, natomiast blok f to 14-kolumnowa sekcja, która zwykle przedstawiana jest jako oderwana od głównego korpusu układu okresowego. Mógłby on być częścią głównego korpusu, ale wtedy układ okresowy byłby dość długi i nieporęczny. Rysunek 8.19 „Bloki w układzie okresowym” przedstawia bloki układu okresowego.
Rysunek 8.19 Bloki w układzie okresowym
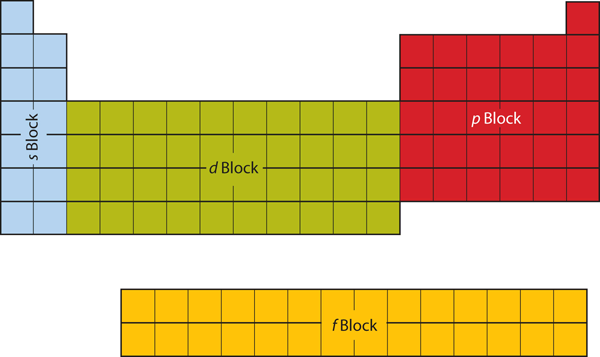
Układ okresowy jest podzielony na bloki w zależności od tego, która podpowłoka jest wypełniana dla atomów należących do tej sekcji.
Elektrony w najwyżej numerowanej powłoce, plus jakiekolwiek elektrony w ostatniej niewypełnionej podpowłoce, nazywane są elektronami walencyjnymi; najwyżej numerowana powłoka nazywana jest powłoką walencyjną. (Wewnętrzne elektrony nazywane są elektronami rdzenia.) Elektrony walencyjne w dużym stopniu kontrolują chemię atomu. Jeżeli spojrzymy tylko na konfigurację elektronową powłoki walencyjnej, zauważymy, że w każdej kolumnie konfiguracja elektronowa powłoki walencyjnej jest taka sama. Dla przykładu, weźmy pierwiastki z pierwszej kolumny układu okresowego: H, Li, Na, K, Rb i Cs. Ich konfiguracje elektronowe (skróty dla większych atomów) są następujące, z zaznaczoną konfiguracją elektronową powłoki walencyjnej:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Wszystkie one mają podobną konfigurację elektronów w swoich powłokach walencyjnych: pojedynczy elektron s. Ponieważ duża część chemii danego pierwiastka zależy od elektronów walencyjnych, można by się spodziewać, że te pierwiastki będą miały podobną chemię – i mają. Organizacja elektronów w atomach wyjaśnia nie tylko kształt układu okresowego, ale także fakt, że pierwiastki w tej samej kolumnie układu okresowego mają podobną chemię.
Ta sama koncepcja odnosi się do innych kolumn układu okresowego. Elementy w każdej kolumnie mają te same konfiguracje elektronowe powłoki walencyjnej, a elementy mają pewne podobne właściwości chemiczne. To jest ściśle prawdziwe dla wszystkich elementów w s i p bloków. W blokach d i f, ponieważ istnieją wyjątki od kolejności zapełniania podpowłok elektronami, podobne powłoki walencyjne nie są bezwzględne w tych blokach. Jednak wiele podobieństw istnieje w tych blokach, więc oczekuje się podobieństwa we właściwościach chemicznych.
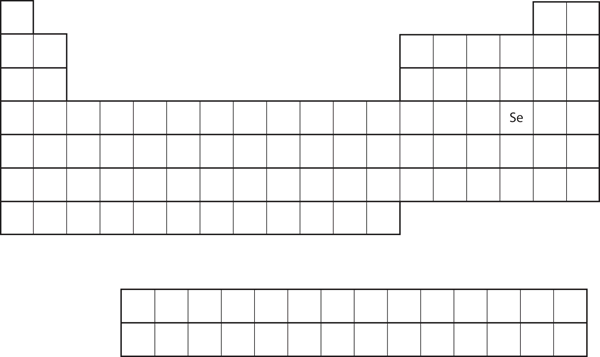
Podobieństwo konfiguracji elektronowej powłoki walencyjnej implikuje, że możemy określić konfigurację elektronową atomu wyłącznie na podstawie jego pozycji w układzie okresowym. Rozważmy Se, jak pokazano na rysunku 8.20 „Selen na układzie okresowym”. Znajduje się on w czwartej kolumnie bloku p. Oznacza to, że jego konfiguracja elektronowa powinna kończyć się konfiguracją elektronową p4. Rzeczywiście, konfiguracja elektronowa Se wynosi 4s23d104p4, zgodnie z oczekiwaniami.
Rysunek 8.20 Selen na układzie okresowym
Przykład 8
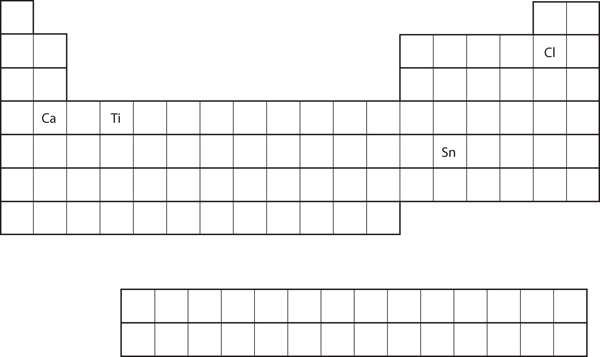
W oparciu o położenie pierwiastka na układzie okresowym, przewidz konfigurację elektronową powłoki walencyjnej dla każdego atomu. Patrz Rysunek 8.21 „Różne pierwiastki na układzie okresowym”.
- Ca
- Sn
Rozwiązanie
- Ca znajduje się w drugiej kolumnie bloku s. Spodziewalibyśmy się, że jego konfiguracja elektronowa powinna kończyć się na s2. Konfiguracja elektronowa wapnia to 4s2.
- Sn znajduje się w drugiej kolumnie bloku p, więc spodziewamy się, że jego konfiguracja elektronowa zakończy się na p2. Konfiguracja elektronowa cyny to 5s24d105p2.
Test Yourself
W oparciu o położenie pierwiastka na układzie okresowym, przewidz konfigurację elektronową powłoki walencyjnej dla każdego atomu. Zobacz Rysunek 8.21 „Różne pierwiastki na układzie okresowym”.
- Ti
- Cl
Odpowiedź
- 4s23d2
- 3s23p5
Rysunek 8.21 Różne pierwiastki w układzie okresowym
Food and Drink App: Artificial Colors
Kolor obiektów pochodzi z innego mechanizmu niż kolory neonów i innych świateł wyładowczych. Chociaż kolorowe światła produkują swoje kolory, obiekty są kolorowe, ponieważ preferencyjnie odzwierciedlają pewien kolor z białego światła, które świeci na nich. Czerwony pomidor, na przykład, jest jasnoczerwony, ponieważ odbija czerwone światło, podczas gdy pochłania wszystkie inne kolory tęczy.
Wiele produktów spożywczych, takich jak pomidory, są bardzo kolorowe, w rzeczywistości, wspólne oświadczenie „jesz najpierw oczami” jest implicite uznanie, że wizualna atrakcyjność żywności jest tak samo ważna jak jej smak. Ale co z przetworzoną żywnością?
Wiele przetworzonej żywności zawiera barwniki spożywcze dodane do nich. Istnieją dwa rodzaje barwników spożywczych: naturalne i sztuczne. Naturalne barwniki żywności obejmują karmelizowany cukier dla brązowego; annato, kurkuma i szafran dla różnych odcieni pomarańczowego lub żółtego; betanina z buraków dla fioletowego; a nawet karmin, głęboki czerwony barwnik, który jest ekstrahowany z koszenili, małego owada, który jest pasożytem na kaktusach w Ameryce Środkowej i Południowej. (To prawda: możesz jeść sok z robaków!)
Niektóre barwniki są sztuczne. W Stanach Zjednoczonych Food and Drug Administration obecnie zatwierdza tylko siedem związków jako sztuczne barwniki w żywności, napojach i kosmetykach:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- FD&C Green #3: Fast Green FCF
- RD&C Red #3: Erythrosine
- FD&C Red #40: Allura Red AC
- FD&C Yellow #5: Tartrazyna
- FD&C Żółty #6: Żółcień pomarańczowa FCF
Niżej numerowane kolory nie są już dostępne na rynku lub zostały usunięte z różnych powodów. Zazwyczaj te sztuczne barwniki są duże cząsteczki, które absorbują pewne kolory światła bardzo mocno, co czyni je użytecznymi nawet w bardzo niskich stężeniach w żywności i kosmetykach. Nawet w tak niskich ilościach, niektórzy krytycy twierdzą, że niewielka część populacji (zwłaszcza dzieci) jest wrażliwa na sztuczne barwniki i nalegają, aby ich stosowanie było ograniczone lub wstrzymane. Jednak formalne badania nad sztucznymi barwnikami i ich wpływem na zachowanie były niejednoznaczne lub sprzeczne. Pomimo tego, większość ludzi nadal korzysta z przetworzonej żywności ze sztucznymi barwnikami (jak te pokazane na załączonym rysunku).

Sztuczne barwniki spożywcze znajdują się w różnych produktach spożywczych, takich jak przetworzona żywność, cukierki i barwniki do jaj. Nawet karmy dla zwierząt domowych mają w sobie sztuczne barwniki spożywcze, choć prawdopodobnie zwierzę nie zwraca na to uwagi!
Źródło: Photo courtesy of Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- Układ elektronów w atomach jest odpowiedzialny za kształt układu okresowego.
- Konfiguracje elektronów można przewidzieć na podstawie położenia atomu na układzie okresowym.
Ćwiczenia
-
Gdzie na układzie okresowym podpowłoki s są zajmowane przez elektrony?
-
Gdzie na układzie okresowym elektrony zajmują podpowłoki d?
-
W jakim bloku znajduje się Ra?
-
W jakim bloku znajduje się Br?
-
Jakie są konfiguracje elektronowe powłok walencyjnych pierwiastków z drugiej kolumny układu okresowego?
-
Jakie są konfiguracje elektronowe powłoki walencyjnej pierwiastków w przedostatniej kolumnie układu okresowego?
-
Jakie są konfiguracje elektronowe powłoki walencyjnej pierwiastków w pierwszej kolumnie bloku p?
-
Jakie są konfiguracje elektronowe powłoki walencyjnej pierwiastków w ostatniej kolumnie bloku p?
-
Z pozycji pierwiastka na układzie okresowym przewidzieć konfigurację elektronową każdego atomu.
a) Sr
b) S
10. Na podstawie położenia pierwiastka na układzie okresowym, przepowiedz konfigurację elektronową każdego atomu.
a) Fe
b) Ba
11. Na podstawie położenia pierwiastka na układzie okresowym, przepowiedz konfigurację elektronową każdego atomu.
a) V
b) Ar
12. Na podstawie położenia pierwiastka na układzie okresowym, przepowiedz konfigurację elektronową każdego atomu.
a) Cl
b) K
13. Na podstawie położenia pierwiastka na układzie okresowym, przepowiedz konfigurację elektronową każdego atomu.
a) Ge
b) C
14. Na podstawie położenia pierwiastka na układzie okresowym, przepowiedz konfigurację elektronową każdego atomu.
a) Mg
b) I
Odpowiedzi
dwie pierwsze kolumny
klocek s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2
.