- Introduction
- Metody
- Przedmioty i projekt
- Akwizycja MRI i standardowa ocena objętości
- Przetwarzanie obrazów
- Discriminative Clustering Tissue Segmentation
- Oszacowanie częściowej objętości
- Ocena neuropsychologiczna
- Analiza statystyczna
- Wyniki
- Charakterystyka badanych
- Partial WML Volumes and other MRI Findings
- Partial WML Volumes as Predictors of Cognitive Performance
- Dyskusja
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Materiały uzupełniające
- Skróty
- Przypisy
Introduction
Cerebral small vessel disease (SVD) is the most common cause of vascular cognitive impairment and dementia. Zmiany w istocie białej (WML) są głównym markerem SVD w obrazowaniu mózgu, wraz z zawałami lakunarnymi, mikrokrwawieniami i zanikiem mózgu. Wykazano, że wszystkie te zmiany mają wpływ na wyniki kliniczne i poznawcze (Jokinen i in., 2011, 2012; Muller i in., 2011; Poels i in., 2012). W badaniu Leukoaraiosis and Disability (LADIS), wśród innych badań, wykazano, że WML są związane z pogorszeniem funkcji poznawczych, upośledzeniem zdolności funkcjonalnych, depresją oraz zaburzeniami chodu i równowagi (LADIS Study Group, 2011).
Magnetyczny rezonans magnetyczny (MRI) jest standardową metodą oceny WML. Pomimo znaczącego postępu w technikach ilościowej analizy obrazu, jedną z głównych przeszkód w MRI jest nadal jego skończona rozdzielczość przestrzenna, która prowadzi do efektów częściowej objętości. W połączeniu z szumem i niejednorodnością, stwarza to trudności dla technik segmentacji mózgu. Często konieczna jest dokładna analiza granic pomiędzy zdrowymi i patologicznymi tkankami, aby określić zakres i stopień zaawansowania zmian, stosując niejawny „próg decyzyjny” dla segmentacji zmian. Co więcej, hiperintensywności w MRI wydają się reprezentować jedynie końcowy etap procesu chorobowego. Z WML może być związane bardziej rozległe uszkodzenie tkanek, niewidoczne w rutynowym badaniu MRI (Schmidt i in., 2011). Nie istnieje standard oceny takich wczesnych etapów uszkodzenia tkanek, ponieważ ich wartości intensywności nie różnią się wystarczająco od wartości dla tkanek prawidłowych.
Większość nowoczesnych metod segmentacji opiera się na wcześniejszych informacjach, takich jak uśrednione atlasy mózgu (Smith i in., 2004; Ashburner i Friston, 2005; Goebel i in., 2006) lub ręczne etykietowanie (Wismüller i in., 2004; Lee i in., 2009; Cruz-Barbosa i Vellido, 2011). Ostatnio zaproponowano nową, sterowaną danymi metodę segmentacji tkanek, opartą na strategii discriminative clustering (DC), w podejściu samonadzorowanego uczenia maszynowego (Gonçalves i in., 2014). Metoda ta redukuje do minimum wykorzystanie informacji wstępnych i wykorzystuje wielospektralne dane MRI. W przeciwieństwie do innych metod, ukierunkowanych jedynie na zdrowe tkanki (Pham i Prince, 1998; Van Leemput i in., 1999; Zhang i in., 2001; Manjón i in., 2010) lub określone typy zmian (Van Leemput i in., 2001; Zijdenbos i in., 2002; Styner i in., 2008; Cruz-Barbosa i Vellido, 2011), DC pozwala na badanie szerokiego zakresu prawidłowych i nieprawidłowych typów tkanek. Innym ważnym atutem proponowanej metody jest możliwość oszacowania prawdopodobieństwa tkankowego dla każdego woksela, co jest niezbędne do odpowiedniej charakterystyki ewolucji WML. Woksele mogą być skategoryzowane jako zawierające mały (jeszcze zbyt słaby, aby był wyraźnie widoczny), średni lub duży odsetek WML. Te, które zawierają mały odsetek zmian, są zwykle poza „progiem decyzyjnym” konwencjonalnej segmentacji i wskazują na wczesne stadium WML.
Skupiono się w obecnym badaniu na obserwacji, jak różne stadia zmian są związane z wydajnością poznawczą w próbie starszych osób z łagodnym do umiarkowanego WML. Użyte dane składały się z pomiarów MRI zebranych w 3-letnim okresie obserwacji i rocznych ocen neuropsychologicznych w tym okresie. W szczególności, byliśmy zainteresowani ustaleniem, czy nawet najwcześniejsze małe częściowe objętości WML, w normalnie wyglądającej tkance mózgowej, są w stanie niezależnie przewidzieć przyszłe pogorszenie zdolności poznawczych, dodatkowo do konwencjonalnie ocenianego obciążenia WML.
Metody
Przedmioty i projekt
Badani stanowili podgrupę uczestników (n = 78) z trzech ośrodków (Amsterdam n = 21, Graz n = 18, Helsinki n = 39) badania LADIS, europejskiego wieloośrodkowego badania badającego wpływ związanej z wiekiem WML w przejściu od funkcjonalnej niezależności do niepełnosprawności. Protokół badania LADIS i charakterystyka próby zostały szczegółowo opisane w innym miejscu (Pantoni i in., 2005). W skrócie, do badania włączono 639 osób w 11 ośrodkach zgodnie z następującymi kryteriami włączenia: (a) wiek 65-84 lata, (b) łagodna do ciężkiej WML według zrewidowanej skali Fazekasa (Pantoni i in., 2005), (c) brak lub minimalne upośledzenie w skali Instrumental Activities of Daily Living (≤ 1 z 8 pozycji upośledzonych) (Lawton i Brody, 1969) oraz (d) obecność informatora, z którym można się regularnie kontaktować. Kryteriami wyłączenia były: (a) ciężka choroba mogąca spowodować porzucenie obserwacji (niewydolność serca, wątroby lub nerek, choroba nowotworowa lub inna istotna choroba układowa), (b) ciężka niepowiązana choroba neurologiczna lub zaburzenie psychiatryczne, (c) leukoencefalopatie pochodzenia pozanaczyniowego (immunologiczno-demielinizacyjne, metaboliczne, toksyczne, zakaźne) oraz (d) niezdolność lub odmowa poddania się badaniu MRI.
Ocena wyjściowa obejmowała MRI mózgu i dokładne oceny medyczne, funkcjonalne i neuropsychologiczne. Oceny kliniczne powtarzano w odstępach 12-miesięcznych przy trzech kolejnych ocenach kontrolnych.
Aby umożliwić ważne porównanie między podmiotami/ośrodkami, sekwencje MRI uzyskane w każdym ośrodku musiały być takie same, a każdy pacjent musiał mieć dostępne trzy sekwencje, bez większych artefaktów. 78 uczestników tego badania nie różniło się od pełnej kohorty LADIS pod względem wieku, płci, wyjściowego wyniku Mini-Mental State Examination (MMSE) lub objętości WML, ale mieli znacząco wyższe wykształcenie (9,3 vs. 11,7 lat; t = -4,6, p < 0,001).
Badanie zostało zatwierdzone przez komisje etyczne każdego ośrodka uczestniczącego w badaniu LADIS (LADIS Study Group, 2011). Wszyscy badani otrzymali i podpisali pisemną, świadomą zgodę. Współpracownicy badania LADIS są wymienieni w Dodatku II.
Akwizycja MRI i standardowa ocena objętości
Wszystkie wykorzystane skany osiowego MRI zostały uzyskane przy użyciu sprzętu 1.5T, zgodnie z tym samym protokołem w każdym ośrodku, w tym obrazy transferu magnetyzacji (TE = 10-14 ms, TR = 740-780 ms), obrazy T2-ważone szybkiego echa spinowego (TE = 100-120 ms, TR = 4000-6000 ms) i obrazy z atenuowanym płynem z odzysku inwersyjnego (FLAIR) (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Wszystkie sekwencje miały rozmiar woksela 1 × 1 × 5-7,5 mm3, FOV = 250 i przerwę międzypowłokową 0,5 mm.
Rozmiar hiperintensywności w regionach istoty białej, w tym w obszarze infratentorialnym, oceniano na osiowych obrazach FLAIR z półautomatyczną analizą wolumetryczną (VFLAIR) przy użyciu stacji roboczej Sparc 5 (SUN) (van Straaten i in., 2006). Zmiany zaznaczano i wyznaczano granice na każdym skrawku przy użyciu lokalnego progowania (oprogramowanie Show_Images, wersja 3.6.1). Nie dokonywano rozróżnienia między hiperintensywnością podkorową i okołokomorową. Obszary hiperintensywności na obrazach T2-ważonych wokół zawałów i lakun nie były brane pod uwagę. Liczbę laków rejestrowano w istocie białej i w głębokiej istocie szarej przy użyciu kombinacji obrazów FLAIR, magnetization prepared rapid-acquisition gradient-echo i T2 w celu odróżnienia laków od przestrzeni okołonaczyniowych i mikrokrwawień (Gouw et al., 2008). Ponadto atrofię mózgu oceniano zgodnie ze skalą ocen opartą na szablonie na obrazach FLAIR oddzielnie w regionach korowych i podkorowych (Jokinen i in., 2012).
Przetwarzanie obrazów
Aby zagwarantować, że informacja wielospektralna zawarta w każdym wokselu pochodziła z dokładnie tego samego miejsca u każdego uczestnika, zastosowano rejestrację wewnątrz pacjenta dla wszystkich dostępnych sekwencji, używając zestawu narzędzi SPM5 (Friston, 2003) i stosując transformację afiniczną z obrazem o najniższej rozdzielczości, zwykle FLAIR, jako szablonem. Ponadto, woksele tkanki pozamózgowej zostały zamaskowane przy użyciu standardowej metody automatycznej (BET2) (Smith et al., 2004).
Discriminative Clustering Tissue Segmentation
Ostatnie postępy w technikach uczenia maszynowego wykazały konkurencyjne wyniki w segmentacji tkanek, często pokonując dokładność osiąganą przez klasyczne metody oparte na region-growing lub progowe (Styner et al., 2008). W szczególności, w porównaniu z ręczną delineacją, są one bardziej odporne i mniej subiektywne. Metoda segmentacji tkanek zastosowana w niniejszej pracy była taką techniką uczenia maszynowego, opartą na metodologii samonadzorowanej opartej na danych, zakorzenionej w strategii DC (Gonçalves i in., 2014). Podobnie do nienadzorowanych algorytmów klasteryzacji, takich jak k-najbliższych sąsiadów, DC grupuje dane wejściowe zgodnie z ich wielowymiarową informacją dystrybucyjną na poziomie szarości. W obecnym badaniu rozkłady te były trójwymiarowe, co odpowiada całkowitej liczbie wykorzystanych sekwencji. Główną zaletą DC jest jego zdolność do wykorzystania niewielkiego zbioru etykietowanych informacji do wsparcia przypisania klasteryzacji. Ta cecha prowadzi do wyraźnej poprawy wyników segmentacji, wykraczającej poza tradycyjne techniki klasteryzacji (Gonçalves et al., 2014).
Ogólny cel DC można zatem podsumować jako podział przestrzeni danych na regiony klasteryzacji o raczej jednolitym rozkładzie w całej przestrzeni oraz spójnej informacji o etykietach dla wszystkich wokseli należących do każdego klastra. Bardziej szczegółowe wyjaśnienie znajduje się w Dodatku I, a pełny opis matematyczny przedstawiony jest w Gonçalves et al. (2014).
Oszacowanie częściowej objętości
DC daje prawdopodobieństwo przynależności każdego woksela do wszystkich klas tkanek, pozwalając na oszacowanie informacji o częściowej objętości. Ponieważ zamierzaliśmy skoncentrować nasze badanie na zmienionych chorobowo wokselach, analizowaliśmy tylko te, w których proporcja obecnej tkanki zmienionej chorobowo jest istotna.
W tym badaniu zidentyfikowano trzy różne kategorie zmian chorobowych, co prowadzi do odpowiedniego oszacowania objętości: objętość wokseli, które mają WYSOKIE (VDC100), ŚREDNIE (VDC66) lub MAŁE (VDC33) prawdopodobieństwo bycia zmianą chorobową. VDC100 i VDC66 to objętości, w których główna tkanka w znajdujących się tam wokselach ma prawdopodobieństwo bycia zmianą odpowiednio >66% i < 66%. Ponieważ obie objętości VDC100 i VDC66 zawierają większość tkanki zmienionej chorobowo, VFLAIR1 można przybliżyć za pomocą sumy: VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. W związku z tym, stosując DC, najlepsze możliwe oszacowanie objętości widocznej zmiany uzyskuje się przez VDCHARD. Ostatnia kategoria, VDC33 odpowiada objętości wokseli, w których zmiana jest drugim najbardziej prawdopodobnym typem tkanki, z prawdopodobieństwem ≥ 33%. Należy zauważyć, że ta objętość nie jest uważana za zmianę w normalnych metodach segmentacji, takich jak ta szacująca VFLAIR, ponieważ zmiana nigdy nie jest tam głównym typem tkanki.
Zdolność obecnej metody segmentacji do wykrywania zmian we wczesnym stadium została zweryfikowana w podgrupie pacjentów (n = 19) z danymi z kontrolnego MRI, c.f. Supplementary Materials: Dodatek I). Wykazano tam, że małe częściowe objętości WML wskazują na możliwe przyszłe lokalizacje w pełni rozwiniętych zmian.
Ocena neuropsychologiczna
Bateria testów poznawczych w badaniu LADIS obejmowała MMSE (Folstein et al., 1975), Vascular Dementia Assessment Scale-Cognitive Subscale (VADAS) (Ferris, 2003), test Stroopa (MacLeod, 1991) i test tworzenia szlaków (Reitan, 1958). Dla obecnych celów, użyliśmy całkowitych wyników MMSE i VADAS jako globalnych miar funkcji poznawczych. Ponadto do oceny poszczególnych domen poznawczych utworzono trzy solidne psychometrycznie miary złożone, wykorzystujące uśrednione standardowe wyniki poszczególnych podtestów, jak opisano wcześniej (Moleiro i in., 2013): (1) szybkość i kontrola motoryczna = z scores (Trail making A + labirynt + digit cancellation)/3; (2) funkcje wykonawcze = z scores of /4; i (3) pamięć = z scores (immediate word recall + delayed recall + word recognition + digit span)/4.
Odsetek brakujących wartości w zmiennych testu neuropsychologicznego wahał się od 0 do 6,4% na linii podstawowej i od 24,4 do 32,1% przy ostatniej ocenie kontrolnej. Ta utrata danych wynikała ze śmierci uczestników (n = 2), rezygnacji z dalszych ocen neuropsychologicznych (wizyta w ostatnim roku, n = 17) lub niezdolności do skompletowania całej baterii testów (n = 6).
Analiza statystyczna
Predyktory podłużnych wyników poznawczych analizowano przy użyciu liniowych modeli mieszanych (ograniczona estymacja największej wiarygodności), które są w stanie poradzić sobie z brakującymi wartościami i złożonymi strukturami kowariancji. Rok oceny (podstawowy, pierwszy, drugi i trzeci) został użyty jako zmienna wewnątrzprzedmiotowa, a struktura kowariancji była nieuporządkowana. Wyniki testów poznawczych zostały określone jako zmienne zależne. Objętości zmian częściowych (VDC33, VDC66, i VDC100) były testowane jako predyktory, jeden po drugim. We wszystkich modelach, wiek, płeć i lata edukacji były używane jako zmienne kowariantne. Modele powtórzono, dodając VFLAIR jako kolejny zmienny, aby sprawdzić wartość predykcyjną pomiarów częściowej objętości w porównaniu z konwencjonalnie ocenianą objętością WML. Podobnie dodano ośrodek badawczy jako potencjalny czynnik zakłócający, ale ponieważ nie miał on istotnego wpływu na wyniki, pominięto go w ostatecznych analizach. Ze względu na skośne rozkłady, które mogą naruszać założenie liniowości modeli mieszanych, zastosowano transformację logarytmiczną do wszystkich trzech pomiarów objętości częściowej i VFLAIR. Wyniki analizowano przy użyciu modułu mieszanego IBM SPSS Statistics 22. Istotność statystyczną ustalono przy p < 0,05 dla wszystkich analiz.
Wyniki
Charakterystyka badanych
Charakterystykę badanych przy linii podstawowej podano w tabeli 1. Zgodnie ze zmienioną skalą Fazekasa, 28 (35,9%) uczestników miało łagodną, 26 (33,3%) umiarkowaną, a 24 (30,8%) ciężką WML.

Tabela 1. Baseline characteristics of the subjects, n = 78.
Partial WML Volumes and other MRI Findings
Table 1 shows the volumes obtained by the conventional segmentation method, the partial lesion volumes estimated by DC, and the Dice similarity coefficient comparing both segmentation methods. Rycina 1 przedstawia porównanie pomiędzy oryginalnym obrazem FLAIR (1A), konwencjonalnie oszacowaną objętością hiperintensywną, VFLAIR (1B), a wynikami uzyskanymi dla częściowych objętości WML VDC100 (1C), VDC66 (1D) i VDC33 (1E). Na klatkach 1F-1J przedstawiono odpowiednie obrazy w powiększonym obszarze oznaczonym białym prostokątem na klatce 1A. Ewolucja wokół ognisk zmiany, od pełnego rozdęcia w centrum do stadium pośredniego i niewielkiego odsetka zmiany na krawędziach, jest widoczna na klatkach 1H-J. Należy zauważyć, że woksele sklasyfikowane jako VDC33 nie są uwzględnione w VFLAIR, ale wskazują na możliwe lokalizacje przyszłych zmian. Rycina 2 przedstawia podobne wyniki na wyższym poziomie, w centrum półowalnym. W procedurze segmentacji DC wykorzystano trzy różne sekwencje (FLAIR, T2, T1). Tutaj, dla celów ilustracyjnych, pokazano tylko FLAIR.
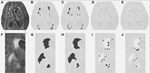
Rysunek 1. Zmiany w istocie białej (WML) na wysokości średniego poziomu. (A) Obraz FLAIR dla danej osoby. (B) Konwencjonalnie oszacowana WML. (C-E) Oszacowana WML, przy użyciu proponowanego algorytmu segmentacji, dla pełnej, pośredniej i małej części zmiany. (F-J) Podobne obrazy dla powiększonej części przedstawionej przez białą ramkę w (A).
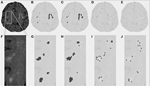
Rysunek 2. Zmiany w istocie białej (WML) w centrum półleżącym. (A) Obraz FLAIR dla danej osoby. (B) Konwencjonalnie oszacowana WML. (C-E) Szacowana WML przy użyciu proponowanego algorytmu segmentacji, dla pełnej, pośredniej i małej części zmiany. (F-J) Podobne obrazy dla powiększonej części przedstawionej przez białą ramkę w (A).
Dla całego użytego zestawu danych, trzy częściowe miary objętości WML korelowały ze sobą znacząco: VDC33*VDC66 r = 0,87; VDC33*VDC100 r = 0,47; VDC66*VDC100 r = 0,47 (p < 0,001). Korelowały one również istotnie z VFLAIR: VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023) i VDC100 r = 0,87 (p < 0,001), odpowiednio. Jednakże środki te nie były istotnie związane z obecnością zawałów lakunarnych (brak/kilka/wiele) lub wynikiem globalnej atrofii mózgu (korowej i podkorowej) (p > 0,05).
Rysunek 3 identyfikuje wspólne i rozbieżne segmentacje pomiędzy segmentacją konwencjonalną (VFLAIR), a DC (VDCHARD) dla obiektu z Rysunku 1. Istnieje wyraźne nakładanie się tych dwóch segmentacji, jak pokazuje duża liczba zielonych pikseli. Dla obiektu przedstawionego na tym rysunku, istnieje niewielka różnica pomiędzy VFLAIR i VDCHARD.
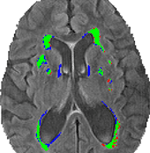
Rysunek 3. Porównanie metod segmentacji. Obraz ten przedstawia segmentację uzyskaną przy użyciu półautomatycznej analizy wolumetrycznej (VFLAIR) oraz klasteryzacji dyskryminacyjnej (VDCHARD) dla obiektu z ryciny 1. Regiony przedstawione na zielono odpowiadają segmentacji pokrywającej się pomiędzy oboma podejściami. Na czerwono pokazano regiony sklasyfikowane jako zmiana tylko przez metodę konwencjonalną, podczas gdy kolor niebieski odpowiada wokselom sklasyfikowanym jako zmiana tylko przez DC.
Oszacowanie pełnej klasyfikacji tkanek u jednego uczestnika, przy użyciu DC na komputerze z procesorem Intel® Core™ i5-4590 CPU@ 3.30 GHz z 16 GB pamięci RAM, zajęło około 25 min. Estymacja etykiet, na wspomnianym komputerze, zajęła około 70 min. Poprawa tej ostatniej estymacji powinna znacznie usprawnić procedurę.
Partial WML Volumes as Predictors of Cognitive Performance
Zależności pomiędzy częściowymi objętościami WML a podłużnymi wynikami poznawczymi są podsumowane w Tabeli 2. Liniowe modele mieszane dostosowane do wieku, płci i wykształcenia wykazały znaczące negatywne związki między VDC33 a wynikiem złożonym dla funkcji wykonawczych. Po pierwsze, VDC33 był związany z istotnym głównym efektem na ogólny poziom sprawności wykonawczej (wyniki średnio we wszystkich czterech ocenach czasowych). Po drugie, interakcja pomiędzy VDC33 i czasem (rok oceny) wskazywała na znaczącą wartość predykcyjną VDC33 dla zmiany w wynikach funkcji wykonawczych w ciągu 3 lat obserwacji. W szczególności, wyższy ładunek VDC33 wiązał się z gorszymi wynikami na poziomie wyjściowym i gwałtowniejszym spadkiem funkcji wykonawczych w każdym kolejnym roku oceny. Po dodatkowym skorygowaniu o VFLAIR, wyniki te pozostały niezmienione. Co więcej, istniało słabe podstawowe powiązanie między VDC33 i całkowitym wynikiem VADAS, ale ten wynik nie był już istotny po skorygowaniu o VFLAIR.VDC33 nie miał znaczących efektów głównych lub interakcji z czasem w MMSE, VADAS, szybkości przetwarzania lub funkcji pamięci.
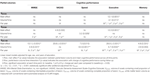
Tabela 2. Zależność między objętościami częściowych zmian w istocie białej a wydajnością poznawczą w 3-letniej obserwacji.
VDC66 był związany ze znaczącymi efektami głównymi wskazującymi na gorszy ogólny poziom wydajności w VADAS i funkcjach wykonawczych. Interakcja między VDC66 a czasem była istotna tylko dla szybkości przetwarzania. Inspekcja wyników w poszczególnych punktach czasowych wykazała znaczące powiązanie wyjściowe (VADAS, funkcje wykonawcze), jak również zmianę wzdłużną w pierwszym (VADAS, funkcje wykonawcze), drugim (MMSE, funkcje wykonawcze) i trzecim (funkcje wykonawcze) roku obserwacji. Kontrola dla VFLAIR miała minimalny wpływ na te wyniki (Tabela 2).
Wreszcie, VDC100 był związany z istotnymi efektami głównymi we wszystkich punktach neuropsychologicznych. Interakcje VDC100* czas wskazywały na znaczący związek ze zmianą podczas obserwacji w czterech z pięciu środków poznawczych. Na tym etapie, zmiany były systematycznie związane z wydajnością poznawczą już na poziomie podstawowym. Ponadto, stromy spadek wydajności był widoczny od pierwszej do ostatniej oceny kontrolnej, z pewnym zróżnicowaniem w różnych pomiarach poznawczych. Większość z tych wyników pozostała nawet po dodatkowej kontroli dla VFLAIR, pomimo jego wysokiej korelacji z VDC100 (Tabela 2).
Pomimo VDC33 i VDC66, VFLAIR pozostał znaczącym predyktorem ogólnej wydajności w okresie obserwacji w VADAS i funkcjach wykonawczych. Jednakże, VFLAIR nie miał niezależnej wartości predykcyjnej przyrostowej do tej z VDC100 na jakimkolwiek z poznawczych środków.
Dyskusja
To badanie zbadało podłużny poznawczy wpływ częściowej WML, od najsłabszych zmian w normalnie wyglądającej istocie białej do w pełni rozwiniętych zmian. Badanie wykorzystało nowatorską metodę segmentacji tkanek multispektralnego MRI opartą na DC (Gonçalves et al., 2014) i corocznie powtarzane oceny neuropsychologiczne w 3-letniej obserwacji. Zidentyfikowano różne typy tkanek, wykorzystując jednocześnie wszystkie dostępne sekwencje MRI. WML został następnie skategoryzowany według częściowych objętości jako mała, pośrednia i całkowita zmiana.
W przeciwieństwie do konwencjonalnej ręcznej segmentacji tkanek, gdzie decyzja opiera się na ukrytym progu poziomu szarości, proponowana metoda daje dostęp do „podprogowych” informacji dotyczących zmian. Pozwala to na lepszą ocenę progresji zmian (informacja jakościowa), jak również wolumetrii sub-wokseli (informacja ilościowa). Istnieją również inne metody, które dostarczają informacji o proporcjach tkanek (Van Leemput i in., 2003; Manjón i in., 2010). Jednak wykorzystują one pewne priorytety, które sprawiają, że nie nadają się do wykrywania WML, takie jak założenie, że jeden woksel nie może zawierać więcej niż dwa typy tkanek.
Głównym wnioskiem z niniejszego badania było to, że nawet najmniejsza częściowa objętość WML, VDC33, była znacząco związana z gorszymi wynikami wykonawczymi już na poziomie wyjściowym i przewidywała przyszły spadek funkcji wykonawczych w ciągu 3 lat obserwacji. Efekt ten był niezależny od czynników demograficznych i, co istotne, również od konwencjonalnie ocenianej objętości hiperintensywnej na obrazach FLAIR. W podgrupie badanych dodatkowo wykazaliśmy, że VDC33 prawdopodobnie reprezentują najwcześniejsze zmiany w normalnie wyglądającej istocie białej, ponieważ ich wykrycie, na poziomie podstawowym, wskazywało na przyszłe lokalizacje w pełni rozwiniętych zmian po obserwacji (Dodatek I).
Zmiany pośredniego stadium, VDC66, były niezależnie związane z bardziej rozległym pogorszeniem funkcji poznawczych, w tym ze zmianami w szybkości przetwarzania i funkcjach wykonawczych, a także z globalnymi funkcjami poznawczymi. Ponadto, pełnoobjawowe zmiany, VDC100, były związane z jeszcze wyraźniejszymi efektami rozprzestrzeniającymi się na wszystkie oceniane domeny poznawcze, zarówno na poziomie podstawowym, jak i w obserwacji. Nie jest zaskakujące, że VDC100 jest silnym predyktorem pogorszenia funkcji poznawczych. Ponieważ VDC100 był wysoce skorelowany z VFLAIR, który wcześniej wykazał silny związek ze zmianami poznawczymi (Jokinen i in., 2011; Kooistra i in., 2014), powinien mieć raczej podobną moc predykcyjną.
Nowatorskim i najważniejszym wynikiem obecnego badania jest to, że objętość zmian wykrytych poniżej progu decyzyjnego pozwala już na przewidywanie poszczególnych wyników poznawczych. Najwcześniejsze oznaki pogorszenia funkcji poznawczych stwierdzono w szczególności w zakresie funkcji wykonawczych, które, jak się przypuszcza, zasadniczo zależą od integralności połączeń przedczołowo-podkorowych istoty białej (O’sullivan i in., 2001). Funkcje wykonawcze obejmują procesy kontroli poznawczej, takie jak elastyczność umysłowa, hamowanie i planowanie związane ze złożonym zachowaniem ukierunkowanym na cel. Funkcje te mają kluczowe znaczenie dla zdolności funkcjonalnych jednostki w życiu codziennym (Tomaszewski Farias i wsp., 2009).
Wyniki przedstawione w niniejszym artykule wspierają hipotezę, że hiperintensywności WML stanowią jedynie „wierzchołek góry lodowej”, podczas gdy w rzeczywistości uszkodzenie istoty białej w SVD ewoluuje jako stopniowy proces dotykający szerszych obszarów mózgu (Schmidt i wsp., 2011; Maillard i wsp., 2013). Badania obrazowania dyfuzyjnego wykazały, że subtelne zmiany mikrostrukturalne, nawet w normalnie wyglądającej tkance mózgowej, są związane z upośledzeniem funkcji poznawczych i przewidują złe wyniki poznawcze i kliniczne w dalszej obserwacji (Schmidt i in., 2010; Jokinen i in., 2013). Integralność mikrostrukturalna jest szczególnie zmniejszona w pobliżu WMH, co wykazano na podstawie anizotropii frakcyjnej (Maillard i in., 2011). To zjawisko zwane „WMH penumbra” może być związane z obserwowanymi w naszym badaniu objętościami częściowych WML we wczesnym stadium. Jednak wczesne początki zmian mogą również występować w pewnej odległości od w pełni rozwiniętej WML, co szczegółowo przedstawiono w Dodatku I. Według naszej wiedzy, związek tych podprogowych zmian ogniskowych z wynikiem poznawczym nie został wcześniej pokazany.
Prezentowana próba składa się z mieszanej grupy starszych osób, jednakowo stratyfikowanych do wszystkich stopni ciężkości WML, od łagodnego do ciężkiego. Uczestnicy byli rekrutowani w różnych miejscach, na podstawie różnych powodów skierowania, reprezentujących różnorodność pacjentów z WML napotkanych w praktyce klinicznej (LADIS Study Group, 2011). Ta heterogeniczność badanych może jednak przesłonić najbardziej subtelne efekty między wynikami badań obrazowych a pogorszeniem funkcji poznawczych. Typowo dla podłużnych badań nad starzeniem się i chorobami naczyniowo-mózgowymi, niektóre dane zostały utracone z powodu porzucenia obserwacji przez uczestników lub niezdolności do ukończenia całej oceny.
Jako ograniczenie, protokół obrazowania LADIS nie był początkowo zaprojektowany dla obecnej ilościowej metody segmentacji, więc tylko część oryginalnych danych obrazowania mogła być wykorzystana. Ponadto, szum obrazu, rozdzielczość i artefakty ruchowe są wszystkimi czynnikami, które mogą wpłynąć na wynik wieloośrodkowego badania, takiego jak to przedstawione tutaj. Jest to szczególnie prawdziwe, gdy mamy do czynienia z efektami częściowej objętości. Pomimo tych ograniczeń i po skorygowaniu dla niektórych z wyżej wymienionych czynników zakłócających, byliśmy w stanie wykryć subtelne oznaki progresji zmiany, oparte na wokselach o małym prawdopodobieństwie bycia zmianą.
Aby poprawić wiarygodność wyników przedstawionych w tym manuskrypcie, można było rozważyć większą kohortę. Ze względu na obawy dotyczące spójności w różnych ośrodkach i zmian w konfiguracji obrazowania w różnym czasie, należy zastosować bardziej rygorystyczną politykę dotyczącą zastosowanych sekwencji MRI.
Mocne strony tego badania obejmują nowatorską, solidną, samonadzorowaną i opartą na danych metodę analizy obrazu, która umożliwia identyfikację typów tkanek i kwantyfikację patologicznych zmian w mózgu na bardzo wczesnym etapie, na którym konwencjonalna ocena MRI nie byłaby przydatna. Badanie korzysta również ze szczegółowych ocen neuropsychologicznych, przeprowadzanych w rocznych odstępach w 3-letniej obserwacji.
W podsumowaniu, wczesne zmiany w normalnie wyglądającej istocie białej już dają wskazówkę o postępującym pogorszeniu i złym wyniku poznawczym. Na tym etapie zaburzone są przede wszystkim funkcje wykonawcze, ale szkodliwy wpływ na poznanie staje się bardziej globalny, gdy zmiany stopniowo przekształcają się w pełnowartościowe WML, ostatecznie wykrywalne również w konwencjonalnej segmentacji tkanek MRI. Wyniki te potwierdzają proponowaną metodę wielospektralnej segmentacji tkanek MRI jako obiecujące narzędzie mające wartość dodaną w rozpoznawaniu ryzyka SVD i klinicznie istotnego postępującego pogorszenia funkcji poznawczych.
Wkład autorów
Wszyscy autorzy dokonali krytycznej korekty manuskryptu pod kątem ważnych treści intelektualnych. Ponadto, najważniejsza praca każdego z autorów dla tego badania była następująca: HJ; Odpowiedzialny badacz i autor korespondujący, projekt i konceptualizacja badania, pozyskiwanie danych neuropsychologicznych i klinicznych, analiza statystyczna i interpretacja, redagowanie i wykończenie manuskryptu. NG; Odpowiedzialny badacz, projekt i konceptualizacja badania, opracowanie metody segmentacji MRI, analiza danych MRI, redagowanie i wykończenie manuskryptu. RV; Opracowanie metody segmentacji MRI, analiza danych MRI, projekt i konceptualizacja badania. JL; Biegłość w analizie i interpretacji statystycznej. FF; Projekt badania LADIS, odpowiedzialny za metody MRI. RS; Projekt badania LADIS, odpowiedzialny za metody MRI. FB; Projekt badania LADIS, odpowiedzialny za metody MRI. SM; Konstrukcja baterii testów neuropsychologicznych, gromadzenie danych neuropsychologicznych i klinicznych. AV; Pozyskiwanie danych neuropsychologicznych i klinicznych. DI; Koordynator badania, członek komitetu sterującego badania LADIS, projekt badania LADIS. LP; Koordynacja i projekt badania LADIS. TE; Członek komitetu sterującego badania LADIS, projekt badania LADIS, konceptualizacja i projekt badania. HJ i NG w równym stopniu przyczynili się do powstania tej pracy.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Badanie Leukoaraiosis and Disability Study było wspierane przez Unię Europejską (grant QLRT-2000-00446). Praca HJ była wspierana przez granty z Clinical Research Institute i Medical Research Fund of the Helsinki University Central Hospital oraz Ella and Georg Ehrnrooth Foundation. NG była finansowana przez grant nr SFRH/BD/36178/2007 z Fundação para a Ciência e Tecnologia.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Skróty
DC, discriminative clustering; FLAIR, fluid-attenuated inversion recovery; LADIS, Leukoaraiosis and Disability Study; MMSE, Mini-Mental State Examination; MRI, magnetic resonance imaging; SVD, small vessel disease; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale; VDC33, objętość wokseli zawierających niewielką część zmiany; VDC66, objętość wokseli zawierających pośrednią część zmiany; VDC100, objętość wokseli zawierających pełną część zmiany; VDCHARD = VDC100 + VDC66; VFLAIR, objętość WML mierzona za pomocą konwencjonalnej półautomatycznej analizy na obrazach FLAIR; WML, zmiana w istocie białej.
Przypisy
1. ^VFLAIR, objętość WML mierzona za pomocą konwencjonalnej półautomatycznej analizy na obrazach FLAIR.
2. ^VDCHARD, objętość odpowiadająca wokselom, w których większość tkanki stanowi zmiana chorobowa.
Ashburner, J., and Friston, K. J. (2005). Unified segmentation. Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., and Vellido, A. (2011). Semi-supervised analysis of human brain tumor from partially labeled MRS information using manifold learning models. Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). Ogólne miary poznania. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini-mental state. a practical method for grading the cognitive state of patients for the clinician. J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). „Statistical parameter mapping. a practical guide,” in Neuroscience Databases, ed R. Kötter (New York, NY: Springer), 237-250. Dostępny w Internecie pod adresem: http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., and Formisano, E. (2006). Analysis of functional image analysis contest data with brainvoyager QX: from single-subject to cortically aligned group general linear model analysis and self-organizing group independent component analysis. Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., and Vigário, R. (2014). Self-supervised MRI tissue segmentation by discriminative clustering. Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. (2008). Progression of white matter hyperintensities and incidence of new lacunes over a 3-year period: the Leukoaraiosis and Disability study. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. (2011). Incident lacunes influence cognitive decline: the LADIS study. Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. (2012). Brain atrophy accelerates cognitive decline in cerebral small vessel disease: the LADIS study. Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. (2013). Diffusion changes predict cognitive and functional outcome: the LADIS study. Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Vascular brain lesions, brain atrophy, and cognitive decline. the second manifestations of arterial disease-magnetic resonance (SMART-MR) study. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011: dekada badania LADIS (Leukoaraiosis And DISability): czego dowiedzieliśmy się o zmianach w istocie białej i chorobie małych naczyń? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., and Brody, E. M. (1969). Assessment of older people: self-maintaining and instrumental activities of daily living. Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). MR image segmentation using a power transformation approach. IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Pół wieku badań nad efektem stroopa: przegląd integracyjny. Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. (2013). FLAIR i sygnały dyfuzji MRI są niezależnymi predyktorami hiperintensywności istoty białej. Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. (2011). White matter hyperintensity penumbra. Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., and Robles, M. (2010). Improved estimates of partial volume coefficients from noisy brain MRI using spatial context. Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. (2013). Confirmatory factor analysis of the neuropsychological assessment battery of the LADIS study: a longitudinal analysis. J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., and Geerlings, M. I. (2011). Zanik mózgu i poznanie: interakcja z patologią mózgowo-naczyniową? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., and Markus, H. S. (2001). Evidence for cortical „disconnection” as a mechanism of age-related cognitive decline. Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. (2005). Impact of age-related cerebral white matter changes on the transition to disability-the LADIS study: rationale, design and methodology. Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., and Prince, J. L. (1998). Partial volume estimation and the fuzzy C-means algorithm. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Cerebral microbleeds are associated with worse cognitive function: the rotterdam scan study. Neurology 78, 326-333. doi: 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). Ważność testu tworzenia śladów jako wskaźnika organicznego uszkodzenia mózgu. Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. (2010). Diffusion-weighted imaging and cognition in the leukoariosis and disability in the elderly study. Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. (2011). Heterogeneity in age-related white matter changes. Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. (2004). Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. (2008). „3D segmentation in the clinic: a grand challenge II: MS lesion segmentation,” MIDAS Journal, MICCAI 2008 Workshop. Dostępne online pod adresem: http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). Longitudinalne zmiany w pamięci i funkcjonowaniu wykonawczym są związane z longitudinalnymi zmianami w instrumentalnych czynnościach życia codziennego u starszych dorosłych. Clin. Neuropsychol. 23, 446-461. doi: 10.1080/138540802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (1999). Automated model-based tissue classification of MR images of the brain. IEEE Trans. Med. Imaging 18, 897-908. doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., and Suetens, P. (2001). Automated segmentation of multiple sclerosis lesions by model outlier detection. IEEE Trans. Med. Imaging 20, 677-688. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). A unifying framework for partial volume segmentation of brain MR images. IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). Impact of white matter hyperintensities scoring method on correlations with clinical data: the LADIS study. Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., and Ritter, H. (2004). W pełni zautomatyzowana segmentacja obrazów biomedycznych poprzez samoorganizującą się adaptację modelu. Neural Netw. 17, 1327. doi: 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., and Smith, S. (2001). Segmentacja obrazów MR mózgu za pomocą modelu ukrytego pola losowego Markowa i algorytmu maksymalizacji oczekiwań. IEEE Trans. Med. Imaging 20, 45-57. doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002). Automatic pipeline analysis of 3-D MRI data for clinical trials: application to multiple sclerosis. IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar
.