Introduction
Zaburzenia neurodegeneracyjne stanowią ogromne globalne niezaspokojone potrzeby medyczne i wymagają opracowania nowych terapii modyfikujących przebieg choroby. Biorąc pod uwagę podstępny charakter tych zaburzeń i wysokie koszty wielu testów diagnostycznych, istnieje duże zapotrzebowanie na szeroko dostępne, wiarygodne i niedrogie biomarkery do śledzenia postępu procesów neurodegeneracyjnych w ramach czasowych odpowiednich do opracowywania leków. W tym kontekście, EEG może mieć niezwykły potencjał. Chociaż EEG jest podatne na znane czynniki związane ze stylem życia i lekami, ma wiele istotnych zalet. EEG odzwierciedla aktywność synaptyczną, która jest wspólnym mianownikiem dla funkcjonalnego wpływu procesów neurodegeneracyjnych. EEG jest nieinwazyjną, przenośną, bezpieczną i niedrogą technologią, która jest powszechnie akceptowana i wymaga stosunkowo krótkiego czasu akwizycji. Jakościowe EEG jest rutynowo stosowane w praktyce klinicznej w diagnostyce padaczki. Ostatnio, integracja ilościowego biomarkera EEG (qEEG) i oceny klinicysty została zaproponowana do oceny zespołu nadpobudliwości psychoruchowej z deficytem uwagi (ADHD) i uzyskała od FDA (Food and Drug Administration) oznaczenie klasy II w celu wsparcia oceny klinicznej ADHD (Lenartowicz i Loo, 2014; Snyder i in., 2015). qEEG jest w fazie badań do zastosowania jako punkt końcowy w chorobach neurodegeneracyjnych w badaniach klinicznych. Jednakże, ostatnie postępy w analizie danych, interpretacji i ulepszonej rozdzielczości przestrzennej zwiększyły potencjał EEG jako wiarygodnego, dokładnego biomarkera progresji choroby neurodegeneracyjnej. Wiele opisanych obserwacyjnych analiz qEEG w stanie spoczynku potwierdza jego potencjalną wartość jako biomarkera do wykrywania neuronalnych sygnatur neurodegeneracji występujących w chorobie Alzheimera (Babiloni i in., 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), chorobie Parkinsona (Sarnthein i Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al., 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) i demencji czołowo-skroniowej (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
Na przestrzeni lat technologia sprzętowa EEG również ewoluowała i pojawiło się kilka bezprzewodowych systemów wielokanałowych, które dostarczają wysokiej jakości sygnały EEG i fizjologiczne w prostszej, wygodniejszej i bardziej komfortowej konstrukcji niż tradycyjne, kłopotliwe systemy. Tradycyjne systemy EEG wymagają długiego czasu montażu i aplikacji, co zwykle wiąże się z otarciami skóry głowy pacjenta. Czas aplikacji i dyskomfort sprawiają, że te tradycyjne systemy są trudne do zastosowania w populacjach dotkniętych demencją, gdzie współpraca z długotrwałymi procedurami klinicznymi jest często trudna. Jednak kilka obecnie dostępnych systemów bezprzewodowych można zastosować w ciągu 20 minut lub krócej, bez dyskomfortu podczas aplikacji i z wygodnym dopasowaniem podczas akwizycji. W połączeniu z postępem w technikach wykrywania sygnału i analizy ilościowej, systemy bezprzewodowe są idealnymi kandydatami do stosunkowo szybkiej, tolerowanej oceny klinicznej potencjalnie trudnych populacji demencji, takich jak behawioralna odmiana demencji czołowo-skroniowej, charakteryzująca się wybitnymi zmianami zachowania i osobowości.
Ostatnio rośnie również rynek konsumenckich technologii noszonych na ciele, co prowadzi do ograniczonych systemów kanałowych dostępnych do użytku osobistego, takich jak medytacja i trening relaksacyjny. Można sobie wyobrazić, że systemy te, mimo ich ograniczonego zasięgu, mogą być również wykorzystywane w wybranych badaniach klinicznych. Zastosowanie tych systemów konsumenckich w badaniach prób klinicznych nie zostało jednak szeroko zbadane, a dokładność i wiarygodność tych systemów dla powtarzanych pomiarów nie zostały dobrze ustalone. Ponadto, nie jest jasne, czy akwizycja z ograniczonym kanałem może dostarczyć wystarczających danych i pokrycia anatomicznego do oceny sygnatur neuronalnych u pacjentów dotkniętych chorobami neurodegeneracyjnymi.
Bieżące badanie zostało zaprojektowane w celu zapewnienia wstępnej oceny potencjału konsumenckich systemów EEG do badań klinicznych, poprzez porównanie łatwości użycia, dokładności i niezawodności dwóch klasy medycznej, wielokanałowych bezprzewodowych systemów EEG, B-Alert X24, i Enobio 20, z dwoma konsumenckimi, ograniczonymi systemami kanałowymi, Muse i Mindwave.
Materiały i metody
Uczestnicy
Populacja badawcza obejmowała pięciu zdrowych uczestników, którzy spełnili kryteria kwalifikacji do badania (Tabela 1). Uczestnicy zostali wykluczeni z badania, jeśli po zapoznaniu się z historią choroby, przyjmowanymi jednocześnie lekami i stylem życia (spożycie alkoholu i kofeiny oraz palenie tytoniu) uznano, że nie są zdrowi. W szczególności, z badania wykluczono osoby z padaczką w wywiadzie lub innymi zaburzeniami snu, neurologicznymi lub psychiatrycznymi, przyjmujące leki lub prowadzące tryb życia, o którym wiadomo, że może wpływać na sygnał EEG, taki jak palenie tytoniu i znaczne spożycie alkoholu i kofeiny.

Tabela 1. Dane demograficzne populacji badanej i charakterystyka wyjściowa.
Od wszystkich uczestników badania uzyskano pisemną świadomą zgodę zgodnie z wytycznymi dotyczącymi badań eksperymentalnych z udziałem ludzi, wymaganymi przez Chesapeake Institutional Review Board.
Procedury badawcze, akwizycja danych EEG i analiza
Aby uniknąć potencjalnej zmienności sygnału EEG związanej z przyjmowaniem pokarmów i zmianami okołodobowymi, wszystkie wizyty odbywały się rano po standardowym niskowęglowodanowym, wysokobiałkowym śniadaniu (aby zminimalizować senność poposiłkową) w miejscu badań Advanced Brain Monitoring (ABM). Dodatkowo, uczestnicy zostali poproszeni o unikanie napojów alkoholowych w noc poprzedzającą wizytę badawczą, jak również o post i unikanie kofeiny w dniu wizyty.
Dane EEG zostały pozyskane podczas dwóch oddzielnych wizyt w odstępie ~1 tygodnia z dwóch wielokanałowych (20 kanałów) medycznych systemów EEG, B-Alert (Advanced Brain Monitoring, ABM) i Enobio (Neuroelectrics) (Rycina 1, Tabela 2) oraz dwóch ograniczonych systemów konsumenckich, Muse (Interaxon, 2 kanały) i Mindwave (Neurosky, jeden kanał) (Rycina 1, Tabela 2) w następującej kolejności: Muse, Mindwave, B-Alert, Enobio. System EEG B-Alert X24 i Enobio są 20-kanałowymi systemami bezprzewodowymi z certyfikatem medycznym CE, stosowanymi w standardowym międzynarodowym montażu 10-20 i rejestrującymi sygnał EEG z częstotliwością próbkowania 256 Hz. Ponadto, B-Alert został dopuszczony przez FDA do stosowania jako urządzenie medyczne.
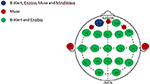
Rysunek 1. Anatomiczny rozkład kanałów w wielo- i ograniczonokanałowych systemach EEG. Przedstawienie wspólnych i unikalnych kanałów wśród czterech ocenianych systemów EEG. Kanał wspólny dla wszystkich czterech systemów EEG, Fp1 (niebieski); kanały unikalne dla systemu Muse (czerwony); kanały współdzielone pomiędzy systemami wielokanałowymi, B-Alert i Enobio (zielony).

Tabela 2. Porównanie systemów EEG.
B-Alert używa sutków jako kanału referencyjnego. Enobio może być używany z referencją mastoidalną, klipsem na ucho lub przy użyciu innych lokalizacji na skórze głowy. Mindwave również posiada kanał referencyjny na ślizgu ucha, a Muse posiada trzy kanały referencyjne na czole. Wszystkie systemy zawierały kontrolę jakości sygnału, jednak w przeciwieństwie do medycznych systemów EEG, oba systemy konsumenckie mają suche elektrody i nie mają kontroli impedancji.
Technologie te zostały wybrane w oparciu o ich zdolność do zapewnienia użytkownikom końcowym surowych danych wyjściowych EEG poprzez praktyczny i niekosztowny dostęp.
Dziesięciominutowy zapis EEG w stanie spoczynku został uzyskany podczas otwartych oczu (EO) z fiksacją wzrokową na symbolu krzyża prezentowanym na ekranie komputera (5 min), jak również podczas zamkniętych oczu (EC) przez 5 min.
Ponieważ wszystkie cztery systemy dzielą tylko kanał FP1 (Rysunek 1), wzorce EEG (surowe i odkażone), gęstości widmowe mocy (PSD) i porównania wiarygodności test/retest w czterech systemach EEG ocenianych w badaniu zostały wykonane skupiając się na elektrodzie Fp1 zarówno w warunkach EO jak i EC.
Dane EEG z każdego systemu zostały załadowane do MATLAB (Mathworks) przy użyciu niestandardowych funkcji. Dane EEG zarejestrowane podczas przerw i instrukcji zostały odrzucone przed analizą. Gęstość widmową mocy EEG dla każdej epoki 1 s obliczano przy użyciu zmodyfikowanej metody periodogramu Welcha z oknem Hamminga o długości 1 s. PSD obliczano dla spoczynkowego EEG zarówno w okresie otwartych, jak i zamkniętych oczu. Aby zapewnić równe jednostki (μV), stosowano współczynnik korekcji 1,25 (Muse), 0,25 (MindWave) lub 1,000 (Enobio 20). Wszystkie dane PSD kanału Fp1 były uśredniane dla pięciu badanych podczas każdej wizyty. Test-retest przeprowadzono poprzez obliczenie i wykreślenie Vist1/Visit2.
Wyniki
Uczestnicy
Uczestnicy byli zdrowymi ochotnikami ze średnią wieku 27 lat, wszyscy byli praworęczni i niepalący, przeważali wśród nich mężczyźni (60%). Ich dane demograficzne i charakterystyka wyjściowa są podsumowane w Tabeli 1.
Resting State EEG
Dane EEG zostały pomyślnie zebrane ze wszystkich czterech testowanych systemów. Zgodnie z oczekiwaniami, ze względu na suche elektrody i ograniczoną liczbę kanałów, czas konfiguracji był znacznie krótszy w przypadku konsumenckich systemów EEG. Nie zaobserwowano jednak różnicy w tolerancji i akceptacji badanych przez cztery systemy.
Patterns of raw EEG data in EO (Figure 2) and EC (Figure 3) conditions were collected and evaluated from each system. Systemy Muse i Mindwave były bardziej podatne na artefakt wynikający z mrugania oczami i ruchów mięśni w okolicy czołowej przy otwieraniu oczu (Rysunek 2).
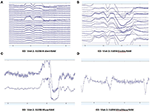
Rysunek 2. Ekstrakty surowych danych EO z B-Alert (A) i Enobio (B) Muse (C) i MindWave (D) w obrębie tego samego uczestnika podczas tej samej wizyty.
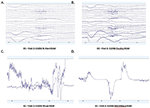
Rysunek 3. Fragmenty surowych danych EC z B-Alert (A) i Enobio (B) Muse (C) i MindWave (D) w obrębie tego samego uczestnika podczas tej samej wizyty.
Kanał Fp1 Gęstości widmowe mocy (PSDs) Porównanie
Średnie PSDs w kanale Fp1 wspólne dla wszystkich czterech systemów EEG dla Wizyty 1 i Wizyty 2 zostały obliczone i zostały wykreślone dla obu warunków EO (Rysunki 4A,B) i EC (Rysunki 4C,D). W warunkach EO, widma B-alert i Enobio były w przybliżeniu równe, podczas gdy Mindwave była nieznacznie zwiększona, ale podążała podobną krzywą. Szerokopasmowy wzrost mocy zaobserwowano dla PSD uzyskanych za pomocą systemu Muse. Podobnie, w warunku EC (ryc. 4C,D), widma B-Alert, Enobio i Mindwave były podobne, jednakże zaobserwowano wzrost mocy szerokopasmowej dla widm Muse, które również charakteryzowały się większą zmiennością niż pozostałe systemy. Piki przy 8-12 Hz (pasmo alfa) były widoczne w widmach uzyskanych za pomocą systemów B-Alert, Enobio i Mindwave podczas każdej wizyty. Podczas gdy dla widma mocy systemu Muse na wizycie 2 występował wyraźny pik alfa, w widmach z wizyty 1 nie zaobserwowano żadnego szczytu.
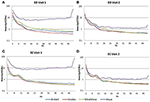
Rysunek 4. Gęstości widmowe mocy Fp1 (PSD) ze wszystkich czterech systemów EEG w stanie EO na wizycie 1 (A) i wizycie 2 (B) oraz w stanie EC na wizycie 1 (C) i wizycie 2 (D).
Fp1 Channel Resting EEG Test/Retest Comparison
W stanie EC stosunek widmowy mocy wynosił od 0,975 do 1,025 dla systemów B-Alert, Enobio i Mindwave (ryc. 5A). Współczynniki PSD systemu Muse były bardziej zróżnicowane niż pozostałych trzech systemów, a współczynniki mieściły się w przedziale od 1,125 do 1,225. W warunkach EO, okazało się, że istnieje nieco większe zróżnicowanie dla Enobio w zakresie wolnych fal Delta (1-3 Hz), Theta (3-7 Hz) i wolnej alfa (8-10) oraz dla B-Alert i Mindwave w zakresie szybszych fal Beta (13-30 Hz) i Gamma (25-40 Hz). Nadal jednak wskaźniki mieściły się w przedziale od 0,975 do 1,05. Podobnie jak w przypadku warunku EC, test/retest dla Muse charakteryzował się większą zmiennością, ze współczynnikami do 1,2 (Rysunek 5B).
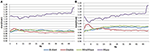
Rysunek 5. Test-retest ratios for EC (A) and EO (B) condition.
Discussion
This study compared quantitative EEG signal and test-retest reliability of medical and consumer EEG systems in order to evaluate their potential application in clinical research and clinical trials. Nowe, popularyzowane konsumenckie systemy EEG były oceniane ze względu na ich niski koszt, szeroką dostępność i potencjał do badań domowych w wymagających populacjach. Wśród popularnych zastosowań konsumenckich systemów EEG znajdują się treningi medytacji i relaksacji, a także radzenie sobie z lękiem i bólem. Ostatnio prowadzone są badania nad ich użytecznością nie tylko w grach komputerowych: Wykazano, że NeuroSky jest w stanie wykryć początek fazy 1 snu (Van Hal i in., 2014), pojawiło się również zainteresowanie oceną konsumenckiego EEG w ramach interfejsów komputerowych mózgu (Białas i Milanowski, 2014; Kim i in., 2015; Taherian i in., 2017). Zastosowanie prostszych systemów EEG (np. 6-kanałowych) jest również badane w warunkach awaryjnych (Jakab i in., 2014). Wcześniejsza ocena, chociaż wykorzystująca bardziej złożony zestaw słuchawkowy, wykazała, że komercyjnie dostępne wielodiodowe konsumenckie systemy EEG, takie jak 16-elektrodowy czepek Emotiv EPOC, mogą również mieć wartość w ocenie warunków klinicznych (Schiff i in., 2016).
To badanie dostarczyło dowodów na to, że dość dobrej jakości dane EEG mogą być z powodzeniem zbierane z konsumenckich EEG. Istniały jednak różnice w przyroście mocy, retestach testowych i kształcie piku alfa obserwowanego przy 8-13 Hz. Mindwave wykazał ogólnie podobne spektra mocy Fp1 do systemów medycznych z lekkim szerokopasmowym wzrostem w stosunku do B-Alert i Enobio. Muse wykazał szerokopasmowy wzrost widma mocy, który może odzwierciedlać artefakt w danych uzyskanych przez suchą elektrodę.
Konsumenckie systemy EEG wykazały znacznie wygodniejszą i szybszą konfigurację, co jest optymalne dla ich przeznaczenia do zastosowań rozrywkowych i samopomocy. Jednakże na ich jakość danych negatywny wpływ miała podatność na artefakty związana z elektrodą suchą. Zgodnie z oczekiwaniami, jakość danych była szczególnie pogorszona podczas EO. Brak możliwości badania impedancji i zastosowanie do badania okolicy czołowej, która jest szczególnie podatna na mruganie oczami i ruch mięśni przy otwieraniu oczu, prawdopodobnie również przyczyniły się do powstania tego względnego artefaktu. Dodatkowo, ocena wykonywana przez konsumenckie systemy EEG jest, z natury rzeczy, ograniczona i ograniczona do jedynego anatomicznego obszaru mózgu objętego kilkoma kanałami, co wyklucza ocenę wielu sieci.
Suche elektrody mogą być również bardziej podatne na dyskomfort w miarę upływu czasu i stwarzają większe ryzyko nieprawidłowego umiejscowienia na czole, co prowadzi do niedokładnej akwizycji sygnału i testów/retestów. W porównaniu z urządzeniami klasy medycznej, wiarygodność testów/retestów była niższa w konsumenckich systemach EEG. Wiarygodność została zmierzona za pomocą akwizycji test-retest dla wszystkich systemów (Rysunek 5). Podczas gdy B-Alert, Enobio i Mindwave wypadły dość dobrze, Muse miał stosunkowo niską wiarygodność. Ponadto, podczas gdy wyraźny szczyt alfa został wykazany dla Muse na wizycie 2 (Rysunek 4), brak szczytu alfa na wizycie 1 sugeruje brak spójności, który może być spowodowany artefaktem. Spójne, wiarygodne pomiary aktywności mózgu są kluczowe w badaniach klinicznych przy monitorowaniu postępu choroby i ocenie skuteczności terapii eksperymentalnej. Podczas gdy systemy konsumenckie mogą być przydatne do szybkiej oceny, gdy czas jest ograniczony, te ograniczenia konsumenckiego EEG mogą utrudniać ich zastosowanie w badaniach i próbach klinicznych, a system klasy medycznej o wysokiej wiarygodności test-retest jest zalecany do stosowania jako farmakodynamiczny punkt końcowy w ocenach klinicznych.
Wreszcie, porównanie medycznych i konsumenckich systemów EEG w warunkach eksperymentalnych podkreśliło różnice w działaniu, a w szczególności specyficzne ograniczenia w użyciu, które mogą utrudniać zastosowanie systemów konsumenckich w badaniach i próbach klinicznych. Z drugiej strony, medyczne systemy wieloprzewodowe są mniej idealne do celów rozrywkowych, które wymagają szybkiej konfiguracji i przetwarzania danych z minimalnej liczby elektrod. Głównym ograniczeniem tego badania jest mała liczebność badanej populacji oraz brak randomizacji kolejności systemów używanych do akwizycji danych. Dane były pozyskiwane w tej samej kolejności systemów, aby uniknąć wpływu czasu akwizycji, który może wpływać na EEG z powodu rytmów okołodobowych. Jednakże, metryka mocy EEG okazała się być bardzo wiarygodna i powtarzalna dla poszczególnych osób przy użyciu standardowych systemów EEG. Z tego powodu wybrana wielkość próby została uznana za informatywną.
Podsumowując, dane EEG mogą być z powodzeniem zbierane ze wszystkich czterech testowanych systemów, w tym konsumenckich systemów EEG, z różnymi ograniczeniami w zakresie użyteczności, jakości danych i wiarygodności, które kierują ich optymalnymi zastosowaniami, w tym w warunkach badań klinicznych. Podatność na artefakty i zmienność w wiarygodności test/retest związane z obecnymi konsumenckimi systemami EEG sugerują użycie systemu EEG klasy medycznej dla solidnych klinicznych przekrojowych i podłużnych zbiorów danych EEG.
Wkład autorów
ER i AV: uczestniczyli w koncepcji i projekcie projektu, analizie i interpretacji danych oraz przygotowaniu manuskryptu. SW, CB i GR: uczestniczyli w tworzeniu koncepcji i planu projektu, jego realizacji, analizie i interpretacji danych oraz przygotowaniu manuskryptu. Wszyscy autorzy brali udział w redagowaniu, pisaniu i poprawianiu manuskryptu i wszyscy przeczytali i zatwierdzili jego ostateczną wersję.
Funding
This study was supported by Biogen.
Conflict of Interest Statement
ER i AV: pracownik Biogen. SW i CB: pracownik Advanced Brain Monitoring, Inc. GR: pracownik firmy Neuroelectrics.
Podziękowania
Chcielibyśmy podziękować uczestnikom badania za poświęcony czas i wkład w to badanie. Zespół firmy Biogen uczestniczył w projektowaniu badania, analizie i interpretacji danych, w pisaniu raportu oraz w podjęciu decyzji o złożeniu artykułu do publikacji.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Cortical sources of resting state electroencephalographic rhythms in Parkinson’s disease related dementia and Alzheimer’s disease. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). „Development of EEG biomarkers for Alzheimer’s disease,” in GTC Biomarkers Summit (San Diego, CA).
Białas, P., and Milanowski, P. (2014). A high frequency steady-state visually evoked potential based brain computer interface using consumer-grade EEG headset. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). Quantitative EEG and LORETA: valuable tools in discerning FTD from AD? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., and ChiehLee, T. (2015). Frequency power and coherence of electroencephalography are correlated with the severity of Alzheimer’s disease: a multicenter analysis in Taiwan. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Quantitative EEG markers relate to Alzheimer’s disease severity in the prospective dementia registry Austria (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). EEG dominant frequency peak differentiates between Alzheimer’s disease and frontotemporal lobar degeneration. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Novel wireless electroencephalography system with a minimal preparation time for use in emergencies and prehospital care. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., and Jo, S. (2015). Ilościowa ocena taniego, nieinwazyjnego interfejsu hybrydowego opartego na EEG i ruchu gałek ocznych. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). „Deep networks using auto-encoders for PD prodromal analysis,” in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Zastosowanie EEG do diagnozowania ADHD. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011). Anatomiczne podłoże i markery EEG skóry głowy są skorelowane u osób z zaburzeniami poznawczymi i chorobą Alzheimera. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Differences in quantitative EEG between frontotemporal dementia and Alzheimer’s disease as revealed by LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Investigation of resting-state EEG functional connectivity in frontotemporal lobar degeneration. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., and Soria-Frisch, A. (2016). „EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients,” in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). High thalamocortical theta coherence in patients with Parkinson’s disease. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). A low-cost, user-friendly electroencephalographic recording system for the assessment of hepatic encephalopathy. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., and Johnson, R. (2015). „A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Integracja biomarkera EEG z oceną ADHD dokonywaną przez klinicystę. Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). „Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017). Are we there yet? Evaluating commercial grade brain-computer interface for control of computer applications by individuals with cerebral palsy. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., and Bossemeyer, R. (2014). Niskokosztowa detekcja snu oparta na EEG. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., and Verma, A. (2016). „Identification of neurophysiological biomarkers of MCI using resting state, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar
.