- Background and Introduction
- Prezentacja przypadku
- Dyskusja
- Patofizjologia ADI
- Literatura Search
- Przyczyny ADI
- Prezentacja kliniczna ADI
- Powikłania towarzyszące ADI
- Postępowanie w ADI
- Podsumowanie
- Dostępność danych
- Oświadczenie o etyce
- Zgoda na udział
- Wkład autorów
- Funding
- Oświadczenie o konflikcie interesów
- Podziękowania
Background and Introduction
Podwzgórzowy cukrzycowy zespół niedocukrzenia (ADI), rzadki zespół o heterogennym obrazie klinicznym, charakteryzuje się występowaniem zaburzeń w homeostatycznych mechanizmach gospodarki wodnej. Obejmują one mechanizm osmoregulacji pragnienia, wydzielanie wazopresyny argininowej oraz zdolność nerek do zagęszczania moczu. Mniej niż sto ciężkich przypadków zostało zgłoszonych na całym świecie w ciągu ostatnich czterech dekad (1).
Zarządzanie takimi pacjentami jest niezwykle trudne, ponieważ pacjenci ci mają tendencję do cierpienia z powodu szerokich wahań stężenia sodu w osoczu, nawet jeśli DI jest dobrze kontrolowany (2).
Zgłaszamy przypadek ciężkiego ADI, który wystąpił pooperacyjnie po operacji malformacji tętniczo-żylnej mózgu (AVM). Opisujemy możliwą patogenezę tego przypadku i dokonujemy przeglądu literatury dla wszystkich podobnie opisanych przypadków i opisujemy potencjalnie zaangażowane mechanizmy, prezentację kliniczną, ostre jak i przewlekłe postępowanie oraz rokowanie.
Prezentacja przypadku
27-letnia kobieta przedstawiona z lewym czołowym krwotokiem śródmózgowym z wewnątrzkomorowym rozszerzeniem wtórnym do dużego kompleksu zwojów podstawy (AVM) ze złożonymi tętniczymi podajnikami od lewej środkowej mózgowej arterii (MCA) i przednich mózgowych arterii (ACA) ze Spetzler Martin Grading Scale z 3 (3).
Po początkowym powrocie do zdrowia po kraniotomii dekompresyjnej i operacji ewakuacji skrzepu, ona przeszła elektywną operację wycięcia AVM ~2 tygodnie później. Podczas operacji AVM, chirurdzy zgłosili gwałtowne krwawienie z naczyń doprowadzających (MCA, ACA i naczynia choroidalne) z ciężkim krwotokiem śródmózgowym i krwotokiem wewnątrzkomorowym wymagającym masywnej transfuzji krwi do 32 jednostek śródoperacyjnie. Umieszczono ją w śpiączce indukowanej barbituranami i indukowanej hipotensją w celu zminimalizowania obrzęku mózgu (4).
Wkrótce po epizodzie obfitego krwawienia śródoperacyjnego zaczęła mieć wielomocz z dużymi objętościami moczu śródoperacyjnie. Chociaż przedoperacyjnie jej stężenie sodu było prawidłowe, natychmiast (w ciągu pierwszej godziny) po operacji stężenie sodu było wyższe w zakresie 151-160 mmol/l w połączeniu z niską osmolalnością moczu <130 mosm/l. Rozważano wystąpienie przejściowego DI i rozpoczęto podawanie dożylnej desmopresyny (IV desmopressin) w dawce 1 mcg, którą podawano codziennie wraz z 3,5-4 L wlewem soli fizjologicznej o połowie mocy przez 3 kolejne dni.
Ponieważ jednak w 4. dobie pooperacyjnej wystąpił u niej obrzęk płuc (prawdopodobnie konsekwencja masywnej śródoperacyjnej transfuzji krwi, dożylnego podawania płynów hipotonicznych i jednoczesnego dożylnego podawania desmopresyny), odstawiono dożylną desmopresynę, a w celu zmniejszenia obrzęku pozanaczyniowego podano świeżo mrożone osocze i leki moczopędne (dożylny furosemid 40 mg). W ciągu następnej godziny u chorej ponownie wystąpił wielomocz z wydajnością 800 mL moczu w ciągu godziny, a stężenie sodu wzrosło do 172 mmol/L. W związku z towarzyszącym pooperacyjnym obrzękiem mózgu podjęto decyzję o celowanym obniżeniu stężenia sodu, tak aby tempo spadku stężenia sodu utrzymywało się w granicach 5-10 mmol/L/dobę, z docelowym poziomem 155 mmol/L. Podano dożylnie małą dawkę desmopresyny 0,25 mcg i zasugerowano schemat miareczkowania w celu utrzymania godzinowego wydalania moczu poniżej 100 ml/godz. W 5. dobie pooperacyjnej pacjentka wymagała dożylnego podania 0,75 mcg desmopresyny, a następnie dożylnego podania 0,25 mcg dwa razy dziennie w 6. dobie po osiągnięciu docelowego stężenia 155 mmol/l. Takie stężenie sodu można było utrzymać przy dawkowaniu desmopresyny przez kolejne 2 dni.
W 9. dobie pooperacyjnej odstawiono desmopresynę, ponieważ pacjentka była w stanie utrzymać niski strumień moczu bez desmopresyny, a stężenie sodu było stabilne. Na tym etapie uznano, że u pacjentki rozwinął się zespół niewłaściwego wydzielania hormonu antydiuretycznego (SIADH) i ograniczono podawanie płynów do 1 L/dobę. Jej stężenie sodu pozostawało stabilne na poziomie 134-138 mmol/l w ciągu tego tygodnia.
W 14. dobie pooperacyjnej u pacjentki ponownie rozwinęła się wielomocz z rosnącym stężeniem sodu i osmolalnością surowicy. W tym czasie wznowiono podawanie desmopresyny dożylnie w dawce 0,25 mcg dwa razy na dobę. Stężenie sodu można było utrzymać na poziomie 138-150 mmol/l za pomocą dożylnej desmopresyny (0,25 mcg dwa razy dziennie) i płynów. U pacjentki wystąpiła faza trójfazowa z okresem przejściowego DI, po którym nastąpił SIADH, a następnie trwały DI (patrz ryc. 1). Poziomy kortyzolu, hormonu wzrostu, insulinopodobnego czynnika wzrostu-1, czynności tarczycy i prolaktyny w surowicy mieściły się w zakresie normy.

Rysunek 1. Wykres przedstawiający wszystkie seryjne pomiary u naszej pacjentki podczas całej hospitalizacji.
Po wszczepieniu shuntu komorowo-otrzewnowego (wykonanego w celu utrzymania ciśnienia wewnątrzczaszkowego) 6 tygodni po wycięciu AVM, pacjentka została przeniesiona na oddział rehabilitacyjny, a reżim dożylnego podawania desmopresyny zamieniono na reżim podskórny (SC) (patrz Rycina 1). Kiedy zaprzestano żywienia przez sondę nosowo-żołądkową, próbowaliśmy regulować płyny poprzez pragnienie. Badania krwi wykazały wzrost poziomu sodu do 165 mmol/l, a pacjentka nie odczuwała pragnienia w tym okresie hipernatremii, pomimo osmolalności surowicy 350 mosm/kg. Pozostała adyptywna pomimo powrotu afazji. Nie zastosowano skali pragnienia, ponieważ w trakcie badania pacjentka oświadczyła, że w ogóle nie odczuwa pragnienia, a zastosowanie skali pragnienia nie było możliwe. W związku z tym należało regulować ilość płynów, aby utrzymać równowagę sodową. Wydalanie moczu było stałe, a równowaga sodowa dobrze uregulowana dzięki podawaniu desmopresyny w dawce 0,5 mcg rano i 0,375 mcg w nocy oraz płynów w ilości 1,5-2 l na dobę. Nie stwierdzono u niej zaburzeń termoregulacji. Kranioplastyka z polieteroeteroketonu (PEEK) została wykonana ~4 miesiące po pierwotnej operacji.
Po 5 miesiącach intensywnej wielodyscyplinarnej rehabilitacji nadal miała niefunkcjonalną dominującą prawą rękę i znaczne resztkowe deficyty poznawcze, a bezpieczne dawkowanie i samodzielne podawanie podskórnej desmopresyny nie było możliwe w dłuższej perspektywie.
Próba zastosowania desmopresyny donosowej i desmopresyny doustnej wykazała znaczne zmienne wchłanianie prowadzące do większych wahań w stężeniach sodu. W związku z tym zdecydowaliśmy się na stosowanie desmopresyny podjęzykowej dostępnej pod nazwą Desmopressin Melt. Po kilku próbach różnych schematów dawkowania udało nam się ustalić ilość wydalanego moczu na około 2 L/dobę, stosując desmopresynę Melt w postaci doustnego liofilizatu w dawce 120 mcg (2 tabletki) rano i 60 mcg (1 tabletka) wieczorem. Przy tej dawce występowała jednak hiponatremia w niektórych porach dnia. Przeprowadziliśmy dalsze miareczkowanie dawki, rozcinając tabletki desmopresyny za pomocą pęsety/szpilki, aby wyjąć tabletki z blistra i pociąć je dokładnie na ćwiartki (każda 15 mcg) za pomocą obcinacza do tabletek. Przy reżimie 90 mcg (1,5 tabletki) rano i 75 mcg (1,25 tabletki) wieczorem udało nam się osiągnąć podobne wyniki jak przy reżimie podskórnym. Dzięki temu reżimowi i regulowanemu spożyciu płynów wynoszącemu 2 L/dobę, jej stężenie sodu utrzymywało się w zakresie 135-150 mmol/l bez większych wahań lub objawów poznawczych. Takie dawkowanie pozwoliło jej również na zwiększoną aktywność w ciągu dnia w celu rehabilitacji, a w nocy mogła spać spokojnie, bez zaburzeń związanych z wielomoczem.
Zobacz rycinę 1 dla seryjnych pomiarów sodu u tej pacjentki przez cały okres hospitalizacji z opisanymi powyżej zdarzeniami.
W świetle historii klinicznej i faktu, że jej przysadka i podwzgórze są w większości nienaruszone, jest mało prawdopodobne, że miała znaczące defekty baroregulacji.
Dyskusja
Patofizjologia ADI
W warunkach fizjologicznych, sód w osoczu, osmolalność i równowaga wodna są utrzymywane w wąskich zakresach wtórnie do starannego współdziałania między pragnieniem i przyjmowaniem wody, wydzielaniem neurofizjologicznej wazopresyny i antydiurezą w nerkowych dystalnych kolektorach.
Obwodowe sygnały (ustno-gardłowe, jelitowe osmoreceptory, osmolalność krwi) kodują informacje o aktualnym stanie nawodnienia w czasie rzeczywistym i są one centralnie zintegrowane (5). Stan odwodnienia prowadzi do sygnałów stymulujących do narządu podoczodołowego (SFO), który hierarchicznie wysyła sygnały do organum-vasculosum of lamina terminalis (OVLT) i jądra przedwzrokowego środkowego (MnPO) (6). MnPO, które może służyć jako „centralny detektor”, wysyła sygnały stymulujące do jąder podwzgórza w celu zwiększenia uwalniania wazopresyny, a także wysyła zwiększony sygnał pragnienia przez SFO i OVLT (7, 8). Ścieżki neuronalne związane z pragnieniem, łączące SFO i OVLT z korą zakrętu obręczy i korą wyspową, powodują świadome odczuwanie pragnienia (7, 8). Przeciwnie, w stanie odpowiedniego nawodnienia, sygnały z czujników obwodowych prowadzą do hamowania tych obszarów, a ujemne sprzężenie zwrotne z MnPO prowadzi do tłumienia pragnienia i obniżenia wydzielania i uwalniania wazopresyny (obwód czerwony). W efekcie, neurony w MnPO, OVLT i SFO są szeroko i wzajemnie powiązane, ponieważ optogenetyczna i chemogenetyczna aktywacja neuronów w każdym z tych obszarów może stymulować pragnienie (9). W związku z tym zaburzenie dopływu krwi skutkujące uszkodzeniem komórek prowadzi do adipsy. Opublikowano również przypadki ADI z powodu autoimmunizacji komórek neuronalnych z SFO i OVLT, wskazujące na funkcjonalne znaczenie tych neuronalnych czujników w kontroli pragnienia (10).
Neurony AVP wykazują „fazową” aktywność potencjałów czynnościowych z przerwami, w których AVP jest uwalniany na zakończeniach aksonów. Uwalnianie wazopresyny jest regulowane przez wejścia osmoreceptorowe z MnPO, przez baroreceptory i istnieje również regulacja antycypacyjna, gdzie uwalnianie wazopresyny jest stymulowane przed posiłkami (prandial), na hipertermii i w rytmie okołodobowym (11). Istnieje circadian dzienny wzór wydzielania wazopresyny w obiegu ze wzrostem poziomu między 24:00 i 02:00 h i poziomy spadają stopniowo w ciągu dnia z nadir między 16:00 i 20:00 h (12). Ten okołodobowy wzrost o północy spowodowany wzrostem uwalniania wazopresyny wynika częściowo ze zwiększonego synaptycznego pobudzenia magnokomórkowych neuronów neurosekrecyjnych przez jądro nadskrzyżowaniowe, o którym wiadomo, że reguluje rytm okołodobowy (11). W ADI osmoreceptorowa regulacja wydzielania wazopresyny jest najbardziej dotknięta, a inne efekty mogą być zmienne w zależności od miejsca i rozległości urazu, podczas gdy odpowiedź baroreceptorów jest znana jako zachowana u wielu pacjentów z ograniczonym urazem, jak wykazano w jednym z badań (13).
AVP działa na nerkowe kanaliki zbiorcze poprzez receptory wazopresyny-2 (V2) w celu zwiększenia przepuszczalności wody, co prowadzi do zmniejszenia tworzenia moczu. Reabsorpcja wody jest kontrolowana poprzez regulację kanału wodnego, akwaporyny-2 (AQP2). AVP w krótkim okresie indukuje wewnątrzkomórkową translokację pęcherzyków zawierających AQP2 do apikalnej błony plazmatycznej, regulując w ten sposób handel AQP2. W dłuższym okresie, przy odpowiednim stężeniu AVP, reguluje transkrypcję genu AQP2 w celu zwiększenia obfitości białka AQP2 w przewodzie zbiorczym (14). W ADI postulujemy, że prawdopodobnie ostra odpowiedź osmoreceptorowa jest bardziej dotknięta niż odpowiedź przewlekła. Stąd będzie względna obfitość akwaporyny, ale ostra trafficking do błony apikalnej będzie dotknięta.
See Figure 2 dla szczegółowej ilustracji mechanizmów.
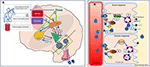
Figure 2. Schematyczne przedstawienie regulacji bilansu płynów u człowieka. (A) Kontrola i regulacja wydzielania wazopresyny w mózgu. (A) Sygnały obwodowe (osmozensory ustno-gardłowe, jelitowe, osmolalność krwi) kodują informacje o aktualnym stanie nawodnienia w czasie rzeczywistym (1) i centralnie zintegrowane (2). Stan odwodnienia prowadzi do sygnałów stymulujących do SFO, który hierarchicznie wysyła sygnały do OVLT i MnPO (3). MnPO, który może służyć jako „centralny detektor”, wysyła sygnały stymulujące do jąder podwzgórza w celu zwiększenia uwalniania wazopresyny (4), a także wysyła zwiększony sygnał pragnienia przez SFO i OVLT (5, niebieski obwód na schemacie). Przeciwnie, w stanie odpowiedniego nawodnienia sygnały z czujników obwodowych hamują te obszary i ujemne sprzężenie zwrotne z MnPO prowadząc do stłumienia pragnienia i zmniejszenia wydzielania i uwalniania wazopresyny (obwód czerwony 6). Szlaki neuronalne związane z pragnieniem, łączące SFO i OVLT z korą zakrętu obręczy i korą wyspową, prowadzą do świadomej percepcji pragnienia (7). W adyptywnym DI, przy braku bodźców osmoreceptorowych, związane z nimi obwody neuronalne z powodu uszkodzenia komórek, stymulującego uwalniania lub hamowania wazopresyny i świadomej percepcji pragnienia są zaburzone. (B) Mechanizm działania wazopresyny na kanaliki zbiorcze nerek. (B) Wazopresyna w krążeniu krwi przyłącza się do receptora wazopresyny 2 na luminalnej powierzchni komórek głównych dystalnej kanalika zbiorczego w nerkach (1). W fazie ostrej, poprzez syntezę cAMP z ATP przez AC (cyklazę adenylanową) tworzy kinazę białkową A (2), która stymuluje translokację akwaporyny z pęcherzyka magazynującego do błony apikalnej i powierzchni luminalnej krwi (3). Powoduje to transport wody do wnętrza komórki (4), a następnie jej wchłanianie do krążenia (5). W fazie przewlekłej, poprzez pośredniczoną przez cAMP transkrypcyjną kontrolę genu akwaporyny (6), w komórkach głównych można stwierdzić zwiększony poziom kanału wodnego akwaporyny (7). W adipsic DI ostra odpowiedź jest prawdopodobnie bardziej dotknięta niż przewlekła odpowiedź, ponieważ wydzielanie wazopresyny związane z osmozą jest dotknięte.
Literatura Search
Wykonaliśmy systematyczne wyszukiwanie literatury, w tym Pubmed, Scopus i Embase dla przypadków zgłoszonych jako opis przypadku lub serii przypadków ADI z lat 1980-2018. Użyliśmy hasła wyszukiwania: Adipsia, Adipsic disorder, i Adipsic DI i ograniczyliśmy wyszukiwanie do języka angielskiego i do Humans. Przeszukaliśmy również wszelkie inne referencje zidentyfikowane podczas czytania każdego opisu przypadku/serii przypadków. Znaleźliśmy 25 referencji (10, 13, 15-39) z łącznie 45 przypadkami opisanymi w literaturze. Wszystkie opisy przypadków podsumowaliśmy w Tabeli 1.
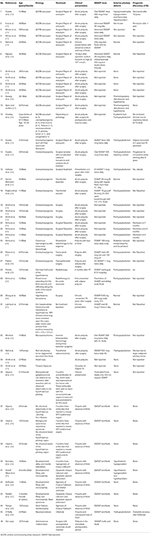
Tabela 1. Dane demograficzne, etiologia, obraz kliniczny, postępowanie i rokowanie u pacjentów z cukrzycą adyptywną opisanych w piśmiennictwie.
Przyczyny ADI
Czterdzieści procent (17/46) opisanych w literaturze przypadków ADI wystąpiło wtórnie do pęknięcia tętniaka tętnicy łączącej przedniej (anterior communicating artery – ACOM) i pooperacyjnego klipsowania przy użyciu kraniektomii czołowej. W jednym przypadku opisano podwójną patologię: craniopharyngioma i tętniaka ACOM (15). Opisano, że tętnicze zaopatrzenie OVLT pochodzi z czterech źródeł (40): (1) górnego przyśrodkowego źródła odgałęziającego się od tętnicy łączącej przedniej, (2) i (3) dwóch bocznych źródeł pochodzących z tętnic, które odgałęziają się od każdej tętnicy mózgowej przedniej poniżej tętnicy łączącej przedniej, oraz (4) dolnego przyśrodkowego źródła wstępującego spod ścięgna nerwu wzrokowego. Charakterystyczne jest to, że naczynia włosowate wyściełające ten narząd leżą poza barierą krew-mózg i stąd zmiana osmolalności może być łatwo wyczuwalna przez te narządy (41). Należy zauważyć, że udoskonalenie technik chirurgicznych i stosowanie zwijania zamiast klipsowania może ograniczyć te powikłania. W przypadku pacjentów w dobrym stanie klinicznym z pękniętymi tętniakami krążenia przedniego, którzy nadają się do koilingu, dane z metaanalizy wskazują, że koilowanie wiąże się z lepszym wynikiem leczenia (42). W porównaniu z klipsowaniem, gdzie oba końce ACA są klipsowane z przerwaniem dopływu krwi do podwzgórza, procedura wprowadzania cewki do tętniaka jest w stanie zachować dopływ krwi do podwzgórza w większości przypadków.
Druga przyczyna ADI została opisana jako suprasellar craniopharyngioma (17/46). Przypadki te często wymagają wycięcia przezczołowego, a w niektórych przypadkach opisywano powrót do zdrowia po operacji. Opisano również przypadek naczyniaka jamistego z podobną manifestacją po epizodzie krwawienia (26).
Guzy podwzgórza, w tym hamartoma, guz szyszynki i guz z komórek germinalnych mogą występować z ADI (26, 29, 30). Opisano również przypadek raka wątrobowokomórkowego z przerzutami do podwzgórza, co spowodowało wystąpienie ADI (31).
Co ciekawe, opisano tylko dwa przypadki guzów przysadki z ADI (18, 32). Oba te przypadki miały agresywny guz z wielokrotną resekcją przezczołową i krwotokiem śródczaszkowym śródoperacyjnie. Opisano również po jednym przypadku w związku z urazem głowy i ekspozycją na toluen (13).
Cztery przypadki opisano z nagłą, ostrą prezentacją wielomoczu i hipernatremii. Pacjenci ci nie mieli żadnych strukturalnych nieprawidłowości w podwzgórzu, a szczegółowe badania ujawniły dowody na obecność przeciwciał przeciwko narządom OVLT. Postuluje się, że u podłoża tych przypadków leży patologia autoimmunologiczna (10, 33).
Wrodzone lub wczesnodziecięce przypadki u pacjentów z problemami rozwojowymi ciała modzelowatego również zostały opisane z manifestacją ADI (34-38). Opisano również przypadek neurosarkoidozy z rozległym zajęciem przysadki przedniej, przysadki tylnej i podwzgórza z ADI (39).
Prezentacja kliniczna ADI
Prezentacja kliniczna w większości opisanych przypadków to wielomocz w bezpośrednim tygodniu po chirurgicznym wycięciu AVM lub po kraniotomii. Prezentacja biochemiczna to hipernatremia ze zwiększoną osmolalnością surowicy w obecności niewłaściwie rozcieńczonego moczu w dużych objętościach. Jeśli odczuwanie pragnienia jest oceniane za pomocą skali pragnienia, pacjenci z ADI zgłaszają niskie lub minimalne pragnienie pomimo hipernatremii. Co ciekawe, pacjenci ci mają normalną odpowiedź na hipotensję, a ich mechanizm baroreceptorowy jest nienaruszony (13).
Nasz pacjent przeszedł przez trójfazową fazę początkowego DI, po której nastąpił SIADH, a następnie stały DI. Ten wzorzec określany jako odpowiedź trójfazowa był opisywany po operacjach przysadki mózgowej i czaszkogardlaka. Patofizjologia trójfazowej odpowiedzi wydaje się być wyjaśniona przez wczesną dysfunkcję podwzgórza (charakteryzującą się wielomoczem i hipernatremią), późniejsze uwolnienie preformowanej wazopresyny z pęcherzyków magazynujących w tylnej przysadce (niezwiązane z żadnym bodźcem) (charakteryzujące się SIADH) i w końcu wyczerpanie zapasów wazopresyny (trwały DI) (43). U naszego pacjenta prawdopodobnie w trzeciej fazie, po ustąpieniu SIADH, dochodzi do ujawnienia niedoboru odpowiedzi na osmolalność w uwalnianiu wazopresyny, a nie do bezwzględnego wyczerpania wazopresyny.
Powikłania towarzyszące ADI
W niewielu opisach przypadków opisywano zaburzenia termoregulacji. Panhypopituitarism has been reported in craniopharyngioma cases and in pituitary tumor cases only and was not present in our patient.
Although not consistently reported, other important complications of the hypernatremia include deep vein thrombosis; heparin low molecular weight heparin may be indicated during acute sickness and immobilization (18).
Hypothalamic obesity and sleep apnoea has been commonly reported as well (18). W jednej serii przypadków (13), w której oceniali odpowiedź AVP na hipotensję, stwierdzili, że pacjenci z craniopharyngiomas również mieli utratę odpowiedzi AVP regulowanej przez bar. Pacjenci ci mieli dowody na panhypopituitaryzm, wskazując, że operacja ich guzów pozostawiła bardziej rozległe uszkodzenia przysadki, w tym tylnej części przysadki, która jest ostatnią wspólną drogą dla wydzielania AVP.
Postępowanie w ADI
Postępowanie w tych przypadkach zostało opisane (15, 18). Kluczowe znaczenie ma edukacja pacjenta i jego rodziny w zakresie zasad bilansu wodnego i gospodarki wodnej. Przyjmowanie wody można ustalić na 1,5-2 L dziennie, a następnie miareczkować dawkę desmopresyny. Codzienne monitorowanie masy ciała jest przydatne w wykrywaniu odwodnienia lub przeciążenia płynami. Zaleca się cotygodniowe oznaczanie stężenia sodu w osoczu w celu monitorowania wahań. Pomimo ścisłego monitorowania trudno jest odtworzyć całodobową kontrolę stężenia sodu w osoczu, która naśladowałaby fizjologiczną osmoregulację. Ze względu na ryzyko gwałtownych wahań stężenia sodu oraz objawy hiponatremii obserwowane przy niskim zakresie referencyjnym, zaleca się utrzymywanie stężenia sodu w wyższym zakresie referencyjnym.
Desmopresyna syntetyczny analog AVP został po raz pierwszy wprowadzony do leczenia DI w 1972 roku (44). Większość pacjentów radzi sobie dobrze na małych dawkach desmopresyny podawanych dwa razy dziennie. Istnieje delikatna równowaga, a poziom sodu może wahać się do bardzo niskich poziomów przy minutowej eskalacji dawki.
Nasz pacjent radził sobie bardzo dobrze na bardzo niskich dawkach podawanych pozajelitowo, o których wiadomo, że mają najmniejszą zmienność w biodostępności (45). Wchłanianie preparatów donosowych jest bardzo zmienne, szczególnie u dzieci lub dorosłych z problemami poznawczymi, ponieważ mogą oni nie wdychać roztworu w spójny sposób (46, 47). Preparaty doustne są dobrym rozwiązaniem, ponieważ zwiększenie dawki prowadzi do dłuższego czasu działania, ale nie ma szczytowego efektu (48-50). Próbowaliśmy tej formy w różnych dawkach 50-100 mcg, ale znaleźliśmy znaczne dzienne różnice w efektach przy tej formie. Desmopresyna podjęzykowa (Minirin Melt) jest dostępna od 2005 roku. Badania farmakologiczne wykazały, że droga podjęzykowa powoduje większą dostępność biologiczną o ~60% w porównaniu z drogą doustną (49, 50). Udoskonalone dawki podjęzykowej desmopresyny można uzyskać poprzez przecięcie każdej tabletki 60 mcg, co pozwala na dostosowanie dawki od 65 do 90 mcg podjęzykowo. Opisano podobny profil farmakokinetyczny takich podzielonych tabletek (51). Wiadomo, że jednoczesne spożywanie pokarmów zmniejsza szybkość i zakres wchłaniania o 40%, dlatego najlepiej jest unikać spożywania pokarmów w ciągu godziny przed i po podaniu podjęzykowych tabletek desmopresyny. Niedawno opisano szczegółowy protokół podawania płynów z codziennym monitorowaniem stężenia sodu przy zastosowaniu desmopresyny podawanej podskórnie w stałej dawce (28), wskazując na trudności w codziennym monitorowaniu. W innym niedawnym opisie przypadku (27) również opisano stosowanie podjęzykowej postaci desmopresyny do ADI w dawkach 60 i 120 mcg na dobę. Zastosowanie podjęzykowej desmopresyny może być przydatną alternatywą w przypadkach, gdy nie można osiągnąć optymalnych efektów przy użyciu innych preparatów. Pacjenci ci wymagają ścisłego monitorowania dobowej masy ciała, objętości moczu i przyjmowania płynów przez całą dobę. W związku z zaburzeniami funkcji poznawczych i pamięci, pacjenci ci zwykle potrzebują opiekuna, który będzie monitorował przyjmowanie płynów, aby upewnić się, że piją wymaganą objętość.
W naszym przeglądzie przypadków, 6 pacjentów miało remisję ADI, z których 2 było związanych z tętniakiem ACOM (15, 16) i 4 było związanych z craniopharyngioma (15, 26). U jednego chorego z neurosarkoidozą uzyskano remisję po zastosowaniu terapii Infliximabem (39). Takie obserwacje mogą sugerować, że zarówno osmoreceptory regulujące pragnienie, jak i ich drogi eferentne wykazują większą neuroplastyczność niż te regulujące produkcję AVP (26).
Podsumowanie
ADI jest niezwykle rzadkim powikłaniem zaburzeń podwzgórzowych, którego skutkiem jest utrata funkcji ośrodka pragnienia. Ze względu na hierarchiczną kontrolę z ośrodka pragnienia, brak pragnienia wiąże się również z utratą regulacji wazopresyny i wielomoczem. Pacjenci cierpiący na ADI muszą być delikatnie zarządzani za pomocą niskich dawek desmopresyny i bilansu płynów. Przy obecnym monitorowaniu i zindywidualizowanym podejściu do opieki nadal nie jest możliwe naśladowanie całodobowej quasi-fizjologicznej osmoregulacji.
Dostępność danych
Wszystkie zestawy danych wygenerowane w tym badaniu są zawarte w manuskrypcie/plikach uzupełniających.
Oświadczenie o etyce
Osoby te wyraziły pisemną świadomą zgodę na publikację wszelkich potencjalnie możliwych do zidentyfikowania obrazów lub danych zawartych w tym artykule.
Zgoda na udział
Uzyskaliśmy pisemne pozwolenie od najbliższej rodziny pacjenta na napisanie i opublikowanie tego manuskryptu.
Wkład autorów
RD był głównym endokrynologiem, który zarządzał równowagą płynów pacjenta, opracował koncepcję, napisał manuskrypt, dokonał przeglądu literatury, pozyskał dane, napisał i przejrzał ostateczną wersję manuskryptu. HC, AC i JH byli rezydentami zaangażowanymi w opiekę nad tym pacjentem i recenzowali ostateczną wersję manuskryptu. HT była anestezjologiem odpowiedzialnym za tego pacjenta podczas fazy intensywnej terapii, opracowała koncepcję i krytycznie oceniła ostateczną wersję manuskryptu. KC była głównym specjalistą rehabilitacji odpowiedzialnym za pacjenta, opracowała koncepcję i dokonała krytycznej oceny ostatecznej wersji manuskryptu. BB opracował koncepcję i krytycznie ocenił ostateczną wersję manuskryptu.
Funding
RD był wspierany częściowo przez Center Grant od National Medical Research Council (NMRC/CG/017/2013) i National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania były prowadzone przy braku jakichkolwiek związków komercyjnych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy pacjentce i jej rodzicom za umożliwienie nam napisania i opublikowania tego manuskryptu.
1. Eisenberg Y, Frohman LA. Adipsic diabetes insipidus: a review. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Zaburzenia regulacji pragnienia. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Proponowany system klasyfikacji dla malformacji tętniczo-żylnych. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. Zastosowanie śpiączki wywołanej barbituranem podczas procedur neurochirurgii mózgowo-naczyniowej: przegląd literatury. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarchical neural architecture underlying thirst regulation. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regulacja pragnienia i uwalniania wazopresyny. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. From sensory circumventricular organs to cerebral cortex: neural pathways controlling thirst and hunger. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Median preoptic nucleus: front i centrum dla regulacji płynów ustrojowych, sodu, temperatury, snu i homeostazy układu krążenia. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunity to the sodium-level sensor in the brain causes essential hypernatremia. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulacja wydzielania wazopresyny i pragnienia w zdrowiu i chorobie. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Neuronalne podstawy pragnienia homeostatycznego i antycypacyjnego. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulacja uwalniania wazopresyny w cukrzycy adyptywnej. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Molecular mechanisms regulating aquaporin-2 in kidney collective duct. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogenous patterns of recovery of thirst in adult patients with adipsic diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Nerkowa adaptacja kompensacyjna do przenoszenia wody u pacjenta z cukrzycą adyptywną po zaklipsowaniu pękniętego tętniaka tętnicy łączącej przedniej. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus after clipping of anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Zespół adyptywny podwzgórza: diagnostyka i postępowanie. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hipodipsowa hipernatremia i cukrzyca po klipsowaniu tętniaka tętnicy łączącej przedniej: wyzwania diagnostyczne i terapeutyczne u amnestycznego pacjenta rehabilitacyjnego. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Przewlekła hipernatremia i hipotermia po krwotoku podpajęczynówkowym. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia i hipotermia po krwotoku podpajęczynówkowym. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Kliniczny wgląd w cukrzycę adyptywną: duża seria przypadków. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Otyłość podwzgórzowa powikłana centralną cukrzycą adyptywną po chirurgicznej resekcji craniopharyngioma. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Severe rhabdomyolysis due to adipsic hypernatremia after craniopharyngioma surgery. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objective assessment of thirst recovery in patients with adipsic diabetes insipidus. Pituitary. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus secondary to craniopharyngioma resection. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Codzienne monitorowanie sodu i protokół przyjmowania płynów: zapobieganie nawracającym hospitalizacjom w cukrzycy adyptywnej. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia u pacjenta z cukrzycą insipidus. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juvenile-onset gout and adipsic diabetes insipidus: opis przypadku i przegląd literatury. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Ciężka hiperosmolarność i hipernatremia u młodej kobiety z adipsy. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipsic diabetes insipidus following pituitary surgery for a macroprolactinoma. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia without hypothalamic lesions accompanied by autoantibodies to subfornical organ. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasia of the corpus callosum associated with adipsic hypernatremia and hypothalamic hypogonadotropinism: a case report and review of the literature. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Chronic hypernatremia from a congenital defect in osmoregulation of thirst and vasopressin. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essential hypernatremia, antidiuretic hormone and neurohypophysin secretion: response to chlorpropamide. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Hipernatremia adyptywna u dwóch sióstr. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. A case of chronic hypernatremia with corpus callosum agenesis. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiologiczna remisja i odzyskanie aprecjacji pragnienia po terapii infliksymabem w cukrzycy adyptywnej wtórnej do neurosarkoidozy. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Narządy okołokomorowe: atlas anatomii porównawczej i unaczynienia. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Water balance disorders after neurosurgery: the triphasic response revisited. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effects of DDAVP, a synthetic analogue of vasopressin, in patients with cranial diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Pharmacokinetics and pharmacodynamics of desmopressin administered orally versus intravenously at daytime versus night-time in healthy men aged 55-70 years. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressin 30 years in clinical use: a safety review. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Leczenie neurohypophyseal diabetes insipidus. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Pharmacokinetics of 1-deamino-8-D-arginine vasopressin after various routes of administration in health volunteers. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Pharmacokinetics, pharmacodynamics, long-term efficacy and safety of oral 1-deamino-8-D-arginine vasopressin in adult patients with central diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasma pharmacokinetics of desmopressin following sublingual administration: an exploratory dose-escalation study in healthy male volunteers. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin lyophilisate for the treatment of central diabetes insipidus: first experience in very young infants. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar
.