Chemia wody 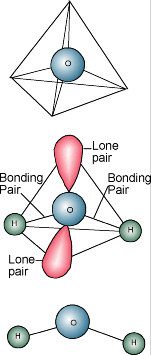 Wiesz zapewne, że chemiczny opis wody to H2O. Cząsteczka wody składa się z jednego atomu tlenu związanego z dwoma atomami wodoru. Atomy wodoru są „przymocowane” do jednej strony atomu tlenu, w wyniku czego cząsteczka wody ma ładunek dodatni po stronie, gdzie są atomy wodoru i ładunek ujemny po drugiej stronie, gdzie jest atom tlenu. Ponieważ przeciwne ładunki elektryczne przyciągają się, cząsteczki wody mają tendencję do przyciągania się nawzajem, co sprawia, że woda jest w pewnym sensie „lepka”. Strona z atomami wodoru (ładunek dodatni) przyciąga stronę z tlenem (ładunek ujemny) innej cząsteczki wody.
Wiesz zapewne, że chemiczny opis wody to H2O. Cząsteczka wody składa się z jednego atomu tlenu związanego z dwoma atomami wodoru. Atomy wodoru są „przymocowane” do jednej strony atomu tlenu, w wyniku czego cząsteczka wody ma ładunek dodatni po stronie, gdzie są atomy wodoru i ładunek ujemny po drugiej stronie, gdzie jest atom tlenu. Ponieważ przeciwne ładunki elektryczne przyciągają się, cząsteczki wody mają tendencję do przyciągania się nawzajem, co sprawia, że woda jest w pewnym sensie „lepka”. Strona z atomami wodoru (ładunek dodatni) przyciąga stronę z tlenem (ładunek ujemny) innej cząsteczki wody.
Wszystkie te cząsteczki wody przyciągające się nawzajem oznaczają, że mają one tendencję do zbijania się w grudki. To dlatego krople wody są, w rzeczywistości, kroplami! Gdyby nie niektóre siły ziemskie, takie jak grawitacja, kropla wody miałaby kształt kuli – idealnej sfery. Nawet jeśli na Ziemi nie tworzy idealnej kuli, powinniśmy się cieszyć, że woda jest lepka.
Woda jest nazywana „uniwersalnym rozpuszczalnikiem”, ponieważ rozpuszcza więcej substancji niż jakakolwiek inna ciecz. Oznacza to, że gdziekolwiek woda płynie, czy to przez ziemię, czy przez nasze ciała, zabiera ze sobą cenne chemikalia, minerały i składniki odżywcze.
Czysta woda ma neutralne pH. Czysta woda ma pH około 7, które nie jest ani kwaśne, ani zasadowe.
Właściwości fizyczne wody:
Woda jest wyjątkowa, ponieważ jest jedyną naturalną substancją, która występuje we wszystkich trzech stanach — ciekłym, stałym (lód) i gazowym (para) — w temperaturach normalnie występujących na Ziemi. Woda na Ziemi jest ciągle w interakcji, zmienia się i jest w ruchu.
 Woda zamarza w 32° Fahrenheita (F) i wrze w 212° F. W rzeczywistości, punkty zamarzania i wrzenia wody są punktem odniesienia, z którym mierzy się temperaturę: 0° w skali Celsjusza to punkt zamarzania wody, a 100° to punkt wrzenia wody. Woda jest niezwykła w tym, że forma stała, lód, jest mniej gęsta niż forma ciekła, dlatego lód unosi się na wodzie.
Woda zamarza w 32° Fahrenheita (F) i wrze w 212° F. W rzeczywistości, punkty zamarzania i wrzenia wody są punktem odniesienia, z którym mierzy się temperaturę: 0° w skali Celsjusza to punkt zamarzania wody, a 100° to punkt wrzenia wody. Woda jest niezwykła w tym, że forma stała, lód, jest mniej gęsta niż forma ciekła, dlatego lód unosi się na wodzie.
Woda ma wysoki współczynnik ciepła właściwego. Oznacza to, że woda może wchłonąć dużo ciepła, zanim zacznie się nagrzewać. To dlatego woda jest cenna dla przemysłu i w chłodnicy twojego samochodu jako płyn chłodzący. Wysoki wskaźnik ciepła właściwego wody pomaga również regulować tempo, w jakim powietrze zmienia temperaturę, dlatego zmiany temperatury między porami roku są stopniowe, a nie nagłe, zwłaszcza w pobliżu oceanów.
Woda ma bardzo wysokie napięcie powierzchniowe. Innymi słowy, woda jest lepka i elastyczna, i ma tendencję do zlepiania się w krople, a nie rozprzestrzeniania się w cienkiej warstwie. Napięcie powierzchniowe jest odpowiedzialne za działanie kapilarne, które pozwala wodzie (i jej rozpuszczonym substancjom) przemieszczać się przez korzenie roślin i przez drobne naczynia krwionośne w naszych ciałach.
Temperatura wody:
Temperatura wody jest ważna nie tylko dla pływaków i rybaków, ale także dla przemysłu, a nawet ryb i alg. Duża ilość wody jest używana do chłodzenia w elektrowniach, które wytwarzają energię elektryczną. Potrzebują one na początku chłodnej wody i zazwyczaj wypuszczają cieplejszą wodę z powrotem do środowiska. Temperatura wypuszczanej wody może mieć wpływ na siedliska w dolnym biegu rzeki. Temperatura może również wpływać na zdolność wody do zatrzymywania tlenu, jak również na zdolność organizmów do opierania się niektórym zanieczyszczeniom.
pH:
pH jest miarą tego, jak kwaśna/zasadowa jest woda. Zakres wynosi od 0 do 14, przy czym 7 jest wartością neutralną. pH poniżej 7 wskazuje na kwasowość, natomiast pH powyżej 7 wskazuje na zasadowość. pH jest tak naprawdę miarą względnej ilości wolnych jonów wodorowych i hydroksylowych w wodzie. Woda, która ma więcej wolnych jonów wodorowych jest kwaśna, podczas gdy woda, która ma więcej wolnych jonów hydroksylowych jest zasadowa. Ponieważ na pH mogą wpływać substancje chemiczne zawarte w wodzie, pH jest ważnym wskaźnikiem wody, która ulega zmianom chemicznym. pH jest podawane w „jednostkach logarytmicznych”, podobnie jak skala Richtera, która mierzy trzęsienia ziemi. Każda liczba reprezentuje 10-krotną zmianę kwasowości/zasadowości wody. Woda o pH 5 jest dziesięć razy bardziej kwaśna niż woda o pH 6.
Zanieczyszczenia mogą zmienić pH wody, co z kolei może zaszkodzić zwierzętom i roślinom żyjącym w wodzie. Na przykład, woda pochodząca z opuszczonej kopalni węgla może mieć pH 2, co jest bardzo kwaśne i na pewno wpłynie na każdą rybę na tyle szalony, aby spróbować żyć w nim! Używając skali logarytmicznej, ta woda z kopalni byłaby 100 000 razy bardziej kwaśna niż woda neutralna – więc trzymaj się z dala od opuszczonych kopalni.
Przewodnictwo właściwe:
Przewodnictwo właściwe jest miarą zdolności wody do przewodzenia prądu elektrycznego. Jest ona w dużym stopniu zależna od ilości rozpuszczonych substancji stałych (takich jak sól) w wodzie. Czysta woda, taka jak woda destylowana, będzie miała bardzo niską przewodność właściwą, a woda morska będzie miała wysoką przewodność właściwą. Woda deszczowa często rozpuszcza unoszące się w powietrzu gazy i pył, a zatem często ma wyższą przewodność właściwą niż woda destylowana. Przewodność właściwa jest ważną miarą jakości wody, ponieważ daje dobre pojęcie o ilości rozpuszczonego materiału w wodzie.
Prawdopodobnie w szkole zrobiłeś eksperyment, w którym podłączasz baterię do żarówki i prowadzisz dwa przewody z baterii do zlewki z wodą. Kiedy przewody są włożone do zlewki z wodą destylowaną, światło nie zapala się. Ale żarówka zapala się, gdy zlewka zawiera słoną wodę (salinę). W słonej wodzie sól rozpuściła się, uwalniając wolne elektrony, a woda będzie przewodzić prąd elektryczny.
Turbidity:
Turbidity is a measure of the cloudiness of water. Mierzy się ją przepuszczając wiązkę światła przez wodę i obserwując jak wiele odbija się od cząsteczek w wodzie. Zmętnienie wody jest spowodowane przez materiał, taki jak brud i resztki liści, który jest zawieszony (pływa) w wodzie. Krystalicznie czysta woda, taka jak w jeziorze Tahoe (gdzie ciężko się pracuje, aby nie dopuścić do przedostania się osadów do jeziora) ma bardzo niską mętność. Ale spójrz na rzekę po burzy – prawdopodobnie jest brązowa. Widać w niej całą zawieszoną w wodzie glebę. Na szczęście dla nas, materiały, które powodują mętność wody pitnej albo się osadzają, albo są filtrowane zanim woda trafi do naszej szklanki w domu. Mętność jest mierzona w nefelometrycznych jednostkach mętności (NTU).
Tlen rozpuszczony:
Ale cząsteczki wody zawierają atom tlenu, nie jest on potrzebny organizmom wodnym żyjącym w naszych naturalnych wodach. Niewielka ilość tlenu, do około dziesięciu molekuł tlenu na milion wody, jest w rzeczywistości rozpuszczona w wodzie. Ten rozpuszczony tlen jest wdychany przez ryby i zooplankton i jest im potrzebny do przeżycia.
Szybko poruszająca się woda, taka jak w górskim strumieniu lub dużej rzece, ma tendencję do zawierania dużej ilości rozpuszczonego tlenu, podczas gdy woda stojąca zawiera go niewiele. Proces, w którym bakterie w wodzie pomagają materii organicznej, takiej jak ta, która pochodzi z oczyszczalni ścieków, rozkłada się zużywając tlen. Tak więc nadmiar materii organicznej w naszych jeziorach i rzekach może spowodować sytuację niedoboru tlenu. Życie wodne może mieć trudny czas w stagnującej wodzie, w której znajduje się dużo gnijącego materiału organicznego, zwłaszcza latem, kiedy poziom rozpuszczonego tlenu jest sezonowo niski.
Twardość:
Ilość rozpuszczonego wapnia i magnezu w wodzie określa jej „twardość”. Twardość wody różni się w całych Stanach Zjednoczonych. Jeśli mieszkasz na obszarze, gdzie woda jest „miękka”, to być może nigdy nawet nie słyszałeś o twardości wody. Ale jeśli mieszkasz na Florydzie, w Nowym Meksyku, Arizonie, Utah, Wyoming, Nebrasce, Południowej Dakocie, Iowa, Wisconsin lub Indianie, gdzie woda jest stosunkowo twarda, możesz zauważyć, że trudno jest uzyskać pianę podczas mycia rąk lub ubrań. Ponadto zakłady przemysłowe w Twojej okolicy mogą być zmuszone do wydawania pieniędzy na zmiękczanie wody, ponieważ twarda woda może uszkodzić sprzęt. Twarda woda może nawet skrócić żywotność tkanin i ubrań! Czy to oznacza, że studenci, którzy mieszkają na obszarach z twardą wodą, nie nadążają za najnowszą modą, ponieważ ich ubrania szybciej się zużywają?
Osady zawieszone:
Osady zawieszone to ilość gleby poruszającej się w strumieniu. Jest ona w dużym stopniu zależna od prędkości przepływu wody, ponieważ szybko płynąca woda może podnieść i zawiesić więcej gleby niż spokojna woda. Podczas burz gleba jest zmywana z brzegów strumienia do strumienia. Ilość, która wpływa do strumienia zależy od rodzaju ziemi w zlewni rzeki i roślinności otaczającej rzekę.
Jeśli ziemia jest zakłócona wzdłuż strumienia i środki ochrony nie są podejmowane, to nadmiar osadów może zaszkodzić jakości wody w strumieniu. Prawdopodobnie widziałeś te krótkie, plastikowe płoty, które budowniczowie stawiają na krawędziach nieruchomości, które rozwijają. Te płoty muł ma uwięzić osad podczas burzy i utrzymać go z mycia do strumienia, jak nadmiar osadów może zaszkodzić strumieni, rzek, jezior i zbiorników.
Osady przychodzące do zbiornika jest zawsze niepokój, raz wchodzi nie może się wydostać – większość z nich będzie osiadać na dnie. Zbiorniki mogą „zamulać się”, jeśli dostanie się do nich zbyt dużo osadów. Objętość zbiornika jest zmniejszona, co skutkuje mniejszą powierzchnią dla żeglarstwa, wędkarstwa i rekreacji, jak również zmniejszeniem możliwości wytwarzania energii przez elektrownię w zaporze.
Geochemia roztworu wodnego:
Spójrz na schemat cyklu hydrogeochemicznego.
- Kwas = substancja zawierająca wodór, która po rozpuszczeniu w wodzie daje wolny wodór (H + )
- Zasada = substancja zawierająca grupę OH, która po rozpuszczeniu w wodzie daje wolny (OH – )
-
Roztwór kwaśny to taki, który zawiera nadmiar wolnego H + , a zasadowy to taki, który zawiera nadmiar wolnego OH – . Reakcję między kwasem a zasadą nazywa się zwykle zobojętnianiem.
Na przykład:
-
HCl (kwas) + NaOH (zasada) ==> H 2 O + NaCl
które ulegają dysocjacji na jony:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - czyli Na + i Cl – pozostają bez zmian.
- pH = odwrotność log stężenia (aktywności) wolnego H + , czyli pH = -log
-
Woda dysocjuje na H + i OH – ;
-
stała dysocjacji wynosi: K wody = =10 -14
- Zatem w kilogramie obojętnego roztworu w temperaturze standardowej 25°C musi być po 10 -7 moli H+ i OH -. Jeden mol to 6,023 x 10 23 atomy (lub cząsteczki), a H 2 O ma masę cząsteczkową 18 gramów na mol. Jeden kilogram wody ma około 1000/18 = 55,6 mola wody lub około 3,35 x 10 25 atomów tlenu i około dwa razy tyle (6,7 x 10 25 atomów) H + (ilość wolnego H + lub wolnego OH – jest stosunkowo niewielka w porównaniu z ilością niezdysocjowanego H 2 O).
- pH waha się w 25°C od 0 do 14; pH < 7 = roztwór kwaśny; pH > 7 = roztwór zasadowy. Jeśli doda się HCl lub inny kwas to pH spada; jeśli doda się NaOH lub inną zasadę to pH wzrasta.
- pH wzrasta, ponieważ kwas węglowy (słaby kwas) dysocjuje: Kiedy dwutlenek węgla łączy się z wodą, tak jak to się dzieje w atmosferze podczas spalania paliw kopalnych, powstaje kwas węglowy: H 2 O + CO 2 ==> H 2 CO 3 . Wolne H + są udostępniane podczas kolejnych dysocjacji:
-
H 2 CO 3 ==> H + + HCO 3- kwasu węglowego na wodorowęglan, zachodzi przy pH ~6,4
-
HCO 3 ==> H + + CO 32- wodorowęglanu na węglan, zachodzi przy pH ~10.3
Pamiętajmy, że wolny H + jest dostępny tylko w środowisku kwaśnym, czyli przy pH < ~7. Dysocjacja wodorowęglanu do węglanu zachodzi, gdy w układzie jest za dużo OH – i H + jest „uwalniany”, aby zrównoważyć zasadę.
- Rozpuszczone kationy i aniony w wodzie
Kationy = donory elektronów, dodatnio naładowane: Na + , K + , Mg ++ , Ca ++ , Fe ++ lub Fe +++ , Mn ++ , Al +++
Aniony = akceptory elektronów, ujemnie naładowane: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metale = zachowują się jak kationy głównie: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, itd.
- Analizy wody – potrzeba równowagi kationowo-anionowej
milirównoważnik (MEQ) = molowy równoważnik ładunku lub anionu lub kationu, miara całkowitego ładunku z powodu danego jonu rozpuszczonego w roztworze. Zacznij od stężenia, podziel przez masę molową, pomnóż przez ładunek: XX mg/L / MW x CHG = MEQ
Przykład: NaCl w roztworze, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Tak więc, jeśli całkowite MEQ kationów i anionów nie są zrównoważone, w analizie występuje pewien błąd.