INTRODUCTION
Heterozygotyczna hipercholesterolemia rodzinna (FH) jest częstym zaburzeniem genetycznym związanym z przedwczesną miażdżycową chorobą układu sercowo-naczyniowego (ASCVD). Dzieci z nieleczoną FH są narażone na zwiększone ryzyko wystąpienia przedwczesnej ASCVD po 20 roku życia.1 Ciężkie podwyższenie poziomu cholesterolu lipoprotein o małej gęstości (LDL-C) rozpoczyna się już u płodu i prowadzi do stałego narażenia ściany tętnicy na działanie LDL-C, co przyspiesza odkładanie się cholesterolu i stan zapalny naczyń oraz predysponuje do wczesnej inicjacji miażdżycy, szczególnie w tętnicach wieńcowych i aorcie.
Statyny i inne terapie obniżające stężenie lipidów (LLTs) skutecznie obniżają stężenie LDL-C, są bezpieczne u dzieci i młodzieży oraz przywracają funkcję śródbłonka w młodym wieku.2-4 Ostatnio zaproponowano5,6 powszechne badania przesiewowe dzieci od 2. roku życia i przed 8. rokiem życia w celu wykrycia osób wymagających leczenia. Podejście to jest jednak oparte na rozważaniach teoretycznych i nie zostało udowodnione w warunkach rzeczywistych.
Niemniej jednak niewiele wiadomo na temat charakterystyki pacjentów z FH w wieku poniżej 18 lat, LLT stosowanej u tych pacjentów oraz celów lipidowych osiąganych w warunkach rzeczywistych. Deficyt informacji jest jeszcze większy w przypadku danych dotyczących obserwacji. Krajowe rejestry mogą być wykorzystane do uzyskania tych kluczowych informacji, które są niezbędne do poprawy modeli opieki nad pacjentami z FH, protokołów terapeutycznych i polityki zdrowotnej.7,8 Badanie SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) zostało zaprojektowane w celu poprawy wglądu w czynniki prognostyczne i mechanizmy wpływające na rozwój ASCVD i śmiertelność w populacji FH.
Naszym celem była analiza charakterystyki pacjentów oraz ocena celów LLT i lipidowych przy włączeniu do badania i w trakcie obserwacji pacjentów z FH w wieku poniżej 18 lat włączonych do badania SAFEHEART oraz określenie czynników prognozujących prawdopodobieństwo osiągnięcia tych celów.
METODYProjekt badania i populacja
SAFEHEART jest otwartym, wieloośrodkowym, ogólnokrajowym, długoterminowym, prospektywnym badaniem kohortowym w molekularnie zdefiniowanej populacji FH w Hiszpanii. Rekrutacja uczestników z rodzin z FH rozpoczęła się w 2004 roku i nadal trwa. Kryteria włączenia do badania obejmowały przypadki indeksowe z genetycznym rozpoznaniem FH oraz ich krewnych w wieku powyżej 15 lat z genetycznym rozpoznaniem FH, jak również ich krewnych bez genetycznego rozpoznania FH (grupa kontrolna). Niemniej jednak do badania włączono również osoby poniżej 15. roku życia, na prośbę rodziców. Badanie zostało zatwierdzone przez lokalne komisje etyczne. Wszystkie kwalifikujące się osoby i/lub co najmniej 1 z ich rodziców lub opiekunów prawnych wyrazili pisemną, świadomą zgodę. Ośrodek koordynujący z siedzibą w Madrycie (Hiszpania) był odpowiedzialny za prowadzenie obserwacji uczestników. Z pacjentami i/lub ich rodzicami kontaktowano się co roku za pomocą standaryzowanej rozmowy telefonicznej w celu zarejestrowania istotnych zmian w stylu życia i przyjmowanych lekach oraz wszelkich zdarzeń sercowo-naczyniowych lub innych problemów medycznych. Lekarze uczestniczący w badaniu, którzy zapisywali pacjentów i ich rodziny do tego rejestru, zostali przeszkoleni, a wytyczne dotyczące najlepszych praktyk były przekazywane na corocznych spotkaniach, w których uczestniczyli lekarze będący ekspertami w tej dziedzinie; ponadto stosowano program oparty na technologii elektronicznej i porady telefoniczne, a w razie potrzeby wdrożono internetowy program szkoleniowy w celu dalszego wsparcia zarządzania. Decyzje dotyczące leczenia były podejmowane wyłącznie przez lekarza każdego pacjenta.
Pomiary kliniczne i laboratoryjne
Charakterystykę demograficzną i kliniczną rejestrowano zgodnie z opisem w innym miejscu.9 Próbki krwi żylnej pobierano po 12 godzinach na czczo. Próbki surowicy, osocza i DNA zostały podzielone na mniejsze części i zachowane w temperaturze -80°C. Poziomy cholesterolu całkowitego, triglicerydów i cholesterolu lipoprotein o dużej gęstości (HDL-C) w surowicy zmierzono w centralnym laboratorium przy użyciu metod enzymatycznych. Stężenie LDL-C w surowicy obliczano za pomocą wzoru Friedewalda. DNA izolowano z krwi pełnej przy użyciu standardowych metod, a FH diagnozowano genetycznie przy użyciu mikromacierzy DNA.10 Cele LDL-C określono zgodnie z najnowszymi zaleceniami i celami. Cholesterol lipoprotein o małej gęstości
mg/dl był celem podstawowym.11 Alternatywny cel dla pacjentów w wieku poniżej 14 lat obejmował stężenie LDL-C mg/dl przy braku innych czynników ryzyka sercowo-naczyniowego (palenie tytoniu, HDL-C mg/dl, lipoproteina (a) > 50mg/dl lub LDL-C > 250mg/dl) lub przedwczesnej choroby sercowo-naczyniowej u przodków lub dziadków.6 Przedwczesna znana ASCVD została zdefiniowana jako wystąpienie pierwszego zdarzenia przed 55 rokiem życia u mężczyzn i przed 65 rokiem życia u kobiet.Klasyfikacja terapii obniżającej poziom lipidów
Maksymalną dawkę statyny zdefiniowano jako atorwastatynę 40-80mg/d lub rosuwastatynę 20-40mg/d, które uznano za dawki statyny o wysokiej intensywności. Maksymalna terapia skojarzona została zdefiniowana jako maksymalna dawka statyny plus ezetymib 10mg/d. Maksymalna dawka LLT została zdefiniowana jako każda dawka LLT, która powinna spowodować co najmniej 50% redukcję wyjściowego stężenia LDL-C: simwastatyna 20, 40, lub 80mg/d plus ezetymib 10mg/d; pravastatyna 40mg/d w połączeniu z ezetymibem 10mg/d; fluwastatyna 80mg/d plus ezetymib 10mg/d; atorwastatyna 40 lub 80mg/d z ezetymibem 10mg/d lub bez niego; atorwastatyna 10 lub 20mg/d plus ezetymib 10mg/d; rosuwastatyna 20 lub 40mg/d z ezetymibem 10mg/d lub bez niego; rosuwastatyna 10mg/d plus ezetymib 10mg/d; oraz pitawastatyna 4mg/d w połączeniu z ezetymibem 10mg/d.12,13
Analiza genetyczna
Mutacje receptora cholesterolu lipoprotein o małej gęstości (LDLR) zostały sklasyfikowane zgodnie z ich znanym wpływem na funkcję białka receptora LDL jako mutacje zerowe (receptor-negatywny) i wadliwe (receptor-defektywny), jak opisano wcześniej.14 Warianty prowadzące do całkowitego braku lub obcięcia białka (utrata funkcji) wykazane przez analizę funkcjonalną in vitro lub analizę symulacji komputerowej zostały sklasyfikowane jako receptor-negatywny. Warianty te obejmowały następujące: a) mutacje punktowe powodujące przedwczesny kodon stop; b) mutacje missense wpływające na piąte bogate w cysteinę powtórzenie w domenie wiążącej ligand genu receptora LDL-C (mutacja klasy 2A); c) małe delecje lub insercje powodujące przesunięcie ramki i przedwczesny kodon stop; oraz d) duże rearanżacje. Mutacje defektujące receptor to pozostałe mutacje punktowe inframe oraz małe delecje i insercje inframe. Wszystkie mutacje bez znanej analizy funkcjonalności za pomocą badań in vitro lub komputerowej analizy symulacyjnej zostały sklasyfikowane jako „nieznana funkcjonalność”, ponieważ nie mogliśmy być pewni, czy wpływ na receptor był negatywny czy wadliwy; jednak zostały one uznane za patogenne, ponieważ wszystkie osoby niosące 1 z tych mutacji miały hipercholesterolemię, podczas gdy krewni bez mutacji mieli normalne poziomy cholesterolu.14
Analiza statystyczna
Analizy statystyczne zostały wykonane przy użyciu SPSS wersja 18.0 (SPSS Inc, Chicago, Illinois, Stany Zjednoczone). Normalność rozkładu zmiennych analizowano za pomocą testu Kołmogorowa-Smirnowa. Dane ilościowe wyrażono jako medianę i zakres międzykwartylowy (IQR), a dane jakościowe jako liczbę bezwzględną i odsetek. Zdefiniowano dwie populacje: populację przy wejściu (n = 241) i populację przy obserwacji (inaczej zwaną kohortą), która obejmowała tych pacjentów, którzy mieli pełny profil lipidowy osocza w obserwacji (n = 217). Wszystkie porównania między badaniem wstępnym a badaniem kontrolnym przeprowadzono w badaniu kohortowym. Porównania częstości między zmiennymi jakościowymi przeprowadzono za pomocą testu chi-squared. Zmiany w zmiennych binarnych analizowano za pomocą testu McNemara. Wartości mediany zmiennych ilościowych porównywano nieparametrycznym testem Manna-Whitneya lub sparowanym testem rang Wilcoxona. W badaniu kohortowym przeprowadzono analizę binarnej regresji logistycznej w przód w celu określenia zmiennych związanych ze stosowaniem statyn. Uwzględniono zmienne, które były istotne statystycznie w analizach jednoczynnikowych, a także predyktory a priori i czynniki zakłócające: wiek, płeć i kontynuację leczenia w ośrodku podstawowym/specjalistycznym. W celu określenia zmiennych związanych z osiągnięciem stężenia LDL-C
mg/dL przeprowadzono kolejną analizę binarnej regresji logistycznej w badaniu kohortowym, z wyłączeniem tych pacjentów, którzy osiągnęli cel na początku badania. Uwzględniono zmienne, które były istotne statystycznie w analizach jednoczynnikowych, a także predyktory a priori i czynniki zakłócające: wiek, płeć, rodzaj mutacji (zerowa lub wadliwa), stosowanie ezetymibu oraz obserwację w ośrodku podstawowym/specjalistycznym. Różnice uznano za istotne statystycznie przy P WYNIKI
Do chwili obecnej do rejestru SAFEHEART zapisano 4141 uczestników; 392 z nich jest młodszych niż 18 lat. Spośród nich u 241 potwierdzono molekularnie FH, a u 217 wykonano pełny profil lipidowy (90,0%) (ryc. 1). Dwudziestu czterech pacjentów zostało pominiętych w analizie z powodu braku kompletnego profilu lipidowego w czasie obserwacji. U 40 pacjentów (18,4%) obserwacja odbywała się w placówkach podstawowej opieki zdrowotnej. Mediana czasu obserwacji wyniosła 4,69 roku (IQR, 2,48-6,38 roku).
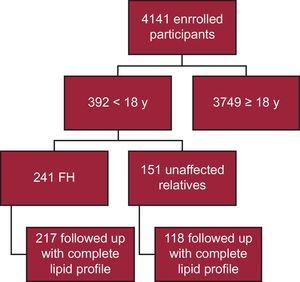
Schematyczny schemat przebiegu badania. FH, familial hypercholesterolemia.
Przy zapisie do badania (populacja at-entry) 129 pacjentów z FH (53,5%) było mężczyznami. Mediana wieku wynosiła 15,0 lat (IQR, 14,0-16,0 lat). Dwóch najmłodszych pacjentów miało 8 lat. U żadnego pacjenta nie stwierdzono ASCVD w wywiadzie, a przedwczesna rodzinna ASCVD występowała u 40 (16,6%). Charakterystykę wyjściową przedstawiono w tabeli 1. Porównanie charakterystyki wyjściowej w momencie włączenia do badania pomiędzy pacjentami z kohorty a tymi, którzy nie byli obserwowani, przedstawiono w tabeli 1. Nie stwierdzono istotnych różnic między tymi dwiema grupami. Żaden pacjent nie miał w wywiadzie ASCVD, nadciśnienia tętniczego ani cukrzycy. Większy odsetek osób, u których nie wykonano badań kontrolnych, był leczony w ramach podstawowej opieki zdrowotnej, choć różnica ta nie była istotna statystycznie. W kohorcie stwierdzono istotne zmniejszenie stężenia w osoczu cholesterolu całkowitego, LDL-C, triglicerydów i nie-HDL-C; zaobserwowano również istotne zwiększenie stężenia HDL-C w okresie obserwacji (tab. 2).
Podstawowa charakterystyka populacji rozpoczynającej leczenie
| pacjenci z FH z obserwacją Mediana (IQR)/nr. (%) |
Pacjenci z FH bez obserwacji Mediana (IQR)/no. (%) |
P | |
|---|---|---|---|
| Liczba | 217 | 24 | |
| Seks (mężczyzna) | 117 (53,9%) | 12 (50%) | .72 |
| Wiek, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Przedwczesne znane ASCVD | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Czynny palacz tytoniu | 13 (6,0%) | 2 (8,3%) | .65 |
| Zaskórniki | 1 (0,5%) | 0 (0,0%) | .99 |
| Corneal arcus | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Obwód talii, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Cholesterol całkowity, mg/dl | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dL | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Zarządzane w warunkach opieki podstawowej | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, miażdżycowa choroba sercowo-naczyniowa; BMI, wskaźnik masy ciała; FH, rodzinna hipercholesterolemia; HDL-C, cholesterol lipoprotein o dużej gęstości; LDL-C, cholesterol lipoprotein o małej gęstości; Lp (a), lipoproteina (a); IQR, zakres międzykwartylowy; TG, triglicerydy.
Stężenia lipidów i lipoprotein we krwi (kohorta)
| Cohorta przy wejściu | Cohorta przy follow-up | P | |
|---|---|---|---|
| Cholesterol całkowity, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dL | 62,0 (49,0-80,2) | 70,0 (54,5-91.0) | .004 |
| Non-HDL-C, mg/dL | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, cholesterol lipoprotein o dużej gęstości; LDL-C, cholesterol lipoprotein o małej gęstości; TG, triglicerydy.
Wartości są medianą (zakres międzykwartylowy).
Mutacje funkcjonalne
Zidentyfikowaliśmy 212 pacjentów z mutacją w genach receptora LDL-C (97,7%) i 5 pacjentów z mutacją w genach apolipoproteiny B (2,3%). Spośród mutacji w genach receptora LDL-C, 95 (43,8%) sklasyfikowano jako mutacje zerowe, 92 (42,4%) jako mutacje defektywne, a 25 (11,5%) jako mutacje o nieznanej funkcjonalności.
Lipid-lowering Therapy and Goal Attainment
Tabela 3 przedstawia stosowanie różnych schematów LLT przy wejściu do badania i w trakcie obserwacji. Wyniki wskazują na znaczący wzrost stosowania statyn (44,2% na wejściu i 68,2% w trakcie obserwacji), ezetymibu (8,7% na wejściu i 15,2% w trakcie obserwacji), maksymalnej dawki statyny (3,3% na wejściu i 13,9% w trakcie obserwacji) oraz maksymalnego LLT (7,9% na wejściu i 23,6% w trakcie obserwacji). Najczęściej przepisywaną statyną na początku (25,3%) i po zakończeniu badania (30.5%) była atorwastatyna. Zwiększyła się częstość przepisywania rosuwastatyny (z 6,0% w momencie włączenia do badania do 20,3% w trakcie obserwacji). Mediana czasu trwania terapii statynami wynosiła 7,0 lat (5,0 do 9,0 lat). Wiek menarche wynosił 12,0 lat (12,0 do 13,0 lat) u dziewcząt leczonych statynami i 12,0 lat (11,0 do 13,0 lat) u dziewcząt nieleczonych statynami (P = .77). Nie zaobserwowano zwiększenia stężenia transaminaz wątrobowych ani fosfokinazy kreatynowej. Fibraty i sekwestranty kwasów żółciowych były stosowane tylko u 15 pacjentów w momencie włączenia do badania (7,0%) i 3 pacjentów w trakcie obserwacji (1,5%). Monoterapię ezetymibem bez statyny stosowano u 18 pacjentów w momencie włączenia do badania (8,3%) i u 24 pacjentów w trakcie obserwacji (11,1%). Jeśli chodzi o przestrzeganie zaleceń terapeutycznych, 10 pacjentów (4,6%) zgłosiło, że nie przyjmowało leków przynajmniej 1 dzień w miesiącu podczas obserwacji. W analizie wielowariantowej żadna zmienna nie była niezależnie związana ze stosowaniem statyny.
Lipid-lowering Therapies and LDL-C Goal Achievement (Cohort)
| At entry-/follow-up- | At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ | P | |
|---|---|---|---|---|---|
| Pacjenci przyjmujący statyny | 60 (27.6%) | 61 (28.1%) | 9 (4.1%) | 87 (40.1%) | .001 |
| Pacjenci na maksymalnej dawce statyny | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Pacjenci przyjmujący ezetymib | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Pacjenci przyjmujący maksymalną terapię skojarzoną | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Pacjenci na maksymalnym LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12.9%) | .001 |
| LDL-C | 44 (20.3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, cholesterol lipoprotein o małej gęstości; LLT, lipid-lowering therapy.
Values are n (%). – = nie występuje; + = występuje.
See text for LLT classification.
Stężenie LDL-C we krwi zmniejszyło się średnio o 12,5%, osiągając medianę wartości 138,0mg/dL w okresie obserwacji. Cele stężenia cholesterolu lipoprotein o małej gęstości, określone w najnowszych międzynarodowych zaleceniach dotyczących FH, zostały osiągnięte u 20,3% na początku i 41,5% w trakcie obserwacji (Tabela 3 i Rycina 2). Gdy rozważano alternatywny cel LDL-C
mg/dL dla pacjentów w wieku poniżej 14 lat, 8 z 48 pacjentów (16,7%) i 1 z 6 pacjentów (16,7%) osiągnęło ten cel odpowiednio przy włączeniu i w trakcie obserwacji. Jedyną zmienną niezależnie związaną z osiągnięciem celu w zakresie LDL-C w analizie wielowariantowej było stosowanie statyny (iloraz szans, 13,83; 95% przedział ufności, 2,98-64,15). Rodzaj dostawcy usług medycznych (lekarz specjalista lub lekarz podstawowej opieki zdrowotnej), wiek, płeć, poziom lipoproteiny (a) i rodzaj mutacji nie były związane z osiągnięciem celu LDL-C.
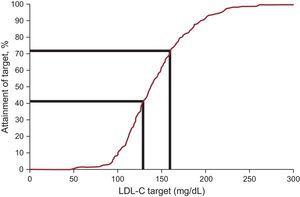
Cele leczenia u pacjentów z hipercholesterolemią rodzinną młodszych niż 18 lat: odsetek pacjentów osiągających docelowy poziom LDL-C. LDL-C, cholesterol lipoprotein o małej gęstości.
DISCUSSION
W tym badaniu opisujemy charakterystykę, stosowanie LLT i osiąganie celu LDL-C w podłużnej kohorcie molekularnie zdefiniowanych pacjentów z FH w wieku poniżej 18 lat zapisanych do rejestru SAFEHEART. Ten unikalny rejestr pacjentów z FH opiera się na danych uzyskanych z rzeczywistego życia w Hiszpanii, zarówno w placówkach specjalistycznych, jak i podstawowej opieki zdrowotnej. Nasze wyniki pokazują, że docelowe stężenie LDL-C
mg/dl zostało osiągnięte tylko u 20,3% pacjentów w momencie włączenia do badania i u 41,5% w czasie obserwacji, przy czym 68,2% pacjentów otrzymywało LLT. Stosowanie statyny było jedynym czynnikiem niezależnie związanym z osiągnięciem celu LDL-C. Zgodnie z naszą wiedzą w żadnej innej pracy nie wykazano osiągnięcia celu u pacjentów z FH w wieku poniżej 18 lat, a niniejsze badanie jest pierwszym, w którym opisano to w dużej populacji.
Ostatnio w rejestrze brytyjskim15 przeanalizowano 207 dzieci z FH, identyfikując mutacje u 64% dzieci i stwierdzając, że 48% z nich przyjmowało LLT; osiągnięto 35% redukcję LDL-C. Autorzy nie podali jednak wyników dotyczących osiągnięcia celu. W innym doniesieniu, w którym analizowano małą próbę badanych (n = 89), wykazano 43-procentową redukcję LDL-C w obserwacji długoterminowej.16 Ta większa redukcja wynika prawdopodobnie z częstszego stosowania terapii skojarzonej (56%). Nie wykazano obiektywnych wyników. W innym retrospektywnym artykule dotyczącym 207 pacjentów w Holandii tylko 26% pacjentów przyjmowało LLT i ponownie nie przedstawiono wyników dotyczących osiągnięcia celu w zakresie LDL-C.17
W tym badaniu podłużnym wykazano, że stężenie LDL-C u pacjentów z FH w wieku poniżej 18 lat może się zmieniać w czasie dzięki modyfikacji LLT i edukacji lekarzy. Odsetek pacjentów przyjmujących statyny, maksymalna dawka statyny i maksymalne LLT istotnie wzrosły podczas obserwacji. Co ciekawe, nasze dane wskazują, że nasza kohorta nie jest tendencyjna, ponieważ nie było istotnych statystycznie różnic między pacjentami, którzy nie byli obserwowani, a kohortą.
Wczesne rozpoznanie i leczenie FH jest niezbędne, szczególnie u dzieci i młodzieży, aby zapobiec rozwojowi ASCVD w wieku dorosłym. Warto przeprowadzać badania przesiewowe w kierunku FH u dzieci i należy je wykonywać przed ukończeniem 8 roku życia, ponieważ dzieci z hipercholesterolemią są w grupie zwiększonego ryzyka przedwczesnego wystąpienia ASCVD. Ponadto, badania przesiewowe mogą zidentyfikować osoby z grupy najwyższego ryzyka i skłonić do rozpoczęcia LLT, która, jak wykazano, skutecznie odwraca proces miażdżycowy i zmniejsza ryzyko ASCVD. Dzieci z FH zazwyczaj nie mają klinicznej postaci ASCVD. Niemniej jednak istnienie przyszłego ryzyka przemawia za stosowaniem LLT, przy czym statyny stanowią podstawę leczenia FH.18
Bezpieczeństwo i tolerancja LLT u dzieci z FH zawsze budzą kontrowersje, chociaż według doniesień są one podobne do tych występujących u dorosłych.5,19,20 Ostatnio Ramaswami i wsp.15 nie zgłosili żadnych zastrzeżeń dotyczących bezpieczeństwa, podobnie jak nasze wyniki. Mimo to zaleca się ścisły nadzór, zwłaszcza u chorych otrzymujących większe dawki statyn. Młodociane dziewczęta należy również pouczyć o konieczności przerwania leczenia statynami w przypadku rozważania zajścia w ciążę. Mimo że potrzeba więcej danych na temat bezpieczeństwa u dzieci poddanych długotrwałemu leczeniu LLT, ostatnie prace dotyczące długoterminowej obserwacji wykazały doskonały profil bezpieczeństwa.21 Stwierdzenie to jest pośrednio poparte naszymi danymi, ponieważ duży odsetek pacjentów rozpoczął LLT w trakcie obserwacji i niewiele osób zrezygnowało z leczenia. Nasze wyniki wyraźnie wskazują na zwiększony odsetek pacjentów stosujących statyny, dużą dawkę statyny i maksymalną LLT, przy niskim odsetku pacjentów rezygnujących z leku. Dane te potwierdzają bezpieczeństwo, stosowanie i tolerancję statyn, nawet w dużych dawkach, u pacjentów z FH w wieku poniżej 18 lat.22 Ponadto nasze wyniki są zgodne z wcześniejszymi doniesieniami wskazującymi na brak wpływu na dojrzewanie płciowe.23 Wszystkie te wyniki potwierdzają koncepcję „im młodsi, tym lepsi” dotyczącą idealnego wieku do rozpoczęcia stosowania statyn u tych młodych pacjentów z FH.23
Nasze wyniki wskazują na dużą liczbę pacjentów z FH w wieku poniżej 18 lat i, zgodnie z wcześniejszymi badaniami,15,16 sugerują gotowość dorosłych pacjentów z FH do włączenia członków najbliższej rodziny w badania przesiewowe i działania rejestracyjne. Fakt ten odzwierciedla powagę, z jaką ci pacjenci traktują swój problem, oraz wpływ, jaki porady lekarzy mogą mieć na zmianę ich stylu życia. Taka postawa u dorosłych pacjentów stanowi podstawę zdrowego stylu życia u ich krewnych.24
Ale najczęstszym celem dla pacjentów z FH poniżej 18 roku życia jest poziom LDL-C poniżej 130mg/dL, alternatywne podejście polegające na oznaczaniu LDL-C mg/dL może być stosowane u tych pacjentów poniżej 14 roku życia, niepalących, z HDL-C ≥ 40mg/dL, lipoproteiną (a) mg/dL, LDL-C mg/dL i bez przedwczesnej choroby sercowo-naczyniowej u przodków lub dziadków.6 Inne najnowsze wytyczne zalecają zmniejszenie stężenia LDL-C o 50% w stosunku do wartości przed leczeniem, ale w przypadku dzieci w wieku ≥ 10 lat, zwłaszcza jeśli występują dodatkowe czynniki ryzyka sercowo-naczyniowego, w tym podwyższone stężenie lipoproteiny (a), docelowa wartość LDL-C powinna wynosić mg/dl.11 Nasze wyniki wskazują również na trudności, jakie napotykają ci pacjenci w osiągnięciu docelowych wartości stężenia lipidów.25 Co więcej, osiągnięcie docelowej wartości LDL-C było podobne niezależnie od tego, czy pacjenci byli leczeni przez specjalistów czy lekarzy podstawowej opieki zdrowotnej. W związku z tym możliwe jest osiągnięcie takiego poziomu opieki nad pacjentami pediatrycznymi z FH w warunkach podstawowej opieki zdrowotnej, który byłby porównywalny z poziomem osiąganym w ramach opieki specjalistycznej. Aby osiągnąć ten cel, należy podkreślić wsparcie, jakie klinicyści otrzymują za pośrednictwem rejestrów i specjalnych programów szkoleniowych. Rejestry mogą zoptymalizować postępowanie z pacjentami z FH w wieku poniżej 18 lat, umożliwiając integrację opieki podstawowej i specjalistycznej, a także mogą wspierać organy służby zdrowia w podejmowaniu decyzji.8,26
Ograniczenia i mocne strony
W tym dużym badaniu obserwacyjnym pacjentów z FH w wieku poniżej 18 lat interwencja była niezmienna w stosunku do interwencji prowadzonej przez lekarza pacjenta. Brakuje wiarygodnego wyjściowego profilu lipidowego w tym rejestrze, ponieważ niektórzy pacjenci byli już leczeni w momencie zapisywania do badania. Ponadto, wyniki mogły zostać zmienione przez kilka warunków, takich jak różne style życia i związek z różnymi czynnikami ryzyka sercowo-naczyniowego, które mogły zmodyfikować wyniki.
WNIOSKI
Dane z rejestru SafeHEART pokazują, że wysoki odsetek pacjentów z FH młodszych niż 18 lat ma wysokie poziomy LDL-C i nie osiąga zalecanych celów LDL-C. Stwierdziliśmy wzrost intensywności LLT i znaczący spadek poziomu LDL-C podczas obserwacji. Stosowanie statyny było jedynym niezależnym predyktorem osiągnięcia docelowego stężenia LDL-C. Ponadto, w trakcie obserwacji nie stwierdzono żadnych problemów związanych z bezpieczeństwem. Wyniki te wskazują, że wielu pacjentów z FH nie jest odpowiednio kontrolowanych i że nadal istnieje możliwość poprawy leczenia. Co więcej, obserwacja tej populacji pacjentów z FH może przyczynić się do poszerzenia wiedzy na temat bezpieczeństwa dożywotniego stosowania LLT oraz optymalnego wieku rozpoczęcia terapii w celu zapobiegania rozwojowi ASCVD w wieku dorosłym.
FUNDOWANIE
Ta praca była wspierana przez grant G03/181 z Fundación Hipercolesterolemia Familiar, FIS PI12/01289 z Instituto de Salud Carlos III, oraz grant 08-2008 z Centro Nacional de Investigación Cardiovascular.
KONFLIKTY INTERESÓW
Nie zgłoszono.
- –
Dzieci z nieleczoną heterozygotyczną rodzinną hipercholesterolemią są narażone na zwiększone ryzyko przedwczesnego ASCVD po 20 roku życia.
- –
Statyny i inne terapie obniżające stężenie lipidów skutecznie obniżają LDL-C i są bezpieczne u dzieci i młodzieży.
- –
Mało wiadomo o charakterystyce pacjentów z FH w wieku poniżej 18 lat, terapiach obniżających stężenie lipidów stosowanych u tych pacjentów oraz celach lipidowych osiąganych w rzeczywistości.
- –
Ten deficyt informacji jest jeszcze większy w przypadku danych z obserwacji.
CO DODAJE TO BADANIE?
- –
Wysoki odsetek pacjentów z FH w wieku poniżej 18 lat nie osiąga zalecanych docelowych wartości stężenia LDL-C.
- –
Stwierdziliśmy zwiększenie intensywności LLT i istotne zmniejszenie stężenia LDL-C podczas obserwacji.
- –
Stosowanie statyny było jedynym niezależnym predyktorem osiągnięcia celu LDL-C i nie wykryto żadnych obaw dotyczących bezpieczeństwa podczas obserwacji.
- –
Wyniki te wzmacniają koncepcję „im młodsze, tym lepsze”.
.