Wskazówki wewnątrzkomórkowe, takie jak uszkodzenia DNA komórki, napędzają apoptozę głównie poprzez szlak wewnątrzkomórkowy. Wewnątrzpochodny szlak apoptozy, który obejmuje konserwatywne białka sygnalizacyjne, jest fizycznie związany z mitochondriami, a u kręgowców jest wrażliwy na mitochondrialny stres oksydacyjny. Na szlak ten mają wpływ członkowie rodziny Bcl związani z błoną mitochondrialną, w tym gen Bax i Bcl-2, które działają odpowiednio jako pro- lub antyapoptotyczne białka regulatorowe.
Overview of Intrinsic Apoptosis Pathway
Wewnątrzpochodny szlak apoptozy jest inicjowany przez, na przykład, chemioterapię i/lub radioterapię. Jest on aktywowany przez szereg egzogennych i endogennych bodźców, takich jak uszkodzenia DNA, niedokrwienie i stres oksydacyjny. Ponadto odgrywa ważną rolę w rozwoju i eliminacji uszkodzonych komórek.
W szlaku wewnątrzpochodnym funkcjonalną konsekwencją sygnalizacji proapoptotycznej jest perturbacja błony mitochondrialnej i uwolnienie cytochromu c do cytoplazmy, gdzie tworzy on kompleks lub apoptosom z czynnikiem aktywującym proteazę apoptotyczną 1 (APAF1) i nieaktywną formą kaspazy-9. Kompleks ten hydrolizuje trójfosforan adenozyny w celu rozszczepienia i aktywacji kaspazy-9. Inicjator kaspazy-9 następnie rozszczepia i aktywuje kaspazy wykonawcze-3/6/7, powodując apoptozę komórek. Jest to całkowicie odmienne od sygnałów zewnątrzkomórkowych, które są zwykle generowane przez komórki cytotoksyczne układu odpornościowego i wyzwalają apoptozę głównie poprzez szlak zewnątrzpochodny.
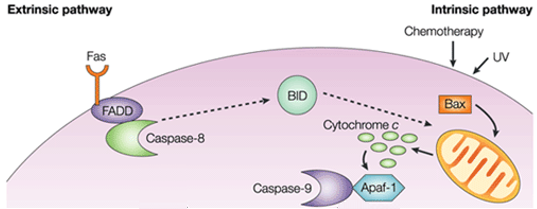
Rysunek 1. Różnica między szlakiem zewnątrzpochodnym a wewnątrzpochodnym.
Process and Regulation of Intrinsic Apoptosis Pathway
Ścieżka wewnątrzpochodna apoptozy indukuje apoptozę poprzez bezpośrednią aktywację kaspazy-3 lub poprzez rozszczepienie bid (agonisty śmierci z domeną współdziałającą z BH3), co prowadzi do dysfunkcji mitochondriów i następczego uwolnienia cytochromu c oraz aktywacji kaspaz-9 i kaspaz-3. Kaspaza-3 promuje typowe cechy apoptozy, w tym fragmentację DNA i śmierć komórki w kilku tkankach.
Rodzina białek chłoniaka B-komórkowego 2 (Bcl-2) ściśle kontroluje aktywację szlaku wewnątrzpochodnego. Występuje w chłoniaku pęcherzykowym i po raz pierwszy została zidentyfikowana jako jeden z genów zaangażowanych w śmierć komórki poprzez aktywację pro-apoptotycznej lub hamowanie anty-apoptotycznej apoptozy. Białka w jednej podgrupie, włączając Bid, Bad, Bim, Bmf, Puma i Noxa, zawierają pojedynczą domenę homologii Bcl-2 3 (białka tylko BH3) i mają aktywność pro-apoptotyczną. Dwa inne podzbiory białek mają wiele domen BH. Pierwszy podzbiór, obejmujący białko X związane z Bcl-2 (Bax), Bcl-2 homologiczny antagonista/zabójca (Bak) i regulator apoptozy z rodziny Bcl-2 (Bok), jest pro-apoptotyczny; drugi podzbiór, obejmujący Bcl-2, Bcl-XL i Mcl-1, jest anty-apoptotyczny. Na szlak mitochondrialny częściowo wpływają członkowie rodziny Bcl związani z błoną mitochondrialną, w tym zarówno proapoptotyczne białka regulacyjne Bax, jak i antyapoptotyczne białka regulacyjne Bcl-2.
Cząsteczki proapoptotyczne powodują permeabilizację zewnętrznej błony mitochondrialnej, prowadząc do odpływu cytochromu c, który wiąże adaptor Apaf-1 i inicjator kaspazy-9 w cytosolu, tworząc kompleks apoptosomu. To stymuluje kaspazę-9, która z kolei aktywuje kaspazy efektorowe. Mitochondrium uwalnia również do cytozolu białko o nazwie Smac/DIABLO. Smac/DIABLO pośrednio promuje apoptozę, blokując działanie grupy białek antyapoptotycznych zwanych białkami inhibitorów apoptozy (IAP).
Białka antyapoptotyczne Bcl-2 i Bcl-XL hamują uwalnianie cytochromu c, podczas gdy Bax, Bak i Bid, wszystkie białka proapoptotyczne, promują jego uwalnianie z mitochondriów. Cytochrom c i trifosforan deoksyadenozyny (dATP) wiążą się z APAF-1, tworząc multimeryczny kompleks, który rekrutuje i aktywuje prokaspazę-9, proteazę wykonawczą pośredniczącą w apoptozie, która z kolei aktywuje kaskadę kaspaz, prowadząc do apoptozy komórek. W procesie tym w inicjację apoptozy zaangażowane są: kaspaza-2, kaspaza-8, kaspaza-9 i kaspaza-10. Kaspaza-3, kaspaza-6 i kaspaza-7 są zaangażowane w apoptozę. Kaspaza-3 i kaspaza-7 regulują zahamowanie naprawy DNA i rozpoczynają degradację DNA. Ponadto kaspaza-6 reguluje rozpad laminy i cytoszkieletu.
Intrinsic Apoptosis Pathway in Pathophysiology
Większość chemioterapii i celowanych terapii przeciwnowotworowych zabija komórki nowotworowe poprzez generowanie sygnalizacji pro-death, która inicjuje intrinsic apoptotic pathway of programmed cell death. Punktem bez powrotu w kaskadzie apoptotycznej jest permeabilizacja zewnętrznej błony mitochondrialnej (MOMP); po jej wystąpieniu, permeabilizacja mitochondrialna prowadzi do powstania apoptosomu, który ułatwia aktywację kaspaz, a następnie uruchamia inne cechy apoptotycznej śmierci komórki. Komórkowa decyzja o zainicjowaniu MOMP jest kontrolowana przez delikatną równowagę między pro- i antyapoptotycznymi cząsteczkami z rodziny BCL-2.
Jedną z przyczyn oporności na chemioterapię jest niezdolność komórek nowotworowych do przejścia w apoptozę z powodu defektów wewnętrznego szlaku apoptotycznego (np. zmiany w p53). Pomimo znacznej poprawy w leczeniu, wskaźniki wyleczalności wielu nowotworów pozostają poniżej optymalnego poziomu. Rozwój chemioterapii cytotoksycznej doprowadził do wyleczenia podgrupy nowotworów, chociaż trudno jest przewidzieć oporność na leczenie u poszczególnych pacjentów. Fala terapii ukierunkowanych molekularnie koncentruje się na mutacjach aktywujących receptory, a zatem jest ograniczona do określonych podgrup pacjentów. Wewnątrzpochodny mitochondrialny szlak apoptozy stanowi jeden z obiecujących celów dla nowych terapii, a skuteczne ukierunkowanie na ten szlak może potencjalnie zmienić krajobraz terapeutyczny terapii dla różnych nowotworów.
.