Waterchemie 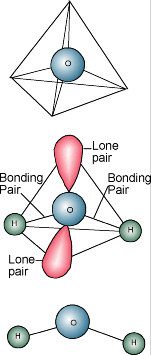 Je weet waarschijnlijk wel dat de chemische omschrijving van water H2O is. Een watermolecuul bestaat uit een zuurstofatoom gebonden aan twee waterstofatomen. De waterstofatomen zitten “vast” aan één kant van het zuurstofatoom, waardoor een watermolecuul een positieve lading heeft aan de kant waar de waterstofatomen zitten en een negatieve lading aan de andere kant, waar het zuurstofatoom zit. Omdat tegengestelde elektrische ladingen elkaar aantrekken, hebben watermoleculen de neiging elkaar aan te trekken, waardoor water een soort “kleverig” wordt. De kant met de waterstofatomen (positieve lading) trekt de zuurstofkant (negatieve lading) van een andere watermolecule aan.
Je weet waarschijnlijk wel dat de chemische omschrijving van water H2O is. Een watermolecuul bestaat uit een zuurstofatoom gebonden aan twee waterstofatomen. De waterstofatomen zitten “vast” aan één kant van het zuurstofatoom, waardoor een watermolecuul een positieve lading heeft aan de kant waar de waterstofatomen zitten en een negatieve lading aan de andere kant, waar het zuurstofatoom zit. Omdat tegengestelde elektrische ladingen elkaar aantrekken, hebben watermoleculen de neiging elkaar aan te trekken, waardoor water een soort “kleverig” wordt. De kant met de waterstofatomen (positieve lading) trekt de zuurstofkant (negatieve lading) van een andere watermolecule aan.
Al deze watermoleculen die elkaar aantrekken, hebben de neiging samen te klonteren. Daarom zijn waterdruppels eigenlijk druppels! Zonder sommige aardse krachten, zoals de zwaartekracht, zou een waterdruppel de vorm van een bol hebben – een perfecte bol. Zelfs als het op aarde geen perfecte bol vormt, moeten we blij zijn dat water kleverig is.
Water wordt het “universele oplosmiddel” genoemd, omdat het meer stoffen oplost dan enige andere vloeistof. Dit betekent dat waar water zich ook begeeft, hetzij door de grond, hetzij door ons lichaam, het waardevolle chemicaliën, mineralen en voedingsstoffen meeneemt.
Puur water heeft een neutrale pH. Zuiver water heeft een pH, van ongeveer 7, die noch zuur noch basisch is.
De fysische eigenschappen van water:
Water is uniek in die zin dat het de enige natuurlijke stof is die in alle drie de toestanden – vloeibaar, vast (ijs), en gas (stoom) – wordt aangetroffen bij de temperaturen die normaal op aarde worden aangetroffen. Het water op aarde is voortdurend in beweging en verandert voortdurend.
 Water bevriest bij 32° Fahrenheit (F) en kookt bij 212° F. In feite vormen het vries- en kookpunt van water de basislijn waarmee temperatuur wordt gemeten: 0° op de schaal van Celsius is het vriespunt van water, en 100° is het kookpunt van water. Water is ongewoon in die zin dat de vaste vorm, ijs, minder dicht is dan de vloeibare vorm, en daarom drijft ijs.
Water bevriest bij 32° Fahrenheit (F) en kookt bij 212° F. In feite vormen het vries- en kookpunt van water de basislijn waarmee temperatuur wordt gemeten: 0° op de schaal van Celsius is het vriespunt van water, en 100° is het kookpunt van water. Water is ongewoon in die zin dat de vaste vorm, ijs, minder dicht is dan de vloeibare vorm, en daarom drijft ijs.
Water heeft een hoge soortelijke warmte-index. Dit betekent dat water veel warmte kan absorberen voordat het heet wordt. Daarom is water waardevol voor de industrie en in de radiator van uw auto als koelvloeistof. De hoge specifieke warmte-index van water helpt ook bij het reguleren van de snelheid waarmee de lucht van temperatuur verandert, waardoor de temperatuurverandering tussen de seizoenen geleidelijk verloopt in plaats van plotseling, vooral in de buurt van de oceanen.
Water heeft een zeer hoge oppervlaktespanning. Met andere woorden, water is kleverig en elastisch, en heeft de neiging om samen te klonteren in druppels in plaats van zich te verspreiden in een dunne film. De oppervlaktespanning is verantwoordelijk voor de capillaire werking, waardoor water (en de opgeloste stoffen) zich door de wortels van planten en door de kleine bloedvaten in ons lichaam kunnen bewegen.
Watertemperatuur:
De temperatuur van het water is niet alleen belangrijk voor zwemmers en vissers, maar ook voor de industrie en zelfs voor vissen en algen. In elektriciteitscentrales wordt veel water gebruikt om elektriciteit op te wekken. Zij hebben koel water nodig om mee te beginnen, en geven over het algemeen warmer water terug aan de omgeving. De temperatuur van het vrijgekomen water kan de stroomafwaartse habitats beïnvloeden. De temperatuur kan ook van invloed zijn op het vermogen van water om zuurstof vast te houden en op het vermogen van organismen om bepaalde verontreinigende stoffen te weerstaan.
pH:
pH is een maat voor hoe zuur/basisch water is. Het bereik loopt van 0 – 14, waarbij 7 neutraal is. pH’s van minder dan 7 wijzen op zuurheid, terwijl een pH van meer dan 7 wijst op een base. pH is eigenlijk een maat voor de relatieve hoeveelheid vrije waterstof- en hydroxyl-ionen in het water. Water met meer vrije waterstof-ionen is zuur, terwijl water met meer vrije hydroxyl-ionen basisch is. Aangezien pH kan worden beïnvloed door chemicaliën in het water, is pH een belangrijke indicator van water dat chemisch verandert. pH wordt gerapporteerd in “logaritmische eenheden”, zoals de schaal van Richter, die aardbevingen meet. Elk getal staat voor een tienvoudige verandering in de zuurgraad/basiciteit van het water. Water met een pH van 5 is tien keer zuurder dan water met een pH van 6.
Verontreiniging kan de pH van een water veranderen, wat op zijn beurt schadelijk kan zijn voor dieren en planten die in het water leven. Bijvoorbeeld, water dat uit een verlaten kolenmijn komt kan een pH van 2 hebben, wat erg zuur is en zeker invloed zou hebben op elke vis die gek genoeg is om te proberen er in te leven! Als we de logaritmische schaal gebruiken, zou dit mijnafvalwater 100.000 keer zuurder zijn dan neutraal water — dus blijf weg uit verlaten mijnen.
Specifieke geleiding:
Specifieke geleiding is een maat voor het vermogen van water om een elektrische stroom te geleiden. Zij is sterk afhankelijk van de hoeveelheid opgeloste vaste stoffen (zoals zout) in het water. Zuiver water, zoals gedestilleerd water, heeft een zeer lage soortelijke geleiding, terwijl zeewater een hoge soortelijke geleiding heeft. Regenwater lost vaak gassen en stof in de lucht op, en heeft daarom vaak een hogere soortelijke geleiding dan gedestilleerd water. Specifieke geleiding is een belangrijke meting van de waterkwaliteit, omdat het een goed idee geeft van de hoeveelheid opgelost materiaal in het water.
Waarschijnlijk heb je op school wel eens het experiment gedaan waarbij je een batterij aansluit op een gloeilamp en twee draden van de batterij in een bekerglas met water laat lopen. Wanneer de draden in een bekerglas met gedestilleerd water worden gelegd, gaat het lampje niet branden. Maar de lamp gaat wel branden als het bekerglas zout water (zoutwater) bevat. In het zoute water is het zout opgelost, waardoor vrije elektronen vrijkomen en het water een elektrische stroom gaat geleiden.
Turbiditeit:
Turbiditeit is een maat voor de troebelheid van water. Zij wordt gemeten door een lichtstraal door het water te laten gaan en te zien hoeveel er door deeltjes in het water wordt weerkaatst. Troebelheid van water wordt veroorzaakt door materiaal, zoals vuil en bladresten, dat in het water zweeft (drijft). Kristalhelder water, zoals het Tahoe-meer (waar hard wordt gewerkt om te voorkomen dat sedimenten in het meer spoelen), heeft een zeer lage troebelheid. Maar kijk eens naar een rivier na een storm — die is waarschijnlijk bruin. Je ziet alle grond in suspensie in het water. Gelukkig voor ons bezinken de stoffen die troebelheid veroorzaken in ons drinkwater of worden ze gefilterd voordat het water thuis in ons drinkglas belandt. Troebelheid wordt gemeten in nefelometrische troebelingseenheden (NTU).
Zuurstof in opgeloste vorm:
Weliswaar bevatten watermoleculen een zuurstofatoom, maar deze zuurstof is niet wat waterorganismen nodig hebben die in onze natuurlijke wateren leven. Een kleine hoeveelheid zuurstof, tot ongeveer tien moleculen zuurstof per miljoen water, is in feite opgelost in water. Deze opgeloste zuurstof wordt ingeademd door vissen en zoöplankton en is voor hen nodig om te overleven.
Snel bewegend water, zoals in een bergbeek of een grote rivier, heeft de neiging veel opgeloste zuurstof te bevatten, terwijl stilstaand water weinig bevat. Het proces waarbij bacteriën in het water organisch materiaal, bijvoorbeeld afkomstig van een rioolwaterzuiveringsinstallatie, helpen rotten, verbruikt zuurstof. Een teveel aan organisch materiaal in onze meren en rivieren kan dus leiden tot een zuurstofarme situatie. Het waterleven kan het moeilijk hebben in stilstaand water met veel rottend organisch materiaal, vooral in de zomer, wanneer het gehalte aan opgeloste zuurstof seizoensgebonden laag is.
Hardheid:
De hoeveelheid opgelost calcium en magnesium in water bepaalt de “hardheid” ervan. De hardheid van water varieert in de Verenigde Staten. Als u in een gebied woont waar het water “zacht” is, dan heeft u misschien nog nooit van waterhardheid gehoord. Maar als je in Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, South Dakota, Iowa, Wisconsin, of Indiana woont, waar het water relatief hard is, zul je misschien merken dat het moeilijk is om je handen of je kleren te wassen. En industrieën in uw regio moeten misschien geld uitgeven om hun water te ontharden, omdat hard water apparatuur kan beschadigen. Hard water kan zelfs de levensduur van stoffen en kleding verkorten! Betekent dit dat studenten die in gebieden met hard water wonen, niet meer mee kunnen komen met de laatste mode omdat hun kleren sneller verslijten?
Suspended Sediment:
Suspended sediment is de hoeveelheid grond die in een stroom meebeweegt. Het hangt sterk af van de snelheid van de waterstroom, want snelstromend water kan meer grond opnemen en in suspensie brengen dan rustig water. Tijdens stormen spoelt grond van de oevers in de beek. De hoeveelheid die in een beek spoelt, hangt af van het soort land in het afwateringsgebied van de rivier en de vegetatie rondom de rivier.
Als het land langs een beek wordt verstoord en er geen beschermende maatregelen worden genomen, kan een teveel aan sediment de waterkwaliteit van een beek schaden. U hebt waarschijnlijk wel eens van die korte, plastic hekken gezien die bouwers plaatsen aan de randen van het terrein dat ze aan het ontwikkelen zijn. Deze slibhekken zijn bedoeld om sediment tijdens een regenbui op te vangen en te voorkomen dat het in een beek spoelt, want overtollig sediment kan schadelijk zijn voor beken, rivieren, meren en stuwmeren.
Sediment dat in een stuwmeer terechtkomt, is altijd een punt van zorg; als het er eenmaal in zit, kan het er niet meer uit – het meeste zal op de bodem bezinken. Reservoirs kunnen “dichtslibben” als er te veel sediment in terechtkomt. Het volume van het stuwmeer wordt kleiner, waardoor er minder ruimte overblijft om te varen, te vissen en te recreëren, en de krachtcentrale in de dam minder energie kan opwekken.
Geochemie van waterige oplossingen:
Kijk naar een diagram van de hydrogeochemische cyclus.
- Zuur = waterstofhoudende stof die bij oplossing in water vrij waterstof (H + ) oplevert
- Base = OH-houdende stof die bij oplossing in water vrij (OH – ) oplevert
-
Een zure oplossing is een oplossing die een overmaat aan vrij H + bevat, en een base is een oplossing die een overmaat aan vrij OH – bevat. Een reactie tussen een zuur en een base wordt gewoonlijk neutralisatie genoemd.
Bijvoorbeeld:
-
HCl (zuur) + NaOH (base) ==> H 2 O + NaCl
die worden gescheiden in ionen:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - d.w.z. Na + en Cl – blijven onaangetast.
- pH = inverse log van de concentratie (activiteit) van vrij H + , of pH = -log
-
Water dissocieert in H + en OH – ;
-
de dissociatieconstante is: K water = =10 -14
- Er moeten dus 10 -7 mol elk van H+ en OH – zijn in een kilogram neutrale oplossing bij de standaardtemperatuur van 25°C. Een mol is 6,023 x 10 23 atomen (of moleculen) en H 2 O heeft een molecuulgewicht van 18 gram per mol. Een kilogram water bevat ongeveer 1000/18 = 55,6 mol water of ongeveer 3,35 x 10 25 zuurstofatomen en ongeveer tweemaal dat aantal (6,7 x 10 25 atomen) H + (de hoeveelheid vrij H + of vrij OH – is relatief klein in vergelijking met de hoeveelheid ongebonden H 2 O).
- pH varieert bij 25°C van 0 tot 14; pH < 7 = zure oplossing; pH > 7 = basische oplossing. Als HCl of een ander zuur wordt toegevoegd dan daalt pH; als NaOH of een andere base wordt toegevoegd dan stijgt pH.
- pH stijgt als koolzuur (een zwak zuur) uit elkaar valt: Wanneer kooldioxide zich met water verbindt, zoals in de atmosfeer gebeurt wanneer fossiele brandstoffen worden verbrand, wordt koolzuur gevormd: H 2 O + CO 2 ==> H 2 CO 3 . Bij de opeenvolgende dissociaties komen vrije H+ vrij:
-
H 2 CO 3 ==> H + + HCO 3- koolzuur tot bicarbonaat, treedt op bij pH ~6,4
-
HCO 3 ==> H + CO 32- bicarbonaat tot carbonaat, treedt op bij pH ~10.3
Vergeet niet dat vrij H + alleen beschikbaar is bij zuur, of bij pH < ~7. De dissociatie van bicarbonaat tot carbonaat vindt plaats als er te veel OH – in het systeem is en H + wordt “vrijgemaakt” om de base uit te balanceren.
- Opgeloste kationen en anionen in water
Kationen = elektronendonoren, positief geladen: Na + , K + , Mg ++ , Ca ++ , Fe ++ of Fe +++ , Mn ++ , Al +++
Anionen = elektronenacceptoren, neg. geladen: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metalen = gedragen zich meestal als kationen: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, enz.
- Wateranalyses – noodzaak van een kation-anionbalans
millequivalent (MEQ) = mol equivalente lading of anion of kation, maat voor de totale lading als gevolg van het ion in kwestie opgelost in de oplossing. Begin met de concentratie, deel door het molgewicht, vermenigvuldig met de lading: XX mg/L / MW x CHG = MEQ
Voorbeeld: NaCl in oplossing, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Als de totale kation- en anion-MEQ’s niet in evenwicht zijn, bestaat er dus enige fout in de analyse.