Wanneer waterstof covalent gebonden is aan een sterk elektronegatief atoom, zoals fluor, chloor, zuurstof of stikstof, heeft het H-atoom een partieel positieve lading, geschreven Hδ+.
Hδ+ is fysisch zeer klein, zodat de ladingsdichtheid erop ongewoon hoog is.
Stel u voor dat een ander negatief of elektronegatief atoom, zeg op een ander molecuul, het Hδ+ nadert; er zal wederzijdse aantrekkingskracht zijn, resulterend in een bijzonder sterke dipool-dipool aantrekkingskracht.Deze aantrekkingskracht wordt een waterstofbrug genoemd.
In het algemeen zijn waterstofbruggen zwakker dan ionische en covalente bindingen, maar sterker dan van der Waals krachten.

waterstofbruggen in water
Het bekendste voorbeeld van waterstofbruggen is water:
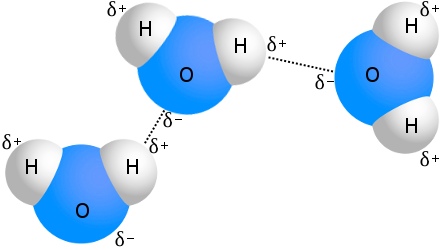
Elk watermolecuul kan waterstofbruggen hebben met wel vier andere watermoleculen.In water bij kamertemperatuur is het gemiddelde aantal waterstofbruggen per watermolecuul 3,6.
De willekeurige thermische beweging van moleculen zorgt ervoor dat de levensduur van elke afzonderlijke waterstofbrug in water kort is, gemiddeld slechts 10 picoseconden.De tijd om een nieuwe binding te vormen is echter nog korter.
Om een enkele waterstofbrug in water permanent te verbreken is 21 kJ mol-1 nodig, een aanzienlijke energie-input.Het resultaat is dat het smelt- en kookpunt van water veel hoger zijn dan men zou verwachten voor zo’n molecuul met een laag moleculair gewicht.
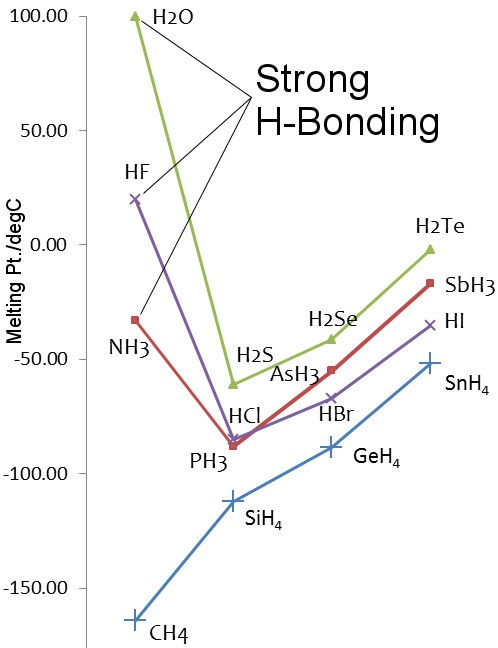
Zie water vs methaan.Watermoleculen worden vrij sterk door waterstofbruggen tot elkaar aangetrokken, terwijl bij methaan de van der Waals krachten overheersen.Dus, hoewel hun molecuulmassa’s vergelijkbaar zijn, bij 18 voor water en 16 voor methaan, zijn hun fysische eigenschappen zeer verschillend.Water smelt bijvoorbeeld bij 0,00 °C en kookt bij 99,98 °C; methaan smelt bij -182,5 °C en kookt bij -161,5 °C.
Hydrogen Bonding in Water vs Waterstofsulfide
Zwavel zit in groep 16 van het periodiek systeem, hetzelfde als zuurstof. Zwavel is zwaarder dan zuurstof, dusH2S zou een hoger smelt- en kookpunt moeten hebben dan H2O.Dit is echter niet het geval omdat zwavel minder elektronegatief is dan zuurstof, en daarom is de waterstofbinding in H2S zwak.

Mol. Mass: 16
Smelttemperatuur: 0,00 °C
Brandtemperatuur: 99,98 °C
Elektronegativiteit van O (Pauling): 3,44
Warmstofbindingsenthalpie: 21 kJ mol-1

Mol. Mass: 34
Smelttemperatuur: -82 °C
Brandtemperatuur: -60 °C
Elektronegativiteit van S (Pauling): 2.58
waterstofbindingsenthalpie: ≅ 3 kJ mol-1
waterstofbinding in ammoniak en waterstoffluoride
Fluor en stikstof zijn de meest elektronegatieve elementen in hun groepen van het periodiek systeem, en waterstofbinding wordt waargenomen in waterstoffluoride en ammoniak.
Zoals in het geval van water, zijn het smelt- en kookpunt van waterstoffluoride en ammoniak hoger dan de hydriden van zwaardere elementen in hun groepen.
smeltpunten voor de hydriden van de elementen van groep 14-17
waterstofbinding in DNA
De basenparen van het DNA verbinden de twee helixketens. De basenparen dragen de genetische informatie van het DNA.
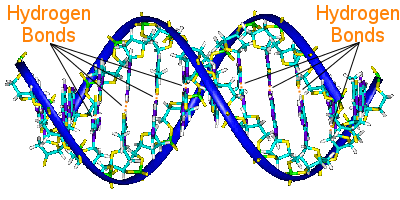
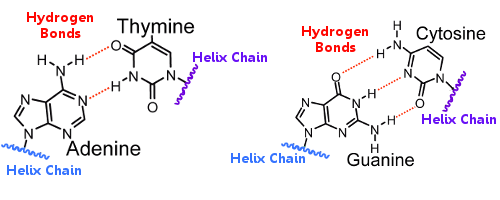
De basenparen op de ene helix zijn door waterstofbruggen verbonden met de basenparen op de andere helix.Zo houdt waterstofbinding de helixen bij elkaar, waardoor de beroemde dubbele helix ontstaat.
Wanneer DNA repliceert, breken de waterstofbruggen, waardoor de twee helixen zich kunnen scheiden.Op deze manier speelt waterstofbinding een essentiële rol in het lock-and-key-mechanisme van de basenparen bij DNA-replicatie.
Waterstofbruggen in wol
Wol heeft net als andere eiwitvezels waterstofbruggen.De afbeelding hieronder laat zien hoe waterstofbruggen (oranje stippen) de windingen van de α-helixketen van wol (groen) met elkaar verbinden.
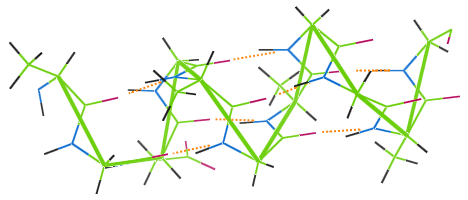
Als een wollen kledingstuk bij een hoge temperatuur wordt gewassen, worden de waterstofbruggen vernietigd, verliezen de spoelen hun elasticiteit en wordt het kledingstuk smoezelig.
