Het immuunsysteem
Het immuunsysteem bestaat uit weefsels, cellen en moleculen met als voornaamste functie het opsporen van, reageren op en elimineren van ziekteverwekkers en getransformeerde cellen.
Aangeboren en adaptieve immuunrespons
Er zijn twee hoofdcomponenten van het immuunsysteem: 1) het aangeboren immuunsysteem en 2) het adaptieve immuunsysteem. Het aangeboren immuunsysteem fungeert als de eerste verdedigingslinie en detecteert ziekteverwekkers via kiembaangecodeerde patroonherkenningsreceptoren, vormt geen geheugen en reageert snel (binnen enkele minuten tot uren). Het adaptieve immuunsysteem reageert langzaam (na dagen), gebruikt antigeenspecifieke receptoren die meerdere genherschikkingen ondergaan tijdens de ontwikkeling, en vormt een immunologisch geheugen – het “leert” van de initiële belediging en maakt het lichaam klaar om toekomstige blootstelling aan gelijkaardig schadelijk materiaal te bestrijden. Beide soorten immuunreacties kunnen worden aangestuurd door macromoleculen in de extracellulaire vloeistof of door de activering van specifieke immuuncellen. Deze reacties staan bekend als respectievelijk humorale immuniteit en cel-gemedieerde immuniteit.
Onder de paraplu van de celgemedieerde immuunrespons stratificeren de immuuncellen zich meestal op basis van de vraag of de respons aangeboren of adaptief is. Het aangeboren immuunsysteem bestaat voornamelijk uit fagocytische cellen, zoals neutrofielen, macrofagen, natuurlijke killercellen, basofielen en anderen die gevaarlijke binnendringende organismen aanpakken. De cellen van het adaptieve immuunsysteem zijn T-cellen en B-cellen. Natural killer (NK) T-cellen hebben kenmerken van zowel aangeboren als adaptieve immuuncellen. Bovendien kunnen de meeste andere celtypes, die niet specifiek zijn voor het immuunsysteem, intrinsieke aangeboren immuunfuncties herbergen in de vorm van cytoplasmatische receptoren en signaal- en effectormoleculen zoals leden van de RIG-I, STING en NLR families. Zoals we verder zullen bespreken, ontstaan cellen van beide systemen uit verschillende myeloïde en lymfoïde lijnen van hematopoiëtische stamcellen.
Componenten van het Immuunsysteem
Volwassen immuuncellen differentiëren zich van wat hematopoietische stamcellen worden genoemd. Dit zijn pluripotente ongedifferentieerde progenitorcellen die voorkomen in het beenmerg, het perifere bloed en de placenta. Deze hematopoietische stamcellen kunnen differentiëren in de gewone myeloïde progenitorcel of de gewone lymfoïde progenitorcel.
Lymfoïde cellen
Gewone lymfoïde progenitorcellen kunnen zich differentiëren in vier grote populaties lymfocyten die kunnen worden onderscheiden door receptorexpressie op het celoppervlak: T cellen, B cellen, natural killer (NK) cellen, en NK-T cellen.
T-cellen
T-cellen spelen een cruciale rol in cel-gemedieerde immuniteit. Deze cellen worden geïdentificeerd door de expressie van CD3 T-celsignaleringsketens.
T-cellen ontstaan uit lymfoïde progenitorcellen die zich oorspronkelijk ontwikkelen uit hematopoietische stamcellen in het beenmerg. Zodra de lymfoïde progenitor zich ertoe verbindt een T-cel te worden, migreert hij van het beenmerg naar de thymus (vandaar de naam T-cel). De thymus biedt de juiste micro-omgeving waar T-cellen zich kunnen ontwikkelen tot hun verschillende subtypes, die worden gedefinieerd door de specifieke receptoren die op het celoppervlak tot uitdrukking komen. T-cellen in de vroege stadia, of thymocyten, missen receptoren voor zowel CD4 als CD8 en worden daarom dubbel negatieve (DN) cellen genoemd. De DN-cellen ondergaan vervolgens genetische herschikkingen en mutaties in de genen die coderen voor de alfa- en bèta-T-celreceptoren (TCR), waardoor zij een traject van lineage commitment ingaan waarbij het eindresultaat een T-celreceptor is met specifieke affiniteit voor een uniek antigeen.
De thymocyten worden dan geselecteerd, zowel positief als negatief, om er zeker van te zijn dat zij “vreemde” antigenen herkennen, maar geen gastheerantigenen, die als peptiden via de MHC op het celoppervlak worden gepresenteerd. Alleen cellen die voor beide tests slagen, worden vervolgens aangezet om CD4 en CD8 tot expressie te brengen, waardoor dubbel-positieve cellen ontstaan. Aan het einde van de rijping zullen T-cellen CD4 of CD8 tot expressie brengen (en de expressie van de andere verliezen) en aldus enkel-positieve cellen worden. Deze rijpe CD4- of CD8-positieve T-cellen worden dan in de bloedbaan vrijgegeven en bevinden zich aanvankelijk in de naïeve toestand, wat betekent dat zij zich nog niet tot een bepaald T-celsubtype hebben verbonden.
Als de rijpende thymocyt tijdens de rijping een gemiddelde hoeveelheid affiniteit voor zelf-MHC-peptiden vertoont, kan hij worden geselecteerd om een regulerende T-cel (Treg) te worden vanwege zijn vermogen om schadelijke “zelf”-antigenen te herkennen. T cellen in het bloed of in perifere weefsels kunnen ook plaatselijk geïnduceerd worden om Tregs te worden. De belangrijkste taak van Tregs is het handhaven van tolerantie voor zelf-antigenen, alsmede het beperken van T-effector celfunctie en proliferatie.
Eenmaal aangekomen in het bloed of perifere weefsels, kunnen naïeve T-cellen geïnduceerd worden om een T-helpercel te worden. Antigeen-presenterende cellen (APC’s), zoals macrofagen, dendritische cellen en B-cellen, zullen het antigeen aan de T-cel tonen, en als hun receptor affiniteit heeft, zal de T-cel het antigeen herkennen. Gewoonlijk zijn CD4+ T-cellen geschikt om peptide-antigenen te herkennen die gebonden zijn aan klasse II MHC-eiwitten. Zodra het peptide-MHC-complex is herkend, zal de T-cel een reeks interne pathways activeren die het mogelijk maken de antigeenherkenning te verifiëren. Alleen dan zal de T-helpercel zich vermenigvuldigen, waardoor de pool van beschikbare cellen die specifiek zijn voor het schadelijke antigeen, zoals verschillende bacteriën en parasieten, wordt uitgebreid.
Zodra T-helpercellen hun antigeen hebben herkend en geactiveerd zijn, zullen ze een verscheidenheid aan cytokines vrijgeven, wat moleculen zijn die andere immuuncellen een signaal geven hoe ze op de juiste manier moeten reageren op de schadelijke molecule. Er zijn verschillende subsets van helper-T-cellen, waaronder Th1, Th2 en Th17. Deze subgroepen produceren en scheiden verschillende cytokinen af die de immuunrespons helpen afstemmen op het type ziekteverwekker. Zo vertrouwen Th1-cellen op het effector-cytokine IFN-γ om macrofagen het signaal te geven het schadelijke materiaal te verteren en te vernietigen, terwijl Th2-cellen een combinatie van IL-4, IL-5, IL-9, IL-10 en IL-13 afscheiden om basofielen, eosinofielen en andere cellen ertoe aan te zetten de infectie aan te vallen. De specifieke hoeveelheid en variëteit van cytokinen bepaalt de juiste reactie op de infectie of schadelijke cel. T-cellen kunnen ook reageren op cellen van het zelf door cytotoxische T-cellen (of natural killer T-cellen) te worden. Gewoonlijk zijn dit CD8+ cellen die met een virus geïnfecteerde cellen of tumorcellen herkennen. Natural killer T-cellen (NKT’s) zullen in een later hoofdstuk nader worden besproken. Deze en andere soorten T-cellen voeren hun verschillende taken of effectorfuncties op verschillende manieren uit om schadelijk materiaal te herkennen en andere immuuncellen te rekruteren om het te vernietigen, en om een blijvende immuunrespons op te bouwen op hetzelfde soort belediging.
De T cel receptor signalering interactieve pathway wordt hier in detail besproken.
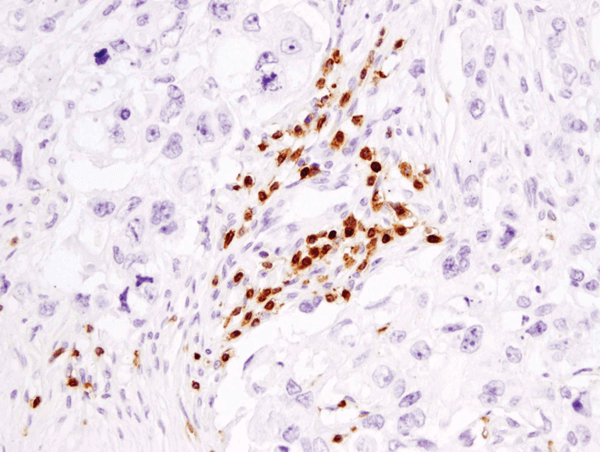
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-analyse van paraffine-embedded humaan borstcarcinoom met #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-analyse van een met paraffine bedekt menselijk borstcarcinoom met behulp van #85061.
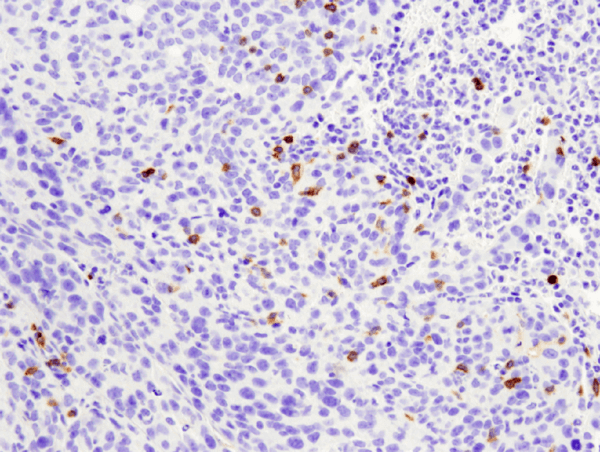
CD4 (D7D2Z) Konijn mAb #25229: IHC-analyse van paraffine-embedded 4T1 metastatische tumor in muizenlong met behulp van #25229.
CD4 (D7D2Z) Konijn mAb #25229: IHC analyse van paraffine-embedded 4T1 metastatische tumor in muizenlong met behulp van #25229.
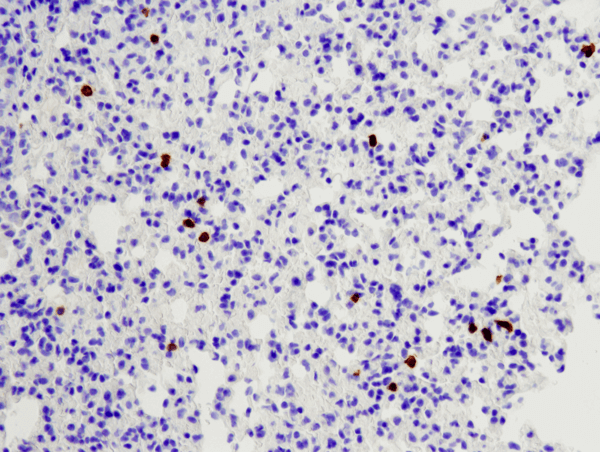
CD8α (D4W2Z) XP® Rabbit mAb (Muis Specifiek) #98941: IHC-analyse van een in paraffine ingebedde muislong met #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Muis Specifiek) #98941: IHC-analyse van een in paraffine ingebedde muislong met #98941.
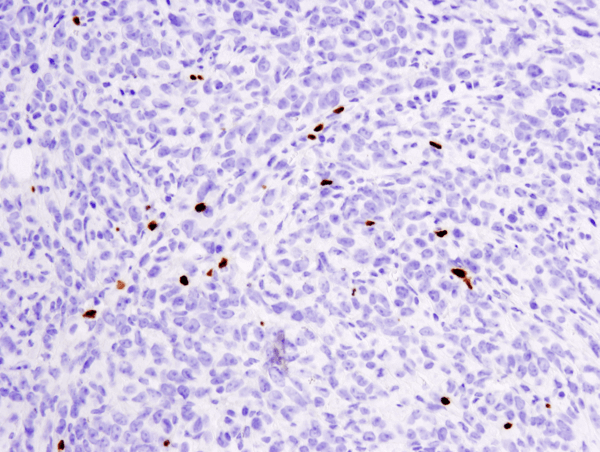
FoxP3 (D6O8R) Konijn mAb #12653: IHC analyse van paraffine-embedded 4T1 metastatische tumor in muizenlong met #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: IHC analyse van paraffine-embedded 4T1 metastatische tumor in muizenlong met behulp van #12653.
B-cellen
B-cellen zijn de kritische cellen in het bloed die bemiddelen bij de productie van antilichamen. Wanneer schadelijk materiaal in de bloedstroom aanwezig is, wordt het door specifieke receptoren op de B-cellen herkend als een antigeen. Na verwerking van het antigeen rijpt de B-cel, met de hulp van T-cellen, uit tot plasmacellen die antilichamen afscheiden. B-cellen kunnen ook een rol spelen bij de presentatie van antigenen en de afscheiding van cytokinen. Zowel de ontwikkeling als de verschillende functies van B-cellen zullen worden besproken.
15% van de leukocyten in het perifere bloed zijn B-cellen. B-cellen produceren immunoglobulinen (Ig), dat zijn antigeenbindende eiwitten (ook bekend als antilichamen) die bestaan uit twee identieke zware ketens en twee identieke lichte ketens. Deze immunoglobulinen bevatten specifieke antigeenbindingsplaatsen die qua aminozuursequentie van antilichaammolecule tot antilichaammolecule verschillen. Deze plaatsen verlenen specificiteit aan elk antilichaam voor herkenning van een verschillend antigeen.
Zoals hierboven vermeld, differentiëren B-cellen zich van hematopoietische cellen die zich in het beenmerg bevinden. Het is in het beenmerg dat oppervlakte-Ig-receptoren (antilichamen) worden geassembleerd door een proces van genherschikking. B-cellen maken gebruik van somatische samenvoeging van verschillende genen op een groot aantal chromosomen die coderen voor de verschillende delen van de zware en lichte ketens waaruit het Ig is opgebouwd. B-cellen worden tot differentiatie aangezet door de productie van IL-7 door beenmergstromale cellen. Deze zich ontwikkelende B-cellen volgen een programma van opeenvolgende herschikkingen van zware en lichte ketens, die worden bemiddeld door een verschillende expressie van receptoren op het celoppervlak. Zo verhindert de expressie van een specifieke pre-B-celreceptor bepaalde genherschikkingen op niet-verwante chromosomen om ervoor te zorgen dat de rijpe B-cel een bepaalde Ig-oppervlakte-receptor tot expressie kan brengen die in staat is één enkel antigeen specifiek te herkennen. Dit proces wordt allelische uitsluiting genoemd. Onjuiste assemblage van de Ig zware ketens en lichte ketens kan secundaire herschikking induceren voor receptorbewerking.
Naast de expressie van een Ig-receptor op het celoppervlak, bevatten B-cellen ook transmembraaneiwitten die intracellulaire signalen kunnen induceren nadat een antigeen bindt aan het extracellulaire gedeelte van de Ig-receptor. B-cellen gebruiken soortgelijke intracellulaire signaalcascades als T-cellen die transcriptionele veranderingen induceren die leiden tot proliferatie en maturatie. Meer in het bijzonder kunnen de intracellulaire domeinen van de Ig-receptor worden gefosforyleerd door de src-familie van kinasen, waardoor een cascade in gang wordt gezet die door het tyrosinekinase Syk en een linker-eiwit bekend als BLINK wordt doorgegeven aan fosfolipase C en guanine-uitwisselingsfactoren, waardoor uiteindelijk proteïnekinase C wordt geactiveerd, calcium wordt gemobiliseerd en MAP-kinase wordt geactiveerd op een Ras/Rac-afhankelijke wijze.
Een uniek kenmerk van B-cellen is hun vermogen om van isotype te veranderen. Dit verwijst specifiek naar een proces van DNA-herschikking dat licht verschillende zware ketens kan genereren. Bovendien kan alternatieve splicing van exonen van de zware keten het Ig in staat stellen aan het celoppervlak gebonden te blijven of te worden gesecreteerd als het transmembrane exon is uitgesplitst. Alternatieve splicing en isotypeverandering worden geïnduceerd door van T-cellen afgeleide cytokines. Bovendien kunnen T-cellen somatische mutaties induceren die leiden tot veranderingen in de antigeenbindingsplaatsen van het Ig van de B-cellen. Een zelfcorrigerende B-celfunctie kan detecteren of deze schijnbaar willekeurige mutaties leiden tot een verlies van affiniteit voor het antigeen en een programma voor celdood in gang zetten. Aldus brengen antigenen die zowel T-cellen als B-cellen activeren T-celgemedieerde B-celrijping op gang via isotype-overschakeling en somatische mutaties, die beide sterk geassocieerd zijn met B-celgeheugen.
Geheugenreacties worden gekenmerkt door een snelle en uitgebreide Ig-productie met hoge affiniteit voor dergelijke antigenen. De ontwikkeling van deze geheugenreacties zijn van cruciaal belang voor het succes van vaccinatie. Zij kunnen echter ook auto-immuniteit en allergische reacties versterken.
T-celonafhankelijke B-celactivatie door een antigeen kan ook plaatsvinden; dit type activatie is echter gekoppeld aan een zwak immuungeheugen. Bovendien moeten deze antigenen polymerisch zijn om B-cellen te kunnen activeren.
NB: Cytokinen, of interleukinen (IL’s), zijn gesecreteerde moleculen die werken op transmembraanreceptoren op het celoppervlak. Bij binding activeren deze cytokinen intracellulaire signaaltransductiewegen die typisch afhankelijk zijn van Jak-STAT-signalering.
De interactieve B celreceptor signaleringsroute wordt hier in detail besproken.
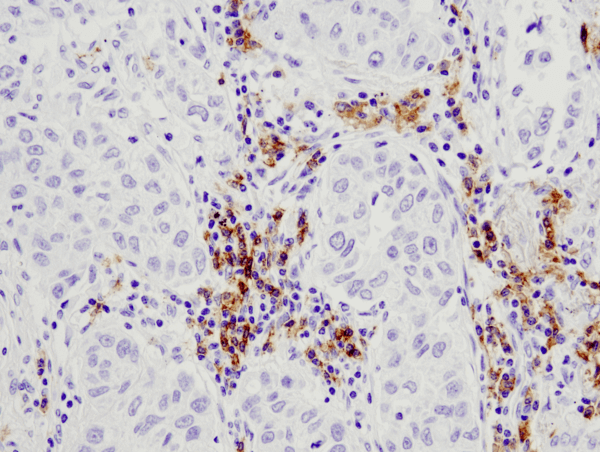
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-analyse van paraffine-embedded menselijk longcarcinoom met #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-analyse van in paraffine ingebed menselijk longcarcinoom met gebruikmaking van #90176.
NK-cellen
Natural killer cellen, of NK-cellen, zijn een ander celtype afkomstig van de lymfoïde lijn. Net als B-cellen ontwikkelen zij zich in het beenmerg op een cytokine- en beenmergstromale celafhankelijke wijze. Zij vertegenwoordigen een klein deel van het perifere bloed en hebben geen antigeenspecifieke receptoren. In plaats daarvan vertrouwen NK-cellen op een complex geheel van transmembraanreceptoren. In het bijzonder bevatten zij remmende cel-oppervlakte-receptoren die klasse I HLA-moleculen herkennen en aldus worden geremd door zelf-MHC-moleculen, waardoor alleen cellen worden gedood die klasse I HLA-expressie hebben gedownreguleerd. Daarom dienen zij het belangrijke doel om zich te richten op viraal geïnfecteerde cellen en tumorcellen waarvan de klasse I HLA expressie is gedownreguleerd om de dood door CD8+ natural killer T (NK-T) cellen te ontlopen. NK-cellen kunnen ook worden geactiveerd op een antilichaam-, interferon-, of cytokine-afhankelijke wijze en kunnen daarom een grote rol spelen bij de bestrijding van tumoren. Het werkingsmechanisme van NK-cellen berust op het vrijkomen van kleine granules die granzymes en perforine bevatten uit hun cytoplasma. Wanneer deze eiwitten vrijkomen, kunnen zij poriën maken en intracellulaire eiwitten afbreken om apoptose te induceren. Als zodanig wordt van NK-cellen gezegd dat zij cytotoxisch zijn.
NK-T-cellen zijn een speciaal subtype van T-cellen die bepaalde receptoren en markers tot expressie brengen die typisch zijn voor NK-cellen, in combinatie met een beperkt repertoire van T-celreceptoren. Daarom deelt dit unieke subtype eigenschappen van zowel T-cellen als NK-cellen. In tegenstelling tot NK-cellen, die zich ontwikkelen in het beenmerg, ontwikkelen NK-T-cellen zich in de thymus.
Myeloïde cellen
Gemeenschappelijke myeloïde progenitorcellen, die afstammen van hematopoietische stamcellen, geven aanleiding tot verschillende soorten myeloïde cellen, waaronder macrofagen, dendritische cellen, en verschillende andere aangeboren immuuncellen en bloedcellen.
Macrofagen
Macrofagen kunnen worden geactiveerd om antigenen te herkennen, zoals beschadigde cellen of vreemd materiaal, voor on-demand vernietiging. Macrofagen zijn aanwezig in de meeste weefsels en reageren wanneer nodig op infecties en afstervende cellen. Het herkende materiaal wordt via fagocytose in de macrofaag vernietigd, waaraan de cellen hun naam te danken hebben (“grote eter” in het Grieks). Macrofagen nemen verschillende vormen aan wanneer ze op verschillende plaatsen aanwezig zijn en kunnen naast fagocytose nog andere functies vervullen.
Na weefselbeschadiging of infectie met een ziekteverwekker worden monocyten in het bloed naar het aangetaste weefsel gerekruteerd en differentiëren ze zich tot macrofagen. Afhankelijk van de plaats waar het weefsel zich bevindt, bestaan er verschillende typen macrofagen, zoals Kupffercellen in de lever, alveolaire macrofagen in de longen, microglia in de hersenen, enz. Deze verschillende typen macrofagen stammen alle af van monocyten, maar specialiseren hun functie naar het weefsel waar zij zich bevinden. Het grootste deel van de algemene fagocytosefunctie wordt uitgevoerd door macrofagen die in het weefsel verblijven. Naast het fagocytoseren van dode cellen en vreemd materiaal, kunnen macrofagen ook via cytokinen signalen afgeven aan andere immuuncellen. Tot op zekere hoogte vervullen macrofagen de kritieke functie van antigeenpresentatie en werken zij aldus samen met T-cellen om de adaptieve immuniteit te ondersteunen. Bovendien kunnen macrofagen cytokinen zoals IL-12 afscheiden en een rol spelen bij lokale immuunreacties, terwijl andere grote hoeveelheden IL-10 afscheiden, die hun rol bij weefselherstel mediëren. Aldus spelen de “grote eters” een verscheidenheid van rollen in het immuunsysteem naast de hoofdtaak van fagocytose.
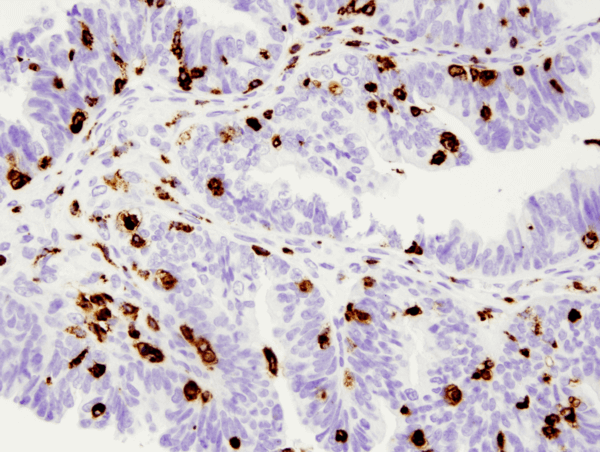
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-analyse van paraffine-embedded humaan sereus papillair carcinoom van de eierstok met #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-analyse van paraffine-embedded humaan sereus papillair carcinoom van de eierstok met gebruik van #76437.
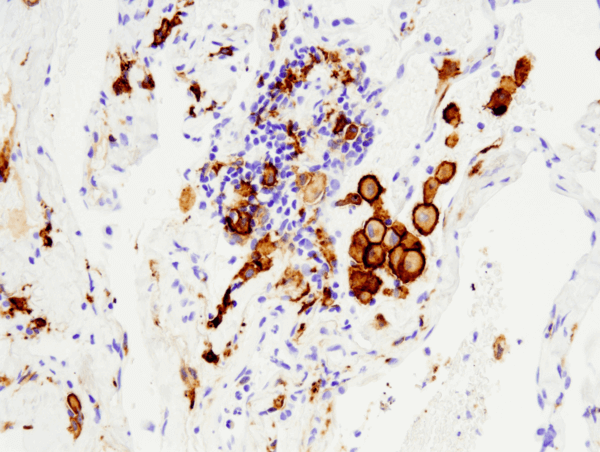
CD163 (D6U1J) Konijn mAb #93498: IHC-analyse van paraffine-embedded humaan niet-kleincellig longcarcinoom met behulp van #93498, uitgevoerd op de Leica® Bond™ Rx.
CD163 (D6U1J) Konijn mAb #93498: IHC-analyse van in paraffine ingebed menselijk niet-kleincellig longcarcinoom met behulp van #93498, uitgevoerd op de Leica® Bond™ Rx.
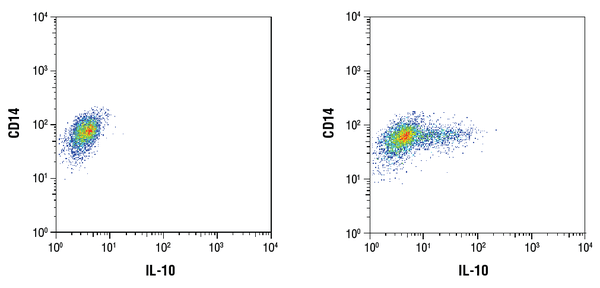
IL-10 (D13A11) XP® Rabbit mAb #12163: Flowcytometrische analyse van gezuiverde CD14+ humane perifere bloedmononucleaire cellen onbehandeld (links) of behandeld met LPS (100ng/mL, 16 uur; rechts) met gebruikmaking van een CD14-antilichaam en #12163. Brefeldin A #9972 (300ng/mL) werd toegevoegd aan onbehandelde en behandelde cellen na 1 uur van LPS stimulatie. Als secundair antilichaam werd anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugaat) #4414 gebruikt.
IL-10 (D13A11) XP® Rabbit mAb #12163: Flowcytometrische analyse van gezuiverde CD14+ humane perifere bloedmononucleaire cellen onbehandeld (links) of behandeld met LPS (100ng/mL, 16 uur; rechts) met gebruikmaking van een CD14-antilichaam en #12163. Brefeldin A #9972 (300ng/mL) werd toegevoegd aan onbehandelde en behandelde cellen na 1 uur van LPS stimulatie. Als secundair antilichaam werd anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugaat) #4414 gebruikt.
Dendritische cellen
Net als macrofagen hebben dendritische cellen de capaciteit om cellulair en vreemd materiaal op te slokken, maar in plaats van het te verteren voor verwijdering, verwerken dendritische cellen het materiaal en presenteren het als antigenen aan T-cellen. Als zodanig fungeren dendritische cellen als antigeenpresenterende cellen, of accessoire cellen, en geven zo informatie over ziekteverwekkers door tussen het aangeboren en het adaptieve immuunsysteem. Dendritische cellen ontlenen hun naam aan hun verschillende cellulaire uitsteeksels die naar buiten reiken en schadelijk materiaal grijpen om te worden verteerd.
Ontstaan uit hematopoietische beenmergprogenitors, doorlopen aanvankelijk onrijpe dendritische cellen een “leerfase” waarin zij hun lokale gebied onderzoeken op vreemd materiaal en een herkenningsreactie in gang zetten via patroonherkenningsreceptoren (een veel voorkomende set van deze receptoren zijn de toll-like receptoren). Deze onrijpe dendritische cellen kunnen zich op verschillende plaatsen bevinden met toegang tot de externe omgeving, zoals de binnenbekleding van de neus, de maag, de longen en zelfs in de huid. Na herkenning van het antigeen zullen de dendritische cellen naar de lymfeknoop migreren, waar zij de T-cellen zullen trainen om het antigeen te herkennen en dienovereenkomstig te reageren. Dendritische cellen zijn de enige antigeenpresenterende cellen die zowel geheugen- als naïeve T-cellen kunnen activeren. Toll-like receptoren zijn een goed bestudeerde klasse van receptoren die aanwezig zijn op macrofagen en dendritische cellen en die bemiddelen bij de herkenning van en de reactie op vreemde ziekteverwekkers. Naast een directe interactie met T-cellen kunnen dendritische cellen ook signalen afgeven via cytokines zoals IL-12, die het immuunsysteem klaarstomen voor de daaropvolgende aanval op het schadelijke materiaal. Andere soorten dendritische cellen kunnen cytokinen afscheiden die een signaal geven om meer macrofagen te rekruteren om een overvloed aan afvalmateriaal op te ruimen. Als de belangrijkste celbemiddelaars voor antigeenpresentatie spelen dendritische cellen dus een onmisbare rol in de kruisbestuiving tussen het aangeboren en het adaptieve immuunsysteem.
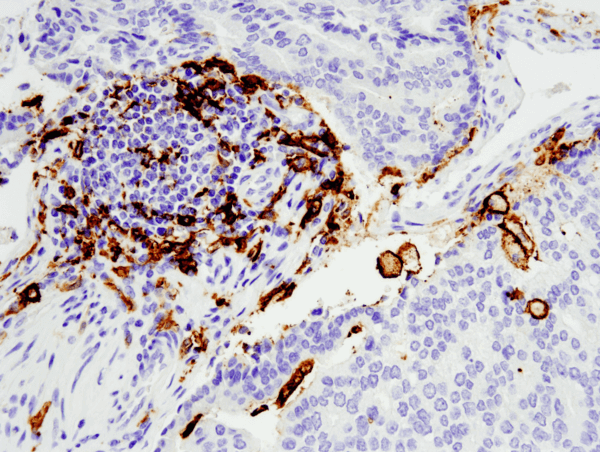
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-analyse van in paraffine ingebedde menselijke prostaat adenocarcinoom met #455812, uitgevoerd op de Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-analyse van in paraffine ingebedde menselijke prostaat adenocarcinoom met #455812, uitgevoerd op de Leica® Bond™ Rx.
Andere aangeboren immuuncellen en signalering
Andere cellen van het aangeboren immuunsysteem omvatten mestcellen, die functioneren bij wondgenezing en helpen bescherming te bieden tegen ziekteverwekkers. Wanneer ze worden geactiveerd door een ziekteverwekker, kunnen mestcellen cytokinen afscheiden, evenals korrels die histamine en heparine bevatten, die verdere immuunreacties zoals het rekruteren van macrofagen en het verwijden van bloedvaten in gang zetten. Neutrofielen, eosinofielen en basofielen worden gezamenlijk granulocyten genoemd vanwege de karakteristieke granules in hun cytoplasma. Bij neutrofielen werken de granules om toxische verbindingen af te geven die ziekteverwekkers zoals schimmels en bacteriën aanpakken.
Immunology in Health and Disease
Cancer Immunology
Het inzetten van immuuncellen om kanker te bestrijden is door het succes in de kliniek een zeer actueel onderzoeksthema geworden. Een recente focus van de huidige immunotherapie is gericht op de signalering van checkpoint-eiwitten, zoals PD-1, die normaal gesproken T-celactivatie en -respons voorkomen. Adoptieve celtherapie is een andere opwindende benadering waarbij T-cellen van de patiënt worden geimmunodificeerd. De T-cellen worden zo gemanipuleerd dat ze een specifieke chimere antigeenreceptor tot expressie brengen die specifiek is voor de kankercellen van de patiënt. De T-cellen worden vervolgens opnieuw toegediend aan de patiënt en zijn nu geprogrammeerd om de kankercellen op te sporen en te doden, overeenkomstig de normale T-celfunctie. Deze en andere benaderingen om het immuunsysteem te manipuleren om de schadelijke kankercellen van de patiënt aan te vallen, vertegenwoordigen een baanbrekende klasse van therapieën om kanker te behandelen.