Een “mineraal” is een anorganische stof die is samengesteld uit één of meer chemische elementen. Per definitie moet een mineraal:
De chemische samenstelling van een mineraal staat bekend als de elementaire samenstelling. De meeste mineralen komen voor als verbindingen (een combinatie van verschillende elementen). Sommige mineralen komen echter uit zichzelf voor als chemische elementen. Deze staan bekend als natuurlijke mineralen.
Wat zijn kristallen?
Kristallen zijn vaste stoffen die een georganiseerde kristallijne structuur bezitten die uit atomen is gevormd. De interne rangschikking van atomen resulteert vaak in uitwendige platte vlakken zoals die te zien zijn op een kwartskristal, maar dit is geen vereiste om als kristal te worden geclassificeerd. Kristallen kunnen anders worden ingedeeld dan mineralen, omdat sommige materialen als organische kristallen kunnen worden beschouwd. Aangezien mineralen zuiver anorganisch zijn, kan een organisch kristal geen mineraal zijn. Zo zijn eiwitten en suikers vaste stoffen die kristallen kunnen vormen, maar omdat het organische stoffen zijn, kunnen ze niet als mineralen worden geclassificeerd.

Onzuiverheden in oplossingen die kristallen vormen, kunnen leiden tot kleurveranderingen en tot aanzienlijke veranderingen in de kristalstructuur. Te veel onzuiverheden in een kristalrooster tijdens de kristallisatie kunnen kristallen produceren met kleine tot grote insluitsels. Deze insluitsels kunnen ook de vorm van het kristal veranderen.
Mineralen, kristallen of gesteenten?
De meeste mineralen komen in de natuur voor als kristallen, maar niet alle kristallen zijn mineralen, aangezien organische kristallen helemaal geen mineralen zijn. Een mineraal met dezelfde chemische formule kan meer dan één soort kristal vormen. Er zijn bijvoorbeeld drie polymorfen (dezelfde chemische formule, verschillende kristalstructuren) van calciumcarbonaat die bekend staan als calciet, aragoniet en vateriet. Calcietkristallen komen voor in het trigonale stelsel, aragonietkristallen behoren tot het orthorhombische stelsel en vaterietkristallen vormen zich in het hexagonale stelsel. Deze kristalstructuren kunnen tijdens de vorming variëren als gevolg van verschillende factoren, waaronder onzuiverheden die de groeipatronen remmen, de temperatuur van het milieu tijdens de vorming, de verzadiging van de mineralen in de oplossing, de geometrie van de covalente bindingen en veranderingen in de beweging van de oplossing.
Mineralen hebben een natuurlijk gevormde, georganiseerde atomaire structuur met een specifieke chemische samenstelling. Kristallen zullen voor het grootste deel deze kenmerken delen, maar de atomen zijn gerangschikt in een zich herhalend patroon dat resulteert in een kristalrooster, dat zich vaak presenteert met kristalvlakken.
Vaak zul je mensen mineralen of kristallen, gesteenten horen noemen, maar een “gesteente” wordt gedefinieerd als een gebonden aggregaat van mineralen, mineraloïden of fragmenten van andere gesteenten. Het woord “gebonden” betekent dat de verzameling mineralen in zekere zin aan elkaar gecementeerd moet zijn. Zand wordt bijvoorbeeld niet als een rots beschouwd, ook al zijn zandkorrels in de meeste gevallen aan elkaar gegroepeerd. Zandsteen bijvoorbeeld is een gesteente geworden omdat de zandkorrels door fijnkorreliger mineralen en/of organisch materiaal aan elkaar zijn gecementeerd, waardoor een betrekkelijk vaste massa is ontstaan.
De drie hoofdindelingen van gesteenten zijn stollingsgesteenten, metamorfe gesteenten en sedimentgesteenten.
Igneus gesteente – gesteente dat is ontstaan door afkoeling en kristallisatie van magma in of boven de lithosfeer (aardkorst). In het magma vormen zich kristallen wanneer het begint te stollen, waarvan de snelheid van afkoeling de grootte van de gevormde kristallen kan dicteren.

Porfyrietgraniet, een stollingsgesteente, van dichtbij gezien. Porfierisch graniet ontstaat wanneer de temperatuur van het magma snel verandert. In dit geval konden zich grote kristallen vormen door langzame afkoeling, maar deze werden onderbroken door een plotselinge temperatuursverandering die het kristallisatieproces versnelde, waardoor kleinere kristallen ontstonden.
Sedimentair gesteente – gesteente dat is gevormd als gevolg van geërodeerde materialen van eerder gevormde gesteenten die zijn afgezet langs oceaanbodems, rivierbeddingen, meerbeddingen, enz., samen met afzetting van mineralen uit het water. In de loop der jaren worden deze afzettingen door natuurlijke krachten samengeperst, om later te stollen tot een vaste massa (rots).

Dit is een sedimentaire rotsformatie die deel uitmaakt van Zabriskie Point, gelegen in Death Valley, Californië. Het is samengesteld uit sedimenten van Furnace Creek Lake, dat ongeveer 5 miljoen jaar geleden opdroogde. Miljoenen jaren van erosie hebben de sedimentlagen blootgelegd.
Metamorf gesteente – gesteente dat is ontstaan toen bestaand sedimentair of stollingsgesteente werd blootgesteld aan druk- en in sommige gevallen temperatuurveranderingen die de oorspronkelijke mineralogie veranderden.

Metamorf gesteente dat bekend staat als “granietgneis”. Gevormd uit gemetamorfoseerd graniet.
Hoe worden anorganische kristallen gevormd?
Kristallen kunnen door een aantal verschillende processen worden gevormd, waaronder:
Evaporietafzettingen – Dit zijn minerale formaties die ontstaan als gevolg van processen aan het aardoppervlak. Kristallen vormen zich uit oplossingen die mineralen bevatten die geconcentreerd raken door uitdroging/verdamping van een waterige oplossing. Terwijl de vloeistof langzaam wordt verwijderd door verdamping, verzamelen de geconcentreerde mineralen zich en slaan ze neer uit het water in een gestructureerd patroon dat zich ontwikkelt tot een kristal. Een voorbeeld van neerslag zijn de roze halietkristallen uit Seamless Lake in Trona, Californië.
Secundaire mineraalafzettingen – Deze worden gevormd door het proces van blootstelling van water aan primaire ertsen, door afzetting uit hydrothermale oplossingen of worden gevormd door de kristallisatie van magma.
- Blootstelling aan primaire ertsen – Water dat in blootgestelde ertsen terechtkomt (meestal in een holte) door neerwaartse percolatie door gesteenten. Dit kan chemische processen op gang brengen die het erts afbreken en de mineralen herverdelen langs open holtewanden. Azuriet en malachiet zijn hiervan goede voorbeelden, waarbij waterige oplossingen zich door gebieden van primair kopererts hebben bewogen en deze hebben herverdeeld als azuriet- en malachietkristallen, waarvan de vormingsvereisten onder meer water, carbonaten en koper omvatten.
- Hydrothermale vloeistofafzetting – komt in de meeste gevallen voor als hydrothermale vloeistoffen zich een weg omhoog banen door gesteente, waarbij zij tijdens dit proces mineralen in het omringende gesteente opnemen. Wanneer deze vloeistoffen in een open holte terechtkomen, kan neerslag van de mineralen optreden in de vorm van kristallen en/of een vaste massa. Soms kunnen de mineralen in het omringende gesteente worden vervangen; dit verschijnsel staat bekend als een vervangingsafzetting.
- Kristallisatie van magma – treedt op wanneer magma afkoelt en de mineralen in het magma zich beginnen te scheiden in groepen van gelijksoortige en compatibele mineralen. Afhankelijk van de snelheid van afkoeling, samenstelling en atmosfeer kan de grootte van de kristallen aanzienlijk variëren. Soms kan de afkoeling te snel gebeuren, waardoor een elementaire structuur ontbreekt; obsidiaan (vulkanisch glas) is hiervan een voorbeeld. Obsidiaan (vulkanisch glas) is hiervan een voorbeeld. Obsidiaan bestaat voornamelijk uit SiO₂ (kwarts in de meeste gevallen) en heeft een chemische formule die de potentie heeft om een kristal/mineraal te zijn, maar het gebrek aan kristallijne structuur en de variabiliteit in samenstelling resulteert in de classificatie als een mineraloïde.

De mineraloïde, obsidiaan.
Mineralenklassen
De chemische samenstelling van het mineraal dicteert hoe het in de natuur zal voorkomen. Enkele van de meest voorkomende mineraalklassen volgens hun chemische samenstelling zijn:
Native Minerals – Elementen die in de natuur voorkomen met een duidelijke minerale structuur en geen combinatie met een ander element. Voorbeelden van elementen waarvan bekend is dat ze als natuurlijke mineralen voorkomen zijn goud (Au), zilver (Ag), zwavel (S), koper (Cu), grafiet ((C) – losjes verpakte koolstof) en diamant ((C) – dicht verpakte koolstof – bevat meestal enkele onzuiverheden).

Ruw Natuurlijk Diamant

Natief Zilver

Natief Koper
Oxiden – Een klasse van chemische verbindingen waarin een zuurstofion (O2-) paart met een element, in veel gevallen een positief geladen metaal. Enkele voorbeelden hiervan zijn SiO₂ – Kwarts, Fe₂O₃ – Hematiet, Cu₂O – Cupriet, enz.
Carbonaten – Mineralen die worden gekenmerkt door de aanwezigheid van een carbonaation (CO₃2-). Bindt zich meestal aan metaalkationen die in de meeste gevallen onoplosbare verbindingen vormen (niet oplosbaar in water). Enkele voorbeelden hiervan zijn CaCO₃ – Calciet/Aragoniet, FeCO₃ – Sideriet, ZnCO₃ – Smithsoniet, enz.
Silicaten – Mineralen uit een familie van anionen die zowel silicium (Si) als zuurstof (O) bevatten. Deze vormen een belangrijk bestanddeel van de gesteenten in de gehele lithosfeer (aardkorst). Enkele voorbeelden van silicaten zijn SiO₂ – Kwarts, AlKO₆Si₂ – Kaliumaluminiumsilicaat, (Fe,Mg)₂SiO₄ – Olivijn, enz.
Sulfide (Sulfide) – Anorganisch zwavelanion dat de chemische formule S^2- heeft en waarbij reacties kunnen optreden die als vrij complex worden beschouwd. De neerslag van sulfiden kan reacties met zware metalen inhouden waarbij onoplosbare metaalneerslagen worden gevormd. Enkele voorbeelden van deze zware metalen die zich vormen uit sulfide-ionen zijn FeS₂ – Pyriet, CuFeS₂ – Chalcopyriet, PbS – Galena, enz.
Sulfaten (sulfaten) – Zouten die ontstaan wanneer zwavelzuur (H₂SO₄) reageert met een andere chemische stof. Enkele voorbeelden van sulfaten zijn (Ba,Sr)SO₄ – Bariet (bariet), CaSO₄- 2H₂O – Gips, SrSO₄ – Celestijn (Celestiet), enz.
Fosfaten – Mineralen die worden gekenmerkt door hun aanwezigheid van het complexe anion (PO₄)^3-., waarvan de meeste in de natuur als vrij zeldzaam worden beschouwd. Enkele voorbeelden van fosfaten zijn Ca5(PO₄)(OH,F,CL) – Apatiet, CuAl₆(PO₄)₄(OH)₈ – 4H₂O – Turkoois, Fe(II)3(PO4)₂- 8H2O – Vivianiet, enz.
Economie van kristallen en mineralen
In de moderne tijd kan een mineraal alleen als economisch winbaar worden beschouwd als het bestaat als een concentratie van nuttige mineralen die kan worden bewerkt (gedolven) en toch winstgevend is. De concentratie moet ook hoog genoeg zijn om van de winning een lonend proces te maken. Soms kan het opraken van het mineraal in de mijn leiden tot onmiddellijke sluiting van de mijn. Hierdoor kan mijnbouw economisch gezien een extra riskante onderneming zijn.
Metalen zijn momenteel de belangrijkste economische delfstoffen, want zij worden gebruikt voor een grote verscheidenheid van moderne toepassingen. Deze metalen worden gewonnen uit metaalhoudende afzettingen die bestaan uit het erts (gezochte mineralen) en in de meeste gevallen de ongewenste, minder economische omringende mineralen die bekend staan als “ganggesteente”.
Terminologie en illustraties
Chemisch element – Een chemisch element is een materie waarvan de atomen allemaal hetzelfde aantal protonen bevatten, bekend als het atoomnummer. Het periodiek systeem is in zekere zin een sleutel die werd samengesteld door Dimitri Mendelejev, een Russisch scheikundige, om deze atomen in elementaire categorieën in te delen op basis van hun aantal protonen. Zo bevat een waterstofatoom (H) één proton, een heliumatoom (He) twee protonen, een lithiumatoom (Li) drie protonen, enzovoort.
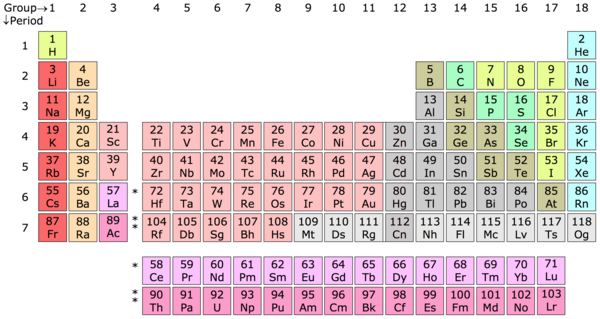
Periodiek systeem
Chemische verbinding – Bestaat uit moleculen. Om als een chemische verbinding te worden beschouwd, moet het molecuul bestaan uit nog eens twee verschillende chemische elementen die aan elkaar zijn gebonden.
Atoom – De kleinste eenheid van een chemisch element. Een atoom bestaat uit proton(en), elektron(en) en neutron(en) die samen de lading van het atoom bepalen. Atomen kunnen elektronen verliezen of winnen, wat resulteert in positieve en negatieve ladingen die ionen worden genoemd.
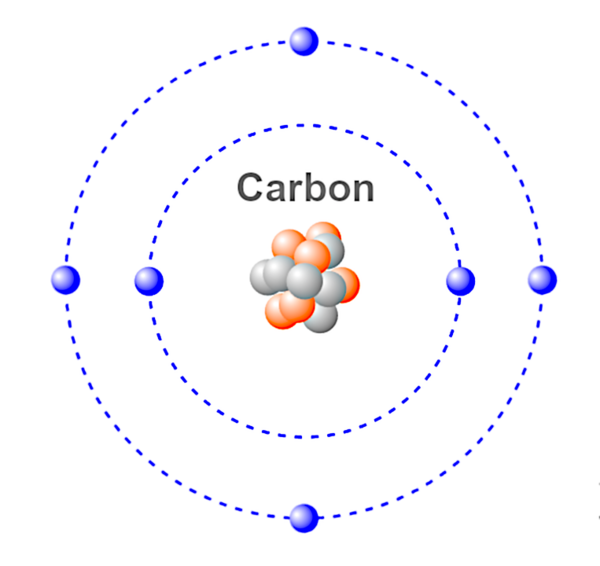
Dit is een afbeelding van een koolstofatoom.
Blauw – elektronen.
Rood &Grijs – Neutronen &Protonen.
Ion – Een atoom of molecuul met een elektrische lading die het gevolg is van een verlies of winst van een of meer elektronen.
Kation – Een positief geladen ion dat wordt aangetrokken door negatief geladen ionen. Voorbeeld – Waterstof ion H+.
Anion – Een negatief geladen ion dat wordt aangetrokken door positief geladen ionen. Voorbeeld – Carbonaat ion is CO₃2-.

Carbonaat ion chemische formule.
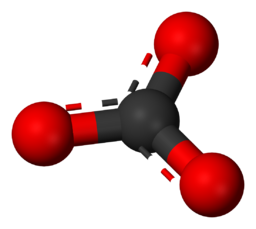
Deze afbeelding illustreert de moleculaire structuur van een carbonaation (CO₃2-) op atomair niveau.