![]()
Water heeft belangrijke effecten op alle biologische systemen. Wat water zo uniek maakt, zijn twee zeer belangrijke eigenschappen.
Water is een polair molecuul
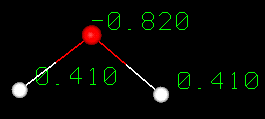 Een watermolecuul wordt gevormd wanneer twee waterstofatomen een covalente binding aangaan met een zuurstofatoom. In een covalente binding worden elektronen gedeeld tussen atomen. In water is het delen niet gelijk. Het zuurstofatoom trekt de elektronen sterker aan dan het waterstofatoom, waardoor water een asymmetrische ladingsverdeling heeft. Moleculen die uiteinden hebben met gedeeltelijke negatieve en positieve ladingen worden polaire moleculen genoemd. Het is deze polaire eigenschap die water in staat stelt polaire oplosmoleculen te scheiden en verklaart waarom water zo veel stoffen kan oplossen.
Een watermolecuul wordt gevormd wanneer twee waterstofatomen een covalente binding aangaan met een zuurstofatoom. In een covalente binding worden elektronen gedeeld tussen atomen. In water is het delen niet gelijk. Het zuurstofatoom trekt de elektronen sterker aan dan het waterstofatoom, waardoor water een asymmetrische ladingsverdeling heeft. Moleculen die uiteinden hebben met gedeeltelijke negatieve en positieve ladingen worden polaire moleculen genoemd. Het is deze polaire eigenschap die water in staat stelt polaire oplosmoleculen te scheiden en verklaart waarom water zo veel stoffen kan oplossen.
Water is zeer cohesief .
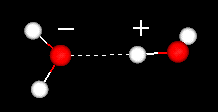 De positieve gebieden in het ene water zullen de negatief geladen gebieden in andere wateren aantrekken. De streepjes geven de waterstofbrug aan. In een waterstofbrug wordt een waterstofatoom gedeeld door twee andere atomen. De donor is het atoom waaraan de waterstof het nauwst is verbonden. De acceptor (met een gedeeltelijk negatieve lading) is het atoom dat het waterstofatoom aantrekt. Klik hier of op het plaatje links om een filmpje van twee watermoleculen te bekijken.
De positieve gebieden in het ene water zullen de negatief geladen gebieden in andere wateren aantrekken. De streepjes geven de waterstofbrug aan. In een waterstofbrug wordt een waterstofatoom gedeeld door twee andere atomen. De donor is het atoom waaraan de waterstof het nauwst is verbonden. De acceptor (met een gedeeltelijk negatieve lading) is het atoom dat het waterstofatoom aantrekt. Klik hier of op het plaatje links om een filmpje van twee watermoleculen te bekijken.
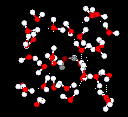 Waterstofbruggen zijn veel zwakker dan covalente bindingen. Maar als een groot aantal waterstofbruggen samenwerkt, leveren ze een sterke bijdrage. Dit is het geval in water.
Waterstofbruggen zijn veel zwakker dan covalente bindingen. Maar als een groot aantal waterstofbruggen samenwerkt, leveren ze een sterke bijdrage. Dit is het geval in water.
Zie: waterstofbruggen in water en ijs — Water- en ijswaterstofbruggen met behulp van Jsmol
Liquid water heeft een gedeeltelijk geordende structuur waarin voortdurend waterstofbruggen worden gevormd en weer verbroken.
Zie een flash-filmpje van watermoleculen in actie.
Aan de andere kant heeft ijs een starre rasterstructuur.
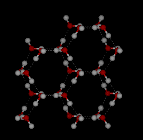
In vloeibaar water is elk molecuul waterstofgebonden aan ongeveer 3,4 andere watermoleculen. In ijs is elk molecuul waterstofgebonden aan 4 andere moleculen.
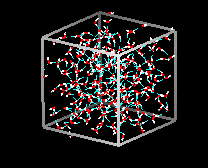
Vergelijk de twee structuren hieronder. Let op de lege ruimtes in de ijsstructuur.
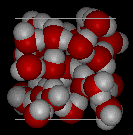
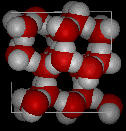
In ijs Ih vormt elk water vier waterstofbruggen met O–O afstanden van 2,76 Angstroms tot de dichtstbijzijnde zuurstofbuur. De O-O-O hoeken zijn 109 graden, typisch voor een tetraëdrisch gecoördineerde roosterstructuur. De dichtheid van ijs Ih is 0,931 g/kubieke cm. Ter vergelijking: de dichtheid van water is 1,00 g/kubieke cm.
Er zijn elf verschillende vormen van kristallijn ijs bekend. De hexaganol vorm, bekend als ijs Ih, is de enige die in de natuur voorkomt. De roosterstructuur van ijs 1h wordt hier getoond.
 Image
Image