Leerdoelen
- Relate de elektronenconfiguraties van de elementen aan de vorm van het periodiek systeem.
- De verwachte elektronenconfiguratie van een element bepalen aan de hand van zijn plaats in het periodiek systeem.
In hoofdstuk 3 “Atomen, Moleculen en Ionen” hebben we het periodiek systeem geïntroduceerd als een hulpmiddel voor het ordenen van de bekende chemische elementen. Een periodiek systeem is afgebeeld in figuur 8.11 “Het Periodiek Systeem”. De elementen zijn gerangschikt volgens atoomnummer (het aantal protonen in de kern), en elementen met vergelijkbare chemische eigenschappen zijn gegroepeerd in kolommen.
Figuur 8.11 Het Periodiek Systeem
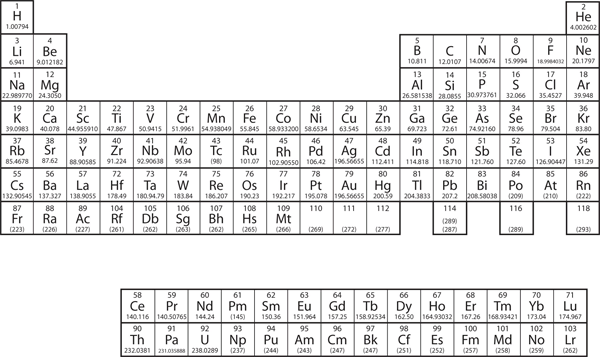
Waarom heeft het Periodiek Systeem de structuur die het heeft? Het antwoord is vrij eenvoudig, als je elektronenconfiguraties begrijpt: de vorm van het periodiek systeem bootst de vulling van de subschillen met elektronen na.
Laten we beginnen met H en He. Hun elektronenconfiguraties zijn respectievelijk 1s1 en 1s2; bij He is de n = 1 schil gevuld. Deze twee elementen vormen de eerste rij van het periodiek systeem (zie figuur 8.12 “De 1”).
Figuur 8.12 De 1s subschil
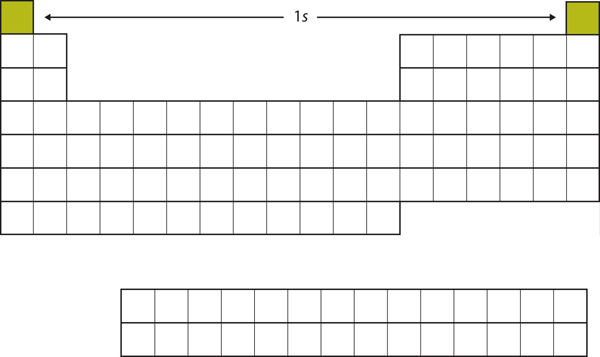
H en He vertegenwoordigen de vulling van de 1s subschil.
De volgende twee elektronen, voor Li en Be, zouden in de 2s subschil gaan. In figuur 8.13 “De 2” is te zien dat deze twee elementen naast elkaar liggen op het periodiek systeem.
Figuur 8.13 De 2s subschil
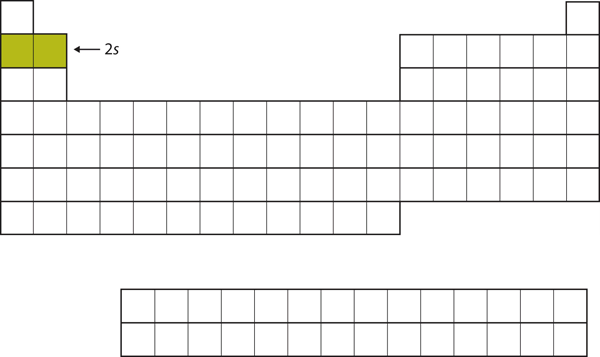
In Li en Be wordt de 2s subschil gevuld.
Voor de volgende zes elementen wordt de 2p subschil bezet met elektronen. Aan de rechterkant van het periodiek systeem zijn deze zes elementen (B t/m Ne) gegroepeerd (figuur 8.14 “De 2”).
Figuur 8.14 De 2p-dubbelschaal
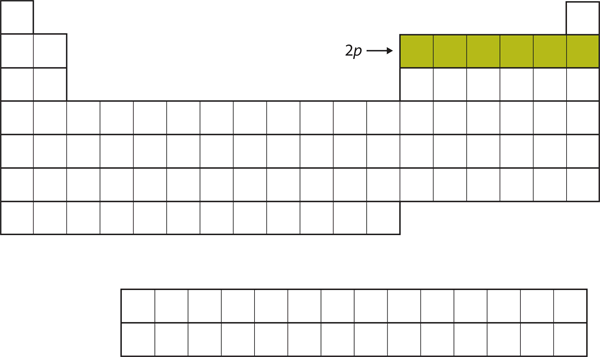
Voor B t/m Ne wordt de 2p-dubbelschaal bezet.
De volgende te vullen subshell is de 3s-subbelschaal. De elementen waarbij deze subschil wordt gevuld, Na en Mg, staan weer aan de linkerkant van het periodiek systeem (figuur 8.15 “De 3”).
Figuur 8.15 De 3s subshell
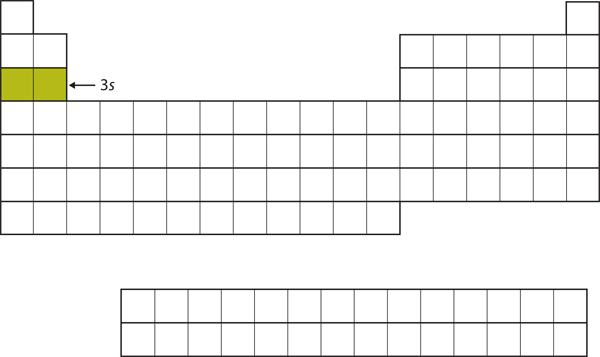
Nu wordt de 3s subshell bezet.
Daarna wordt de 3p subshell gevuld met de volgende zes elementen (figuur 8.16 “De 3”).
Figuur 8.16 De 3p-deelschaal
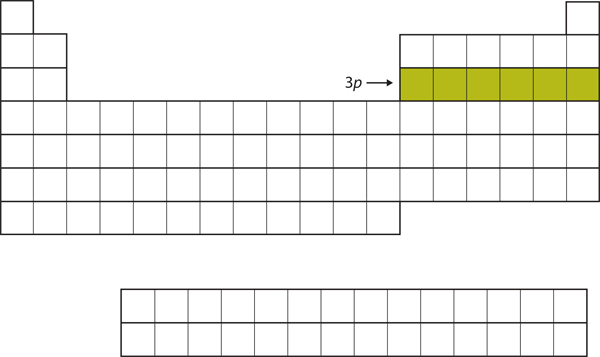
De 3p-deelschaal wordt vervolgens gevuld met elektronen.
In plaats van vervolgens de 3d-deelschaal te vullen, gaan elektronen naar de 4s-deelschaal (figuur 8.17 “De 4”).
In plaats van de 3d-deelschaal te vullen, gaan elektronen naar de 4s-deelschaal (figuur 8.16 “De 3”).17 “De 4”).
Figuur 8.17 De 4s subschil
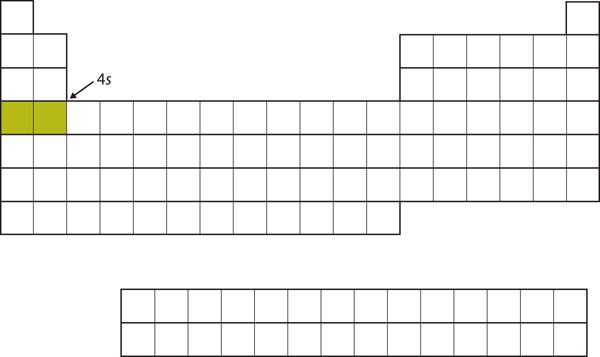
De 4s subschil wordt eerder gevuld dan de 3d subschil. Dit wordt weerspiegeld in de structuur van het periodiek systeem.
Nadat de 4s subschil is gevuld, wordt de 3d subschil gevuld met maximaal 10 elektronen. Dit verklaart de sectie van 10 elementen in het midden van het periodiek systeem (figuur 8.18 “De 3”).
Figuur 8.18 De 3d subshell
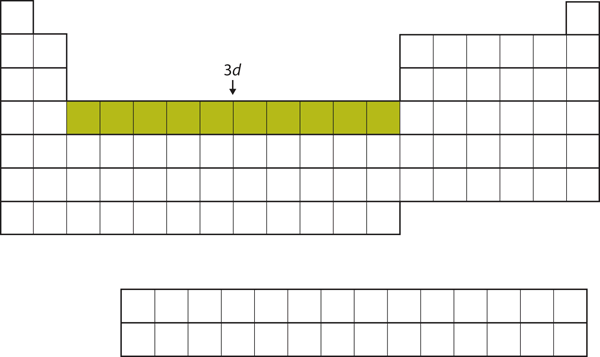
De 3d subshell is gevuld in de middelste sectie van het periodiek systeem.
Enzovoort. Als we over de rijen van het periodiek systeem gaan, geeft de algemene vorm van het systeem aan hoe de elektronen de schillen en subschillen bezetten.
De eerste twee kolommen aan de linkerkant van het periodiek systeem zijn waar de s subschillen worden bezet. Daarom worden de eerste twee rijen van het periodiek systeem aangeduid als het s-blok. Het p-blok zijn de zes meest rechtse kolommen van het periodiek systeem, het d-blok is de middelste 10 kolommen van het periodiek systeem, terwijl het f-blok het 14 kolommen tellende deel is dat gewoonlijk wordt afgebeeld als los van het periodiek systeem. Het zou deel kunnen uitmaken van het hoofdgedeelte, maar dan zou het periodiek systeem nogal lang en omslachtig worden. Figuur 8.19 “Blokken op het periodiek systeem” toont de blokken van het periodiek systeem.
Figuur 8.19 Blokken op het periodiek systeem
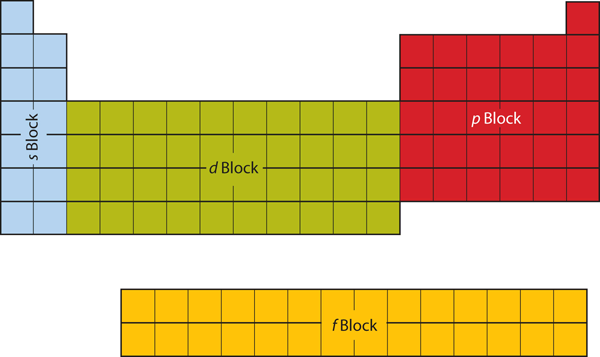
Het periodiek systeem is in blokken verdeeld, afhankelijk van welke subshell wordt gevuld voor de atomen die in die sectie thuishoren.
De elektronen in de hoogst genummerde schil, plus eventuele elektronen in de laatste ongevulde subschil, worden valentie-elektronen genoemd; de hoogst genummerde schil wordt de valentieschil genoemd. (De binnenste elektronen worden kernelektronen genoemd.) De valentie-elektronen bepalen voor een groot deel de chemie van een atoom. Als we alleen naar de elektronenconfiguratie van de valentieschil kijken, zien we dat in elke kolom de elektronenconfiguratie van de valentieschil hetzelfde is. Neem bijvoorbeeld de elementen in de eerste kolom van het periodiek systeem: H, Li, Na, K, Rb, en Cs. Hun elektronenconfiguraties (afgekort voor de grotere atomen) zijn als volgt, met de valentieschil-elektronenconfiguratie gemarkeerd:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Ze hebben allemaal een soortgelijke elektronenconfiguratie in hun valentieschillen: een enkel s-elektron. Omdat een groot deel van de chemie van een element wordt beïnvloed door valentie-elektronen, zouden we verwachten dat deze elementen een vergelijkbare chemie zouden hebben, en dat is ook zo. De organisatie van elektronen in atomen verklaart niet alleen de vorm van het periodiek systeem, maar ook het feit dat elementen in dezelfde kolom van het periodiek systeem een vergelijkbare chemie hebben.
Hetzelfde concept geldt voor de andere kolommen van het periodiek systeem. Elementen in elke kolom hebben dezelfde valentieschil elektronenconfiguraties, en de elementen hebben een aantal vergelijkbare chemische eigenschappen. Dit is strikt waar voor alle elementen in de s- en p-blokken. In de d- en f-blokken zijn gelijksoortige valentieschillen niet absoluut, omdat er uitzonderingen zijn op de volgorde van vulling van subschillen met elektronen. Er zijn echter wel veel overeenkomsten in deze blokken, zodat een overeenkomst in chemische eigenschappen wordt verwacht.
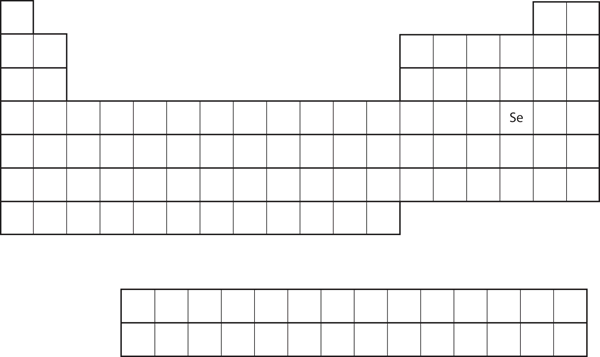
Gelijksoortigheid van valentieschil-elektronenconfiguratie impliceert dat we de elektronenconfiguratie van een atoom uitsluitend kunnen bepalen aan de hand van zijn positie in het periodiek systeem. Neem Se, zoals weergegeven in figuur 8.20 “Selenium in het periodiek systeem”. Het staat in de vierde kolom van het p-blok. Dit betekent dat zijn elektronenconfiguratie moet eindigen in een p4 elektronenconfiguratie. De elektronenconfiguratie van Se is inderdaad 4s23d104p4, zoals verwacht.
Figuur 8.20 Selenium op het periodiek systeem
Voorbeeld 8
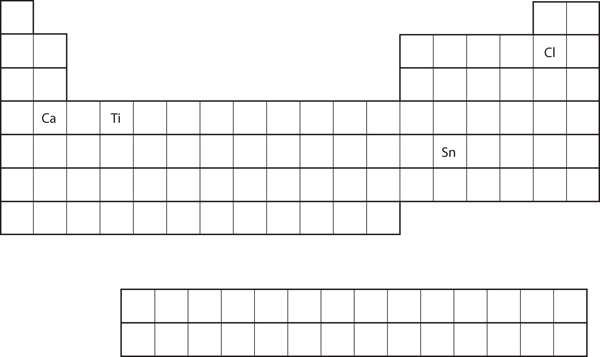
Voorspel uit de positie van het element op het periodiek systeem de valentieschil-elektronenconfiguratie voor elk atoom. Zie figuur 8.21 “Diverse elementen in het periodiek systeem”.
- Ca
- Sn
Oplossing
- Ca bevindt zich in de tweede kolom van het s-blok. We zouden verwachten dat zijn elektronenconfiguratie zou moeten eindigen op s2. De elektronenconfiguratie van calcium is 4s2.
- Sn bevindt zich in de tweede kolom van het p-blok, dus verwachten we dat zijn elektronenconfiguratie zou eindigen op p2. De elektronenconfiguratie van tin is 5s24d105p2.
Test jezelf
Vanuit de positie van het element op het periodiek systeem, voorspelt u de valentieschil-elektronenconfiguratie voor elk atoom. Zie figuur 8.21 “Diverse elementen in het periodiek systeem”.
- Ti
- Cl
Antwoord
- 4s23d2
- 3s23p5
Figuur 8.21 Verschillende elementen in het Periodiek Systeem
Voedsel en dranken App: Kunstmatige kleuren
De kleur van voorwerpen komt van een ander mechanisme dan de kleuren van neon- en andere ontladingslampen. Hoewel gekleurde lichten hun kleuren produceren, zijn voorwerpen gekleurd omdat zij bij voorkeur een bepaalde kleur weerkaatsen van het witte licht dat op hen schijnt. Een rode tomaat, bijvoorbeeld, is helderrood omdat hij rood licht weerkaatst terwijl hij alle andere kleuren van de regenboog absorbeert.
Vele voedingsmiddelen, zoals tomaten, zijn sterk gekleurd; in feite is de gebruikelijke uitspraak “je eet eerst met je ogen” een impliciete erkenning dat de visuele aantrekkingskracht van voedsel net zo belangrijk is als de smaak. Maar hoe zit het met bewerkte voedingsmiddelen?
Veel bewerkte voedingsmiddelen hebben kleurstoffen die aan hen zijn toegevoegd. Er zijn twee soorten kleurstoffen: natuurlijke en kunstmatige. Natuurlijke kleurstoffen zijn gekarameliseerde suiker voor bruin; annatto, kurkuma, en saffraan voor verschillende tinten oranje of geel; betanine uit bieten voor paars; en zelfs karmijn, een dieprode kleurstof die wordt gewonnen uit de cochenille, een klein insect dat een parasiet is op cactussen in Midden- en Zuid-Amerika. (Dat klopt: het kan zijn dat u insectensap eet!)
Sommige kleurstoffen zijn kunstmatig. In de Verenigde Staten keurt de Food and Drug Administration momenteel slechts zeven verbindingen goed als kunstmatige kleurstoffen in voedingsmiddelen, dranken en cosmetica:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- FD&C Green #3: Fast Green FCF
- RD&C Rood #3: Erythrosine
- FD&C Rood #40: Allura Rood AC
- FD&C Geel #5: Tartrazine
- FD&C Geel #6: Zonnegeel FCF
Lager genummerde kleuren zijn niet meer op de markt of zijn om verschillende redenen verwijderd. Typisch zijn deze kunstmatige kleurstoffen grote moleculen die bepaalde kleuren licht zeer sterk absorberen, waardoor ze zelfs in zeer lage concentraties bruikbaar zijn in voedingsmiddelen en cosmetica. Zelfs bij dergelijke lage hoeveelheden beweren sommige critici dat een klein deel van de bevolking (vooral kinderen) gevoelig is voor kunstmatige kleurstoffen en dringen zij erop aan dat het gebruik ervan wordt beperkt of stopgezet. Formele studies naar kunstmatige kleurstoffen en hun effecten op het gedrag hebben echter geen uitsluitsel gegeven of spreken elkaar tegen. Desondanks blijven de meeste mensen genieten van bewerkte voedingsmiddelen met kunstmatige kleurstoffen (zoals die in de bijgaande figuur).

Kunstmatige kleurstoffen worden aangetroffen in een verscheidenheid van voedingsmiddelen, zoals bewerkte voedingsmiddelen, snoep en kleurstoffen voor eieren. Zelfs dierenvoeding bevat kunstmatige kleurstoffen, hoewel het dier zich daar waarschijnlijk niets van aantrekt.
Bron: Foto met dank aan Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- De ordening van elektronen in atomen is verantwoordelijk voor de vorm van het periodiek systeem.
- Elektronenconfiguraties kunnen worden voorspeld aan de hand van de positie van een atoom op het periodiek systeem.
Oefeningen
-
Waar op het periodiek systeem worden s deelschalen bezet door elektronen?
-
Waar op het periodiek systeem worden de d-deelschalen bezet door elektronen?
-
In welk blok wordt Ra gevonden?
-
In welk blok wordt Br gevonden?
-
Wat zijn de valentieschil-elektronenconfiguraties van de elementen in de tweede kolom van het periodiek systeem?
-
Wat zijn de valentieschil-elektronenconfiguraties van de elementen in de een-na-laatste kolom van het periodiek systeem?
-
Wat zijn de valentieschil-elektronenconfiguraties van de elementen in de eerste kolom van het p-blok?
-
Wat zijn de valentieschil-elektronenconfiguraties van de elementen in de laatste kolom van het p-blok?
-
Vanuit de positie van het element in het periodiek systeem, voorspel de elektronenconfiguratie van elk atoom.
a) Sr
b) S
10. Voorspel vanuit de positie van het element op het periodiek systeem de elektronenconfiguratie van elk atoom.
a) Fe
b) Ba
11. Voorspel vanuit de positie van het element op het periodiek systeem de elektronenconfiguratie van elk atoom.
a) V
b) Ar
12. Voorspel vanuit de positie van het element op het periodiek systeem de elektronenconfiguratie van elk atoom.
a) Cl
b) K
13. Voorspel vanuit de positie van het element op het periodiek systeem de elektronenconfiguratie van elk atoom.
a) Ge
b) C
14. Voorspel uit de positie van het element op het periodiek systeem de elektronenconfiguratie van elk atoom.
a) Mg
b) I
Antwoorden
de eerste twee kolommen
het s-blok
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2