Leerdoelen
Aan het einde van dit deel zult u in staat zijn om:
- De wiskundige relaties tussen de verschillende eigenschappen van gassen kunnen identificeren
- De gecombineerde gaswet en verwante gaswetten kunnen gebruiken om de waarden van verschillende gaseigenschappen onder gespecificeerde omstandigheden te berekenen
Tijdens de zeventiende en vooral de achttiende eeuw, gedreven door zowel de wens om de natuur te begrijpen als door de wens om ballonnen te maken waarin zij konden vliegen (figuur 1), legden een aantal wetenschappers de verbanden tussen de macroscopische fysische eigenschappen van gassen, dat wil zeggen druk, volume, temperatuur en hoeveelheid gas. Hoewel hun metingen naar huidige maatstaven niet nauwkeurig waren, waren zij in staat de wiskundige relaties te bepalen tussen paren van deze variabelen (b.v. druk en temperatuur, druk en volume) die gelden voor een ideaal gas – een hypothetische constructie die reële gassen onder bepaalde omstandigheden benaderen. Uiteindelijk werden deze individuele wetten gecombineerd tot één enkele vergelijking – de ideale gaswet – die de gashoeveelheden voor gassen met elkaar in verband brengt en vrij nauwkeurig is voor lage drukken en gematigde temperaturen. We zullen de belangrijkste ontwikkelingen in de afzonderlijke relaties bekijken (om pedagogische redenen niet helemaal in historische volgorde) en ze vervolgens samenvoegen in de ideale gaswet.

Figuur 1. In 1783 vonden de eerste (a) met waterstof gevulde ballonvluchten, (b) bemande heteluchtballonvluchten en (c) bemande met waterstof gevulde ballonvluchten plaats. Toen de met waterstof gevulde ballon in (a) landde, zouden de geschrokken dorpelingen van Gonesse hem met hooivorken en messen hebben vernietigd. De lancering van de laatste werd naar verluidt bekeken door 400.000 mensen in Parijs.
Druk en temperatuur: De Wet van Gay-Lussac
Stel je voor dat je een starre container die aan een manometer is bevestigd, met gas vult en dan de container zo afsluit dat er geen gas kan ontsnappen. Als de container wordt afgekoeld, wordt het gas binnenin ook kouder en zijn druk wordt waargenomen om te verminderen. Aangezien de bol stijf is en goed is afgesloten, blijven zowel het volume als het aantal mol gas constant. Als we de bol verhitten, wordt het gas binnenin het vat heter (figuur 2) en neemt de druk toe.

Figuur 2. Het effect van de temperatuur op de gasdruk: Als de verwarmingsplaat uit staat, is de druk van het gas in de bol relatief laag. Naarmate het gas wordt verwarmd, neemt de druk van het gas in de bol toe.
Dit verband tussen temperatuur en druk wordt waargenomen voor elk gasmonster dat in een constant volume is opgesloten. Een voorbeeld van experimentele druk-temperatuur gegevens is getoond voor een luchtmonster onder deze omstandigheden in figuur 3. Wij stellen vast dat temperatuur en druk lineair verbonden zijn, en als de temperatuur op de schaal van kelvin ligt, dan zijn P en T recht evenredig (ook hier, wanneer volume en mol gas constant worden gehouden); als de temperatuur op de schaal van kelvin met een bepaalde factor toeneemt, neemt de gasdruk met dezelfde factor toe.
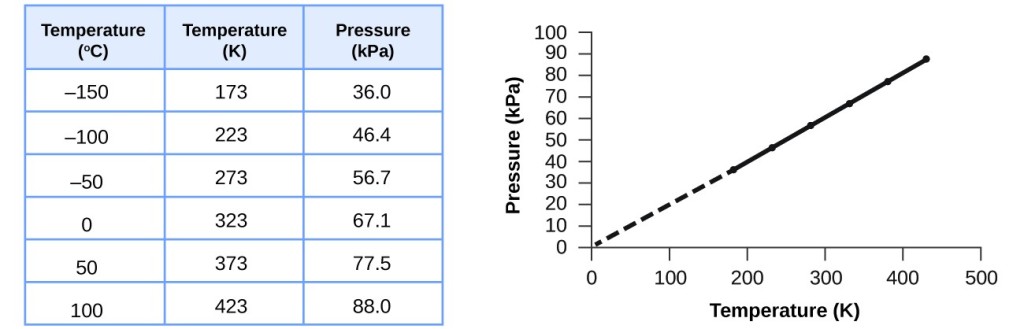
Figuur 3. Voor een constant volume en een constante hoeveelheid lucht zijn de druk en de temperatuur recht evenredig, mits de temperatuur in kelvin is. (Bij lagere temperaturen kunnen geen metingen worden verricht wegens de condensatie van het gas). Wanneer deze lijn wordt geëxtrapoleerd naar lagere drukken, bereikt zij een druk van 0 bij -273 °C, wat 0 is op de schaal van kelvin en de laagst mogelijke temperatuur, het absolute nulpunt genoemd.
Guillaume Amontons was de eerste die de relatie tussen de druk en de temperatuur van een gas empirisch vaststelde (~1700), en Joseph Louis Gay-Lussac bepaalde de relatie nauwkeuriger (~1800). Daarom staat de P-T relatie voor gassen bekend als de wet van Gay-Lussac of als de wet van Amontons. Onder beide namen wordt gesteld dat de druk van een bepaalde hoeveelheid gas recht evenredig is met de temperatuur op de schaal van Kelvin wanneer het volume constant wordt gehouden. Wiskundig kan dit worden geschreven:
Groot P=T
Groot P=Tijd T
Groot P=kTijd T
waar ∝ betekent “is evenredig met”, en k een evenredigheidsconstante is die afhangt van de identiteit, de hoeveelheid, en het volume van het gas.
Deze vergelijking is nuttig voor druk-temperatuur berekeningen voor een opgesloten gas met constant volume. Merk op dat de temperatuur op de schaal van kelvin moet liggen voor alle gaswetberekeningen (0 op de schaal van kelvin en de laagst mogelijke temperatuur wordt het absolute nulpunt genoemd). (Er zijn ten minste drie manieren om te beschrijven hoe de druk van een gas verandert als de temperatuur verandert: We kunnen een tabel met waarden gebruiken, een grafiek, of een wiskundige vergelijking.)
Volume en temperatuur: De Wet van Charles
Als we een ballon vullen met lucht en hem afsluiten, bevat de ballon een bepaalde hoeveelheid lucht bij atmosferische druk, laten we zeggen 1 atm. Als we de ballon in een koelkast zetten, wordt het gas binnenin koud en krimpt de ballon (hoewel zowel de hoeveelheid gas als de druk constant blijven). Als we de ballon heel koud maken, krimpt hij heel erg, en hij zet weer uit als hij warmer wordt.
Deze video laat zien hoe het afkoelen en verwarmen van een gas ervoor zorgt dat het volume respectievelijk kleiner of groter wordt.
Deze voorbeelden van het effect van temperatuur op het volume van een gegeven hoeveelheid van een ingesloten gas bij constante druk zijn in het algemeen waar: Het volume neemt toe als de temperatuur toeneemt, en neemt af als de temperatuur afneemt. Volume-temperatuurgegevens voor een 1 mol monster van methaangas bij 1 atm zijn opgesomd en grafisch weergegeven in figuur 4.

Figuur 4. Het volume en de temperatuur zijn lineair verbonden voor 1 mol methaangas bij een constante druk van 1 atm. Als de temperatuur in kelvin is, zijn volume en temperatuur recht evenredig. De lijn stopt bij 111 K omdat methaan bij deze temperatuur vloeibaar wordt; bij extrapolatie snijdt de lijn de oorsprong van de grafiek, die een temperatuur van het absolute nulpunt voorstelt.
Het verband tussen het volume en de temperatuur van een gegeven hoeveelheid gas bij constante druk staat bekend als de wet van Charles, naar de Franse wetenschapper en ballonvaarder Jacques Alexandre César Charles. De wet van Charles stelt dat het volume van een gegeven hoeveelheid gas recht evenredig is met de temperatuur op de schaal van Kelvin wanneer de druk constant wordt gehouden.
Mathematisch kan dit worden geschreven als:
Groot V = T
Groot V = T
Groot V = k T
waarbij k een evenredigheidsconstante is die afhangt van de hoeveelheid en de druk van het gas.
Volume en druk: Wet van Boyle
Als we een luchtdichte injectiespuit gedeeltelijk met lucht vullen, bevat de injectiespuit een bepaalde hoeveelheid lucht bij een constante temperatuur, zeg 25 °C. Als we de zuiger langzaam indrukken terwijl de temperatuur constant blijft, wordt het gas in de spuit samengeperst tot een kleiner volume en neemt de druk toe; als we de zuiger eruit trekken, neemt het volume toe en de druk af. Dit voorbeeld van het effect van het volume op de druk van een bepaalde hoeveelheid van een ingesloten gas is in het algemeen waar. Het verminderen van het volume van een ingesloten gas zal de druk verhogen, en het verhogen van het volume zal de druk verlagen. In feite is het zo dat als het volume met een bepaalde factor toeneemt, de druk met dezelfde factor afneemt, en omgekeerd. De volume-drukgegevens voor een luchtmonster bij kamertemperatuur zijn grafisch weergegeven in figuur 5.

Figuur 5. Wanneer een gas een kleiner volume inneemt, oefent het een hogere druk uit; wanneer het een groter volume inneemt, oefent het een lagere druk uit (ervan uitgaande dat de hoeveelheid gas en de temperatuur niet veranderen). Aangezien P en V omgekeerd evenredig zijn, is een grafiek van 1/P versus V lineair.
In tegenstelling tot de P-T en V-T verbanden, zijn druk en volume niet recht evenredig met elkaar. In plaats daarvan vertonen P en V een omgekeerde evenredigheid: Een toename van de druk leidt tot een afname van het volume van het gas. Wiskundig kan dit worden geschreven:
Grote P=k1{/}V\text{ of }P=k1{/}V\text{ of }{P}_{1}{V}_{1}={P}_{2}{V}_{2}
waarbij k een constante is. Grafisch wordt dit verband weergegeven door de rechte lijn die ontstaat wanneer men de inverse van de druk \groot-links(\frac{1}{P}rechts) uitzet tegen het volume (V), of de inverse van het volume \groot-links(\frac{1}{V}rechts) tegen de druk (V). Grafieken met gebogen lijnen zijn moeilijk nauwkeurig af te lezen bij lage of hoge waarden van de variabelen, en ze zijn moeilijker te gebruiken bij het aanpassen van theoretische vergelijkingen en parameters aan experimentele gegevens. Om die redenen proberen wetenschappers vaak een manier te vinden om hun gegevens te “lineariseren”. Als we P tegen V uitzetten, krijgen we een hyperbool (zie figuur 6).
De relatie tussen het volume en de druk van een gegeven hoeveelheid gas bij constante temperatuur werd meer dan 300 jaar geleden voor het eerst gepubliceerd door de Engelse natuurfilosoof Robert Boyle. Het is samengevat in de verklaring die nu bekend staat als de wet van Boyle: Het volume van een gegeven hoeveelheid gas dat bij constante temperatuur wordt gehouden, is omgekeerd evenredig met de druk waaronder het wordt gemeten.
Chemistry in Action: Ademhaling en de Wet van Boyle
Wat doe je zo’n 20 keer per minuut, je hele leven lang, zonder onderbreking, en vaak zonder je er zelfs maar bewust van te zijn? Het antwoord is natuurlijk ademhaling, of ademhaling. Hoe werkt dat? Het blijkt dat de gaswetten hier van toepassing zijn. Je longen nemen gas op dat je lichaam nodig heeft (zuurstof) en voeren afvalgas af (kooldioxide). Longen zijn gemaakt van sponsachtig, rekbaar weefsel dat uitzet en samentrekt terwijl je ademt. Wanneer u inademt, trekken uw middenrif en tussenribspieren (de spieren tussen uw ribben) samen, waardoor uw borstholte groter wordt en uw longvolume toeneemt. De toename van het volume leidt tot een afname van de druk (wet van Boyle). Hierdoor stroomt er lucht in de longen (van hoge druk naar lage druk). Wanneer u uitademt, keert het proces om: Je middenrif en ribspieren ontspannen zich, je borstholte trekt samen, en je longvolume neemt af, waardoor de druk toeneemt (weer de wet van Boyle), en lucht uit de longen stroomt (van hoge druk naar lage druk). Vervolgens ademt u weer in en uit, en herhaalt u deze cyclus van de wet van Boyle voor de rest van uw leven (figuur 7).
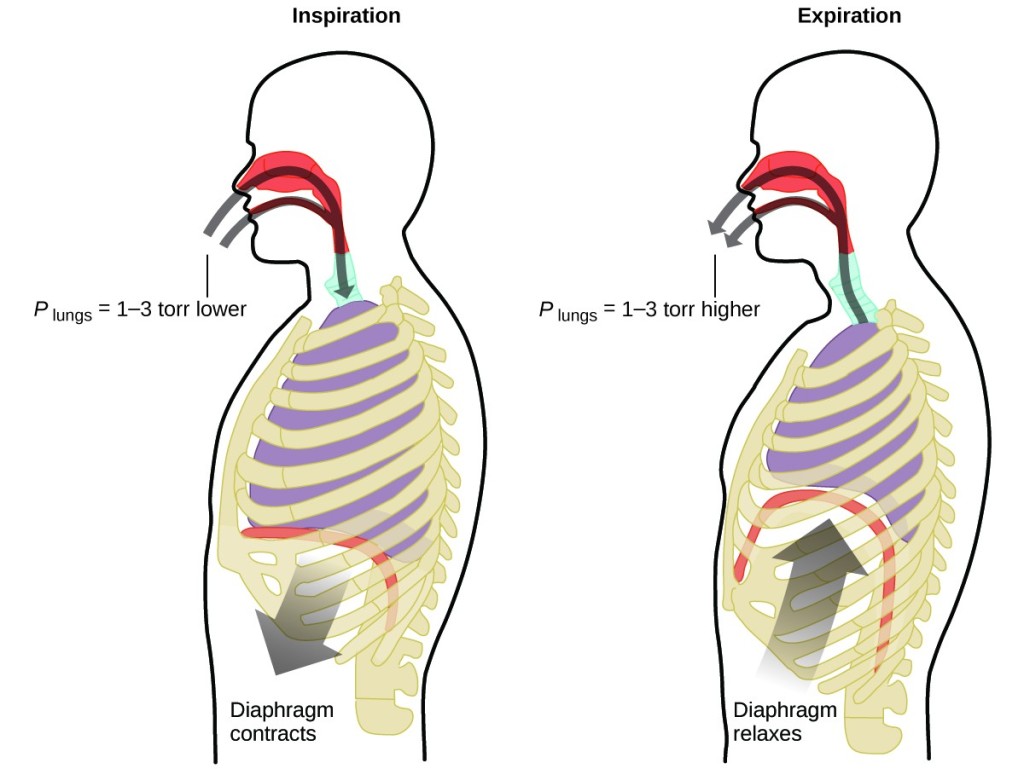
Figuur 7. Ademhaling vindt plaats doordat het uitzetten en inkrimpen van het longvolume kleine drukverschillen creëert tussen uw longen en uw omgeving, waardoor lucht in uw longen wordt gezogen en uit uw longen wordt geperst.
Gasmassa en volume: De Wet van Avogadro
De Italiaanse wetenschapper Amedeo Avogadro stelde in 1811 een hypothese op om het gedrag van gassen te verklaren. Hij stelde dat gelijke volumes van alle gassen, gemeten onder dezelfde omstandigheden van temperatuur en druk, hetzelfde aantal moleculen bevatten. Na verloop van tijd werd deze relatie ondersteund door vele experimentele waarnemingen en uitgedrukt in de wet van Avogadro: Voor een ingesloten gas zijn het volume (V) en het aantal mol (n) recht evenredig als de druk en de temperatuur beide constant blijven.
In vergelijkingsvorm wordt dit geschreven als:
V\begin{array}{ccccc}V\propto n& \text{of}& V=k\times n& \text{of}& \frac{V}_{1}}{{n}_{1}=\frac{V}_{2}}{{n}_{2}}
Mathematische relaties kunnen ook worden bepaald voor de andere variabele paren, zoals P versus n, en n versus T.
Glossary
absolute nul: temperatuur waarbij het volume van een gas nul zou zijn volgens de wet van Charles.
Wet van Avogadro: volume van een gas bij constante temperatuur en druk is evenredig met het aantal gasmoleculen
Wet van Boyle: volume van een gegeven aantal mol gas dat bij constante temperatuur wordt gehouden is omgekeerd evenredig met de druk waaronder het wordt gemeten
Wet van Charles: Het volume van een gegeven aantal mol gas is recht evenredig met de kelvin temperatuur wanneer de druk constant gehouden wordt
De wet van Gay-Lussac: (ook, wet van Amontons) druk van een gegeven aantal mol gas is recht evenredig met de kelvin temperatuur wanneer het volume constant gehouden wordt