INLEIDING
Heterozygote familiaire hypercholesterolemie (FH) is een veel voorkomende genetische aandoening die geassocieerd is met vroegtijdige atherosclerotische cardiovasculaire aandoeningen (ASCVD). Kinderen met onbehandelde FH lopen een verhoogd risico op vroegtijdige ASCVD na de leeftijd van 20 jaar.1 De ernstige verhoging van het gehalte aan lage-densiteit-lipoproteïnecholesterol (LDL-C) begint al bij de foetus en leidt tot een langdurige blootstelling van de slagaderwand aan LDL-C, wat de afzetting van cholesterol en vasculaire ontsteking versnelt en predisponeert voor het vroegtijdig ontstaan van atherosclerose, met name in de kransslagaders en de aorta.
Statines en andere lipidenverlagende therapieën (LLT’s) verlagen effectief LDL-C, zijn veilig bij kinderen en adolescenten, en herstellen de endotheelfunctie op jonge leeftijd.2-4 Onlangs is een universele screening van kinderen vanaf de leeftijd van 2 jaar en vóór de leeftijd van 8 jaar voorgesteld5,6 om personen op te sporen die behandeling nodig hebben. Deze aanpak is echter gebaseerd op theoretische overwegingen en is niet in de praktijk bewezen.
Niettemin is er weinig bekend over de kenmerken van FH-patiënten jonger dan 18 jaar, de LLT die bij deze patiënten wordt toegepast, en de lipidedoelen die in de praktijk worden bereikt. Het tekort aan informatie is nog groter voor follow-up gegevens. Nationale registers kunnen worden gebruikt om deze cruciale informatie te verstrekken, die nodig is om de zorgmodellen voor FH, de therapeutische protocollen en het gezondheidsbeleid te verbeteren.7,8 De SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) is opgezet om meer inzicht te krijgen in de prognostische factoren en mechanismen die van invloed zijn op de ontwikkeling van ASCVD en mortaliteit in een FH-populatie.
Onze doelstelling was het analyseren van patiëntkenmerken en het beoordelen van LLT- en lipidedoelen bij inclusie en tijdens follow-up bij FH-patiënten jonger dan 18 jaar die waren ingeschreven in SAFEHEART en het bepalen van de factoren die de waarschijnlijkheid van het bereiken van deze doelen voorspellen.
METHODSStudy Design and Population
SAFEHEART is een open, multicenter, landelijke, lange termijn prospectieve cohortstudie in een moleculair gedefinieerde FH-populatie in Spanje. De rekrutering van deelnemers uit FH families begon in 2004 en is nog steeds aan de gang. Inclusiecriteria waren index gevallen met een genetische diagnose van FH en hun familieleden ouder dan 15 jaar met een genetische diagnose van FH, evenals hun familieleden zonder een genetische diagnose van FH (controlegroep). Deelnemers jonger dan 15 jaar werden echter ook opgenomen, indien hun ouders daarom verzochten. Deze studie werd goedgekeurd door de lokale ethische commissies. Alle in aanmerking komende personen en/of ten minste één van hun ouders of wettelijke voogden gaven schriftelijke geïnformeerde toestemming. Een coördinerend centrum in Madrid, Spanje, was verantwoordelijk voor de follow-up van de deelnemers. Patiënten en/of hun ouders werden jaarlijks gecontacteerd via een gestandaardiseerd telefoongesprek om relevante veranderingen in levensstijl en medicatie en eventuele cardiovasculaire voorvallen of andere medische problemen te registreren. De deelnemende artsen die patiënten en gezinnen in dit register opnamen, kregen een opleiding, waarbij richtlijnen voor beste praktijken werden versterkt tijdens jaarlijkse bijeenkomsten die werden bijgewoond door artsen die deskundig waren op dit gebied; bovendien werd gebruik gemaakt van een elektronisch programma en telefonisch advies en werd een webgebaseerd opleidingsprogramma ingezet om het beheer indien nodig verder te ondersteunen. Beslissingen over de behandeling werden uitsluitend genomen door de arts van elke patiënt.
Clinische en laboratoriummetingen
Demografische en klinische kenmerken werden geregistreerd zoals elders beschreven.9 Veneuze bloedmonsters werden genomen na 12 uur vasten. Serum-, plasma- en DNA-monsters werden aliquoteerd en bewaard bij -80°C. Serum totaal cholesterol, triglyceriden, en hoge dichtheid lipoproteïne cholesterol (HDL-C) niveaus werden gemeten in een centraal laboratorium met behulp van enzymatische methoden. De serum LDL-C-concentratie werd berekend aan de hand van de Friedewald-formule. DNA werd geïsoleerd uit volbloed met behulp van standaardmethoden en FH werd genetisch gediagnosticeerd met behulp van een DNA-microarray.10 De LDL-C-doelstellingen werden gedefinieerd volgens recente aanbevelingen en doelstellingen. Lage-densiteit-lipoproteïnecholesterol
mg/dL was het primaire doel.11 Een alternatief doel voor patiënten jonger dan 14 jaar bestond uit LDL-C mg/dL bij afwezigheid van andere cardiovasculaire risicofactoren (roken, HDL-C mg/dL, lipoproteïne (a) 50mg/dL, of LDL-C 250mg/dL) of premature cardiovasculaire ziekte bij de voorouders of grootouders.6 Premature bekende ASCVD werd gedefinieerd als het optreden van een eerste voorval vóór 55 jaar bij mannen en vóór 65 jaar bij vrouwen.Lipidenverlagende therapieclassificatie
Maximale statinedosis werd gedefinieerd als atorvastatine 40 tot 80mg/d of rosuvastatine 20 tot 40mg/d, die werden beschouwd als statinedoseringen met hoge intensiteit. Maximale gecombineerde therapie werd gedefinieerd als de maximale statinedosis plus ezetimibe 10mg/d. Maximale LLT werd gedefinieerd als elke LLT die naar verwachting ten minste een vermindering van 50% van de LDL-C-baselinewaarden zou opleveren: simvastatine 20, 40, of 80mg/d plus ezetimibe 10mg/d; pravastatine 40mg/d in combinatie met ezetimibe 10mg/d; fluvastatine 80mg/d plus ezetimibe 10mg/d; atorvastatine 40 of 80mg/d met of zonder ezetimibe 10mg/d; atorvastatine 10 of 20mg/d plus ezetimibe 10mg/d; rosuvastatine 20 of 40mg/d met of zonder ezetimibe 10mg/d; rosuvastatine 10mg/d plus ezetimibe 10mg/d; en pitavastatine 4mg/d in combinatie met ezetimibe 10mg/d.12,13
Genetische analyse
Mutaties in de lage-densiteit-lipoproteïne-cholesterolreceptor (LDLR) werden op grond van hun bekende effect op de functie van het LDL-receptoreiwit ingedeeld in null-mutaties (receptornegatieve mutaties) en defect-mutaties (receptordefectieve mutaties), zoals eerder beschreven.14 Varianten die leiden tot de volledige afwezigheid of truncatie van het eiwit (functieverlies), aangetoond door in vitro functionele analyse of computersimulatie-analyse, werden ingedeeld als receptornegatief. Deze varianten omvatten: a) puntmutaties die een voortijdig stopcodon veroorzaken; b) missense mutaties die de vijfde cysteïnerijke herhaling in het ligandbindende domein van het LDL-C-receptorgen (klasse 2A-mutatie) beïnvloeden; c) kleine deleties of inserties die een frameverschuiving en een voortijdig stopcodon veroorzaken; en d) grote herschikkingen. Receptor-defectieve mutaties waren de overige inframe puntmutaties en kleine inframe deleties en inserties. Alle mutaties waarvan de functionaliteit niet bekend was door middel van in vitro studies of computersimulatie-analyse werden geclassificeerd als “onbekende functionaliteit” omdat we niet zeker konden zijn of het effect op de receptor negatief of defect was; ze werden echter wel als pathogeen beschouwd omdat alle individuen die 1 van deze mutaties droegen hypercholesterolemie hadden, terwijl familieleden zonder de mutatie normale cholesterolwaarden hadden.14
Statistische analyse
Statistische analyses werden uitgevoerd met SPSS versie 18.0 (SPSS Inc, Chicago, Illinois, Verenigde Staten). De normaliteit van de verdeling van de variabelen werd geanalyseerd met de Kolmogorov-Smirnov test. Kwantitatieve gegevens worden uitgedrukt als mediaan en interkwartielafstand (IQR) en kwalitatieve gegevens als absoluut aantal en percentage. Er werden twee populaties gedefinieerd: de populatie bij binnenkomst (n = 241) en de populatie bij follow-up (ook bekend als het cohort), dat de patiënten omvatte die bij follow-up een volledig plasmalipidenprofiel hadden (n = 217). Alle vergelijkingen tussen binnenkomst en follow-up werden uitgevoerd in het cohortonderzoek. Vergelijkingen van frequenties tussen kwalitatieve variabelen werden uitgevoerd met de chi-kwadraat toets. Veranderingen in binaire variabelen werden geanalyseerd met de McNemar test. Mediane waarden van kwantitatieve variabelen werden vergeleken met de Mann-Whitney niet-parametrische test of de gepaarde Wilcoxon signed rank test, al naar gelang het geval. Een voorwaartse binaire logistische regressieanalyse werd uitgevoerd in de cohortstudie om de variabelen te bepalen die geassocieerd waren met statinegebruik. Wij namen variabelen op die statistisch significant waren in univariate analyses, evenals a priori voorspellers en confounders: leeftijd, geslacht, en follow-up in een primaire/gespecialiseerde setting. Een andere voorwaartse binaire logistische regressieanalyse werd uitgevoerd in de cohortstudie, met uitsluiting van de patiënten die bij binnenkomst het doel bereikten, om de variabelen te bepalen die geassocieerd waren met het bereiken van LDL-C
mg/dL. Wij namen variabelen op die statistisch significant waren in univariate analyses, evenals a priori voorspellers en confounders: leeftijd, geslacht, type mutatie (nihil of defect), gebruik van ezetimibe, en follow-up in een primaire/gespecialiseerde setting. Verschillen werden als statistisch significant beschouwd bij P RESULTATEN
Tot op heden zijn 4141 deelnemers ingeschreven in het SAFEHEART-register; 392 zijn jonger dan 18 jaar. Hiervan hebben 241 een moleculaire bevestiging van FH, met 217 opgevolgd met een volledig lipidenprofiel (90,0%) (figuur 1). Vierentwintig patiënten werden uit de analyse weggelaten wegens het ontbreken van een volledig lipidenprofiel bij de follow-up. Bij 40 patiënten (18,4%) vond de follow-up plaats in een eerstelijnsgezondheidszorgomgeving. De mediane follow-up tijd was 4,69 jaar (IQR, 2,48-6,38 jaar).
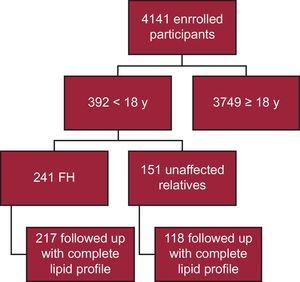
Schematisch stroomdiagram van de studie. FH, familiaire hypercholesterolemie.
Bij de inschrijving (de at-entry populatie) waren 129 FH-patiënten (53,5%) man. De mediane leeftijd was 15,0 jaar (IQR, 14,0-16,0 jaar). De 2 jongste patiënten waren 8 jaar oud. Geen van de patiënten had een voorgeschiedenis van ASCVD en 40 (16,6%) hadden een voortijdige familiaire ASCVD. De basislijn karakteristieken zijn weergegeven in Tabel 1. Een vergelijking van de basislijn karakteristieken bij inclusie tussen cohort patiënten en degenen die niet werden opgevolgd is weergegeven in Tabel 1. Er werden geen significante verschillen gevonden tussen de 2 groepen. Geen enkele patiënt had een voorgeschiedenis van ASCVD, hoge bloeddruk, of diabetes mellitus. Een groter aandeel van de groep zonder follow-up werd behandeld in de eerstelijnsgezondheidszorg, hoewel het verschil statistisch niet significant was. In het cohort waren er significante verlagingen van de plasmaconcentraties van totaal cholesterol, LDL-C, triglyceriden en non-HDL-C; bij follow-up werd ook een significante stijging van HDL-C waargenomen (tabel 2).
Baseline Kenmerken van de At-entry Population
| FH-patiënten met follow-up Median (IQR)/no. (%) |
FH-patiënten zonder follow-up Mediaan (IQR)/nr. (%) |
P | |
|---|---|---|---|
| Nr. | 217 | 24 | |
| Sekse (man) | 117 (53,9%) | 12 (50%) | .72 |
| Leeftijd, j | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Prematuur bekend ASCVD | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Actieve tabaksroker | 13 (6,0%) | 2 (8,3%) | .65 |
| Xanthoma’s | 1 (0,5%) | 0 (0,0%) | .99 |
| Corneale arcus | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21.09 (19.40-22.80) | 20.79 (17.80-22.70) | .64 |
| Stomtrek, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Totaal cholesterol, mg/dL | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dL | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Behandeld in de eerstelijnsgezondheidszorg | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, atherosclerotische hart- en vaatziekten; BMI, body mass index; FH, familiaire hypercholesterolemie; HDL-C, high-density lipoproteïnecholesterol; LDL-C, low-density lipoproteïnecholesterol; Lp (a), lipoproteïne (a); IQR, interkwartiel bereik; TG, triglyceriden.
Plasma Lipid and Lipoprotein Concentrations (Cohort)
| Cohort at entry | Cohort at follow-up | P | |
|---|---|---|---|
| Totaal cholesterol, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49.0 (43.0-55.0) | 50.0 (44.0-58.0) | .002 |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 |
| Non-HDL-C, mg/dL | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, hoge-densiteit-lipoproteïnecholesterol; LDL-C, lage-densiteit-lipoproteïnecholesterol; TG, triglyceriden.
Waarden zijn mediaan (interkwartiel bereik).
Functionele mutaties
We identificeerden 212 patiënten met een mutatie in LDL-C receptor genen (97,7%) en 5 patiënten met een mutatie in apolipoproteïne B genen (2,3%). Van de mutaties in LDL-C-receptorgenen werden 95 (43,8%) geclassificeerd als null-mutaties, 92 (42,4%) als defecte mutaties, en 25 (11,5%) als mutaties met onbekende functionaliteit.
Lipidenverlagende therapie en doelbereiking
Tabel 3 toont het gebruik van verschillende LLT-regimes bij binnenkomst en follow-up. De resultaten laten een significante toename zien in het gebruik van statines (44,2% bij binnenkomst en 68,2% bij follow-up), ezetimibe (8,7% bij binnenkomst en 15,2% bij follow-up), maximale statinedosis (3,3% bij binnenkomst en 13,9% bij follow-up), en maximale LLT (7,9% bij binnenkomst en 23,6% bij follow-up). De meest voorgeschreven statine bij binnenkomst (25,3%) en bij follow-up (30,3%) was de meest voorgeschreven statine.5%) was atorvastatine. Het voorschrijven van rosuvastatine nam toe (van 6,0% bij inclusie tot 20,3% bij follow-up). De mediane duur van de statinetherapie was 7,0 jaar (5,0 tot 9,0 jaar). Leeftijd bij menarche was 12,0 jaar (12,0 tot 13,0 jaar) voor meisjes die werden behandeld met statines en 12,0 jaar (11,0 tot 13,0 jaar) voor meisjes die niet werden behandeld met statines (P = .77). Er werd geen toename in lever transaminasen of creatine fosfokinase waargenomen. Fibraten en galzuursequestranten werden alleen gebruikt bij 15 patiënten bij inclusie (7,0%) en 3 patiënten bij follow-up (1,5%). Ezetimibe monotherapie zonder een statine werd gebruikt bij 18 patiënten bij inclusie (8,3%) en 24 patiënten bij follow-up (11,1%). Wat betreft therapietrouw meldden 10 patiënten (4,6%) dat zij tijdens de follow-up ten minste 1 dag per maand geen medicatie innamen. Bij multivariabele analyse was geen enkele variabele onafhankelijk geassocieerd met statinegebruik.
Lipidenverlagende therapieën en het bereiken van het LDL-C-doel (Cohort)
| Bij binnenkomst-/follow-up- | Bij entry-/follow-up+ | Bij entry-/follow-up- | Bij entry-/follow-up+ | P | |
|---|---|---|---|---|---|
| Patiënten met statines | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Patiënten op maximale statine dosis | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Patiënten op ezetimibe | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Patiënten op maximale combinatietherapie | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Patiënten met maximale LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, lage-densiteit-lipoproteïnecholesterol; LLT, lipidenverlagende therapie.
Values are n (%). – = niet aanwezig; + = aanwezig.
Zie tekst voor LLT-classificatie.
Plasma LDL-C-concentratie daalde met een gemiddelde van 12,5%, waarbij een mediane waarde van 138,0mg/dL werd bereikt bij follow-up. Lage-densiteit-lipoproteïnecholesteroldoelen, zoals gedefinieerd door de recente internationale aanbevelingen voor FH, werden bereikt bij 20,3% bij aanvang en 41,5% bij follow-up (tabel 3 en figuur 2). Wanneer een alternatief doel van LDL-C
mg/dL werd overwogen voor patiënten jonger dan 14 jaar, bereikten 8 van de 48 patiënten (16,7%) en 1 van de 6 patiënten (16,7%) het doel bij inclusie en follow-up, respectievelijk. De enige variabele die onafhankelijk geassocieerd was met het bereiken van het LDL-C-doel in de multivariabele analyse was statinegebruik (odds ratio, 13,83; 95% betrouwbaarheidsinterval, 2,98-64,15). Het type zorgverlener (specialist of huisarts), leeftijd, geslacht, lipoproteïne(a)-niveau en type mutatie waren niet geassocieerd met het bereiken van het LDL-C-doel.
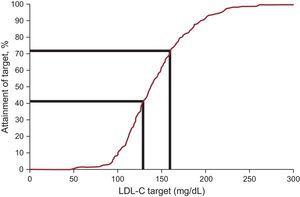
Behandelingsdoelstellingen bij patiënten met familiaire hypercholesterolemie jonger dan 18 jaar: percentage patiënten dat de LDL-C-doelstelling bereikt. LDL-C, lage-densiteit-lipoproteïnecholesterol.
DISCUSSIE
In deze studie rapporteren we de kenmerken, het LLT-gebruik en het bereiken van de LDL-C-doelstelling in een longitudinaal cohort van moleculair gedefinieerde FH-patiënten jonger dan 18 jaar die zijn ingeschreven in het SAFEHEART-register. Dit unieke register van FH-patiënten is gebaseerd op gegevens uit het echte leven in Spanje in zowel gespecialiseerde als eerstelijnszorgomgevingen. Onze resultaten tonen aan dat een LDL-C behandelingsdoel
mg/dL werd bereikt door slechts 20,3% van de patiënten bij inclusie en in 41,5% bij follow-up, met 68,2% van de patiënten op LLT. Statinegebruik was de enige factor die onafhankelijk geassocieerd was met het bereiken van het LDL-C-doel. Voor zover wij weten, heeft geen ander werk het bereiken van het doel aangetoond bij FH-patiënten jonger dan 18 jaar en deze studie is de eerste die dit in een grote populatie rapporteert.
Recentelijk analyseerde een Brits register15 207 kinderen met FH, waarbij mutaties werden geïdentificeerd bij 64% van de kinderen en werd vastgesteld dat 48% LLT onderging; er werd een vermindering van 35% van de LDL-C bereikt. De auteurs meldden echter geen resultaten wat betreft het bereiken van het doel. Een ander rapport, dat een kleine steekproef van proefpersonen (n = 89) analyseerde, toonde een LDL-C-reductie van 43% bij follow-up op lange termijn.16 Deze grotere reductie is waarschijnlijk te wijten aan een frequenter gebruik van combinatietherapie (56%). Er werden geen objectieve resultaten aangetoond. In een ander retrospectief artikel met 207 patiënten in Nederland was slechts 26% van de patiënten aan de LLT en ook hier werden geen resultaten met betrekking tot het bereiken van het LDL-C-doel gerapporteerd.17
Deze longitudinale studie toonde aan dat LDL-C-niveaus bij FH-patiënten jonger dan 18 jaar in de loop van de tijd kunnen veranderen als gevolg van LLT-wijziging en voorlichting door de arts. Het aandeel patiënten op statines, de maximale statinedosis, en de maximale LLT namen significant toe tijdens de follow-up. Interessant is dat onze gegevens erop wijzen dat ons cohort niet bevooroordeeld is, omdat er geen statistisch significante verschillen waren tussen de patiënten die niet werden gevolgd en het cohort.
Ear vroege diagnose en behandeling van FH is essentieel, vooral bij kinderen en adolescenten, om de ontwikkeling van ASCVD op volwassen leeftijd te voorkomen. Screening op FH bij kinderen is de moeite waard en moet worden uitgevoerd vóór de leeftijd van 8 jaar omdat kinderen met hypercholesterolemie een verhoogd risico lopen op vroegtijdige ASCVD. Bovendien kan screening diegenen identificeren die het hoogste risico lopen en een LLT initiëren, waarvan is aangetoond dat het het atherosclerotische proces effectief omkeert en het ASCVD risico vermindert. Kinderen met FH hebben meestal geen klinische ASCVD. Niettemin ondersteunt het bestaan van toekomstig risico het gebruik van LLT, waarbij statines de hoeksteen vormen van FH-management.18
De veiligheid en verdraagbaarheid van LLT bij pediatrische FH zijn altijd controversieel, hoewel ze vergelijkbaar zijn met die bij volwassenen.5,19,20 Onlangs meldden Ramaswami et al.15 geen veiligheidsproblemen, vergelijkbaar met onze resultaten. Niettemin is strikt toezicht aanbevolen, vooral bij patiënten die hogere doses statines krijgen. Adolescente meisjes moeten ook worden geadviseerd om de statinetherapie te staken wanneer zij een zwangerschap overwegen. Hoewel er meer gegevens nodig zijn over de veiligheid van kinderen die langdurig met LLT worden behandeld, heeft recente follow-up op lange termijn een uitstekend veiligheidsprofiel aangetoond.21 Deze bevinding wordt indirect ondersteund door onze gegevens, omdat een groot deel van de patiënten met LLT begon tijdens de follow-up en er weinig drop-outs waren. Onze resultaten laten duidelijk een verhoogd percentage patiënten zien die statines, een hoge statinedosis en maximale LLT gebruiken, met een laag percentage patiënten dat de medicatie opgeeft. Deze gegevens bevestigen de veiligheid, therapietrouw en verdraagbaarheid van statines, zelfs bij gebruik in een hoge dosering, bij FH-patiënten jonger dan 18 jaar.22 Bovendien komen onze resultaten overeen met eerdere rapporten die geen effecten op de seksuele rijping aantoonden.23 Al deze resultaten bevestigen opnieuw het concept “hoe jonger, hoe beter” met betrekking tot de ideale leeftijd om te beginnen met statines bij deze jonge FH-patiënten.23
Onze resultaten tonen een groot aantal FH-patiënten jonger dan 18 jaar en wijzen, in overeenstemming met eerdere studies,15,16 op de bereidheid van volwassen FH-patiënten om hun naaste familieleden te betrekken bij screening en registeractiviteiten. Dit weerspiegelt de ernst waarmee deze patiënten hun probleem opvatten en de impact die het advies van hun arts kan hebben op het veranderen van hun levensstijl. Een dergelijke houding bij volwassen patiënten vormt de basis van een gezonde levensstijl bij hun familieleden.24
Hoewel het meest gebruikelijke doel voor FH-patiënten jonger dan 18 jaar een LDL-C niveau lager dan 130mg/dL is, kan een alternatieve benadering bestaande uit LDL-C mg/dL worden gebruikt bij patiënten jonger dan 14 jaar, niet-rokers, met HDL-C ≥ 40mg/dL, lipoproteïne (a) mg/dL, LDL-C mg/dL, en zonder vroegtijdige cardiovasculaire aandoeningen bij de voorouders of grootouders.6 Andere recente richtlijnen bevelen een vermindering van LDL-C met 50% ten opzichte van de niveaus vóór de behandeling aan, maar voor kinderen van ≥ 10 jaar, vooral als er bijkomende cardiovasculaire risicofactoren zijn, waaronder verhoogde lipoproteïne (a), moet het LDL-C-streefcijfer mg/dL zijn.11 Onze resultaten tonen ook aan hoe moeilijk het voor deze patiënten is om lipidedoelen te bereiken.25 Bovendien was het bereiken van de LDL-C-doelstelling vergelijkbaar ongeacht of de patiënten door specialisten of door huisartsen werden behandeld. Het is dus mogelijk om voor pediatrische patiënten met FH in een eerstelijnsgezondheidszorgsetting een zorgniveau te bereiken dat vergelijkbaar is met het niveau dat door specialistische zorg wordt bereikt. Om dit doel te bereiken, is het belangrijk de nadruk te leggen op de ondersteuning die clinici krijgen via registers en speciale opleidingsprogramma’s. Registers kunnen het beheer van FH-patiënten jonger dan 18 jaar optimaliseren door de integratie van eerstelijns- en specialistische zorg mogelijk te maken en kunnen ook de gezondheidsautoriteiten ondersteunen bij de besluitvorming.8,26
Beperkingen en sterke punten
In deze grote follow-up studie van FH-patiënten jonger dan 18 jaar, was de interventie ongewijzigd ten opzichte van de door de arts van de patiënt geleverde interventie. Een betrouwbaar basislijn lipidenprofiel ontbreekt in dit register omdat sommige patiënten al werden behandeld toen ze werden ingeschreven. Bovendien kunnen de bevindingen zijn veranderd door verschillende omstandigheden, zoals verschillende levensstijlen, en een associatie met verschillende cardiovasculaire risicofactoren die de resultaten zouden kunnen hebben gewijzigd.
CONCLUSIES
SAFEHEART-registergegevens tonen aan dat een groot deel van de FH-patiënten jonger dan 18 jaar hoge LDL-C-spiegels hebben en er niet in slagen de aanbevolen LDL-C-doelstellingen te bereiken. We vonden een toename in LLT-intensiteit en een significante afname in LDL-C-spiegels tijdens de follow-up. Statinegebruik was de enige onafhankelijke voorspeller van het bereiken van de LDL-C-doelstellingen. Bovendien werden geen veiligheidsproblemen vastgesteld tijdens de follow-up. Deze resultaten wijzen erop dat veel FH-patiënten niet adequaat worden gecontroleerd en dat er nog ruimte is voor verbetering van de behandeling. Bovendien kan de follow-up van deze FH-populatie bijdragen aan de kennis over de veiligheid van levenslange LLT en de optimale leeftijd voor therapie-initiatie om de ontwikkeling van ASCVD op volwassen leeftijd te voorkomen.
FONDSING
Dit werk werd ondersteund door subsidie G03/181 van de Fundación Hipercolesterolemia Familiar, FIS PI12/01289 van het Instituto de Salud Carlos III, en subsidie 08-2008 van het Centro Nacional de Investigación Cardiovascular.
CONFLICTS OF INTEREST
Niemand verklaard.
- –
Kinderen met onbehandelde heterozygote familiaire hypercholesterolemie hebben een verhoogd risico op vroegtijdige ASCVD na 20 jaar.
- –
Statines en andere lipidenverlagende therapieën verlagen effectief de LDL-C en zijn veilig bij kinderen en adolescenten.
- –
Er is weinig bekend over de kenmerken van FH-patiënten jonger dan 18 jaar, de lipidenverlagende therapieën die bij deze patiënten worden gebruikt, en de lipidendoelen die in het echte leven worden bereikt.
- –
Dit tekort aan informatie is nog groter voor follow-up gegevens.
WAT DOET DIT STUDIE TOEVOEGEN?
- –
Een groot deel van de FH-patiënten jonger dan 18 jaar slaagt er niet in de aanbevolen LDL-C-doelstellingen te halen.
- –
Wij vonden een toename in LLT-intensiteit en een significante afname in LDL-C-niveaus tijdens de follow-up.
- –
Statinegebruik was de enige onafhankelijke voorspeller van het bereiken van LDL-C-doelstellingen en er werden geen veiligheidsproblemen ontdekt tijdens de follow-up.
- –
Deze resultaten versterken het concept van “hoe jonger, hoe beter”.