- Introduction
- Materialen en Methoden
- Deelnemers
- Study Procedures, EEG Data Acquisition, and Analysis
- Results
- Participants
- Resting State EEG
- Fp1 Kanaal Power Spectral Densities (PSDs) Vergelijking
- Fp1 Channel Resting EEG Test/Retest Comparison
- Discussie
- Author Contributions
- Funding
- Conflict of Interest Statement
- Acknowledgments
Introduction
Neurodegeneratieve aandoeningen vertegenwoordigen wereldwijd een enorme onvervulde medische behoefte en vereisen de ontwikkeling van nieuwe ziekteveranderende therapieën. Gezien de verraderlijke aard van deze aandoeningen en de hoge kosten van veel diagnostische tests, is er een grote behoefte aan op grote schaal beschikbare, betrouwbare en goedkope biomarkers om de progressie van neurodegeneratieve processen te volgen in een tijdsbestek dat geschikt is voor de ontwikkeling van geneesmiddelen. In deze context kan EEG een opmerkelijk potentieel hebben. Hoewel EEG gevoelig is voor bekende levensstijlfactoren en medicatie, heeft het veel aanzienlijke voordelen. EEG weerspiegelt synaptische activiteit, die een gemeenschappelijke noemer is voor de functionele impact van neurodegeneratieve processen. EEG is een niet-invasieve, draagbare, veilige en goedkope technologie die algemeen aanvaard is en een relatief korte acquisitietijd vereist. Kwalitatief EEG wordt routinematig gebruikt in de klinische praktijk voor de diagnose van epilepsie. Meer recent is een integratie van een kwantitatieve EEG biomarker (qEEG) en clinicus evaluatie voorgesteld voor de beoordeling van attention-deficit/hyperactivity disorder (ADHD) en heeft van de FDA (Food and Drug Administration) klasse II aanwijzing gekregen ter ondersteuning van de klinische evaluatie van ADHD (Lenartowicz en Loo, 2014; Snyder et al., 2015). qEEG is in onderzoeksstadia voor gebruik als een eindpunt in neurodegeneratieve ziekten in klinische studies. Echter, recente vooruitgang in data-analyses, interpretatie en verbeterde ruimtelijke resolutie hebben het potentieel van EEG als een betrouwbare, nauwkeurige biomarker voor neurodegeneratieve ziekteprogressie vergroot. Veel gerapporteerde observationele rusttoestand qEEG analyses ondersteunen de potentiële waarde ervan als biomarker voor de detectie van neurale handtekeningen van neurodegeneratie die optreedt bij de ziekte van Alzheimer (Babiloni et al, 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), de ziekte van Parkinson (Sarnthein en Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) en frontotemporale dementie (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
In de loop der jaren is ook de EEG-hardwaretechnologie geëvolueerd en zijn er verschillende draadloze meerkanaals systemen ontstaan die EEG- en fysiologische signalen van hoge kwaliteit leveren in een eenvoudiger, handiger en comfortabeler ontwerp dan de traditionele, omslachtige systemen. Traditionele EEG-systemen vergen langdurige montage- en aanbrengtijd, waarbij doorgaans de hoofdhuid van de patiënt moet worden geschuurd. De tijd die nodig is voor het aanbrengen en het ongemak maken deze traditionele systemen moeilijk te gebruiken bij dementiepatiënten, bij wie medewerking aan langdurige klinische procedures vaak moeilijk is. Verscheidene momenteel beschikbare draadloze systemen kunnen echter in 20 minuten of minder worden aangebracht zonder ongemak tijdens het aanbrengen en met een comfortabele pasvorm tijdens de acquisities. Gecombineerd met vooruitgang in signaaldetectie en kwantitatieve analysetechnieken, zijn draadloze systemen ideale kandidaten voor relatief snelle, verdraagbare klinische beoordeling van potentieel uitdagende dementiepopulaties, zoals gedragsvariant frontotemporale dementie, gekenmerkt door prominente gedrags- en persoonlijkheidsveranderingen.
Meer recent is er ook een groeiende markt voor draagbare consumententechnologieën die leiden tot systemen met een beperkt aantal kanalen die beschikbaar zijn voor persoonlijk gebruik, zoals meditatie- en ontspanningstraining. Het is denkbaar dat deze systemen, zij het met hun beperkte dekking, ook in geselecteerde klinische studies worden gebruikt. De toepassing van deze consumentensystemen in onderzoek naar klinische proeven is echter nog niet uitgebreid onderzocht en de nauwkeurigheid en betrouwbaarheid van deze systemen voor herhaalde metingen zijn nog niet goed vastgesteld. Verder is het niet duidelijk of de acquisitie met beperkte kanalen voldoende gegevens en anatomische dekking kan bieden om de neurale signaturen te beoordelen bij patiënten die lijden aan neurodegeneratieve ziekten.
De huidige studie was ontworpen om een eerste evaluatie te geven van het potentieel van consumenten EEG-systemen voor klinische proeven, door het gebruiksgemak, de nauwkeurigheid en de betrouwbaarheid van twee medische kwaliteit, meerkanaals draadloze EEG-systemen, B-Alert X24, en Enobio 20, te vergelijken met twee consumenten, beperkt-kanaals systemen, Muse en Mindwave.
Materialen en Methoden
Deelnemers
De studiepopulatie omvatte vijf gezonde deelnemers die voldeden aan de geschiktheid voor de studie (tabel 1). Proefpersonen werden uitgesloten indien, na controle van hun medische voorgeschiedenis, bijkomende medicatie en levensstijl (alcohol- en cafeïneconsumptie evenals rookstatus), zij niet als gezond werden beschouwd. Zij werden met name van de studie uitgesloten als zij een voorgeschiedenis van epilepsie of andere slaap-, neurologische of psychiatrische stoornissen hadden, medicijnen gebruikten of een levensstijl hadden waarvan bekend was dat die het EEG-signaal beïnvloedde, zoals roken en aanzienlijk alcohol- en cafeïnegebruik.

Tabel 1. Tabel 1. Demografische gegevens en basiskenmerken van de onderzoekspopulatie.
Verschreven geïnformeerde toestemming werd verkregen van alle deelnemers aan de studie volgens de richtlijnen voor experimenteel onderzoek met menselijke proefpersonen zoals vereist door de Chesapeake Institutional Review Board.
Study Procedures, EEG Data Acquisition, and Analysis
Om potentiële EEG-signaalvariabiliteit in verband met voedingsinname en circadiane variaties te vermijden, vonden alle bezoeken plaats in de ochtend na een standaard koolhydraatarm, eiwitrijk ontbijt (om post-prandiale slaperigheid te minimaliseren) op de Advanced Brain Monitoring (ABM) research labs studie locatie. Bovendien werden de deelnemers gevraagd om alcoholische dranken de avond vóór het studiebezoek te vermijden, evenals om te vasten en cafeïne te vermijden op de ochtend van het bezoek.
EEG-gegevens werden verkregen tijdens twee afzonderlijke bezoeken ~ 1 week na elkaar met twee meerkanaals (20 kanalen) medische EEG-systemen, B-Alert (Advanced Brain Monitoring, ABM) en Enobio (Neuroelectrics) (figuur 1, tabel 2) en twee consumentensystemen met beperkte kanalen, Muse (Interaxon, 2 kanalen) en Mindwave (Neurosky, één kanaal) (figuur 1, tabel 2) in de volgende volgorde: Muse, Mindwave, B-Alert, Enobio. Het B-Alert X24 EEG Systeem en Enobio zijn beide CE medisch gecertificeerde 20 kanaals draadloze systemen toegepast in de standaard internationale 10-20 montage en verwerven EEG signaal met een bemonsteringsfrequentie van 256 Hz. Bovendien is B-Alert door de FDA vrijgegeven voor gebruik als medisch hulpmiddel.
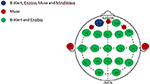
Figuur 1. Anatomische kanaalverdeling van de EEG-systemen met meerdere en met beperkte kanalen. Weergave van de gedeelde en unieke kanalen bij de vier geëvalueerde EEG-systemen. Het gemeenschappelijke kanaal voor alle vier EEG-systemen, Fp1 (blauw); kanalen uniek voor het Muse-systeem (rood); kanalen gedeeld door de meerkanaalssystemen, B-Alert en Enobio (groen).

Tabel 2. Vergelijkingen tussen EEG-systemen.
B-Alert gebruikt mastoïden als referentiekanaal. Enobio kan worden gebruikt met een mastoïdreferentie, een oorclip of op andere plaatsen op de hoofdhuid. Mindwave heeft ook een referentie op de oorclip en Muse heeft drie referentiekanalen op het voorhoofd. Alle systemen omvatten signaalkwaliteitscontrole, maar in tegenstelling tot de medische EEG-systemen, hebben beide consumentensystemen droge elektroden en geen impedantiecontrole.
Deze technologieën werden geselecteerd op basis van hun vermogen om eindgebruikers te voorzien van ruwe EEG-uitvoer via praktische en niet-kostprijsremmende toegang.
Tien minuten EEG in rusttoestand werd verworven tijdens ogen open (EO) met visuele fixatie op een kruissymbool gepresenteerd op een computerscherm (5 min), evenals terwijl ogen gesloten (EC) gedurende 5 min.
Omdat alle vier systemen alleen het FP1 kanaal (figuur 1) delen, werden EEG patronen (ruw en gedecontamineerd), spectrale vermogensdichtheden (PSD’s), en test / hertest betrouwbaarheidsvergelijkingen tussen de vier EEG-systemen geëvalueerd in de studie uitgevoerd gericht op de Fp1 elektrode in zowel EO en EC condities.
De EEG-gegevens van elk systeem werden geladen in MATLAB (Mathworks) met behulp van op maat gemaakte functies. De EEG-gegevens opgenomen tijdens pauzes en instructies werden weggegooid voor de analyse. Power spectrale dichtheid van EEG voor elke 1 s epoch werd berekend met behulp van gemodificeerde periodogram methode Welch’s met een Hamming venster taps toelopend van 1 s lengte. PSD’s werden berekend op rust EEG tijdens zowel de ogen open en ogen dicht periodes. Om gelijke eenheden (μV) mogelijk te maken, werd een correctiefactor van 1,25 (Muse), 0,25 (MindWave), of 1.000 (Enobio 20) toegepast. Alle Fp1 kanaal PSD gegevens werden gemiddeld voor de vijf proefpersonen voor elk bezoek. Test-retest werd uitgevoerd door het berekenen en plotten van Vist1/Visit2.
Results
Participants
Deelnemers waren allemaal gezonde vrijwilligers met een gemiddelde leeftijd van 27 jaar, ze waren allemaal rechtshandig en niet-rokers, en overwegend mannen (60%). Hun demografische gegevens en basislijn kenmerken zijn samengevat in tabel 1.
Resting State EEG
EEG-gegevens werden met succes verzameld van alle vier geteste systemen. Zoals verwacht, als gevolg van de droge elektroden en het beperkte aantal kanalen, de set-up tijd was aanzienlijk minder voor de consument EEG-systemen. Er was echter geen waargenomen verschil in tolerantie en acceptatie van de proefpersonen tussen de vier systemen.
Patronen van ruwe EEG-gegevens in EO (figuur 2) en EC (figuur 3) condities werden verzameld en geëvalueerd van elk systeem. Muse en Mindwave waren gevoeliger voor artefacten als gevolg van oogknipperen en spierbeweging in de frontale regio bij het openen van de ogen (figuur 2).
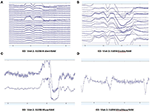
Figuur 2. Uittreksels van ruwe EO-gegevens van B-Alert (A) en Enobio (B) Muse (C) en MindWave (D) bij dezelfde deelnemer tijdens hetzelfde bezoek.
Figuur 3. Uittreksels van ruwe EC data van B-Alert (A) en Enobio (B) Muse (C) en MindWave (D) binnen dezelfde deelnemer gedurende hetzelfde bezoek.
Fp1 Kanaal Power Spectral Densities (PSDs) Vergelijking
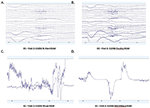
Gemiddelde PSDs in het Fp1 kanaal gemeenschappelijk voor alle vier EEG systemen voor Bezoek 1 en Bezoek 2 werden berekend en werden uitgezet voor zowel EO (Figuren 4A,B) en EC (Figuren 4C,D) condities. In de EO conditie waren B-alert en Enobio spectra ongeveer gelijk, terwijl Mindwave licht verhoogd was maar een vergelijkbare curve volgde. Een breedbandige toename van het vermogen werd waargenomen bij PSD’s die met het Muse-systeem waren verkregen. Op dezelfde manier, in de EC conditie (Figuren 4C,D), waren B-Alert, Enobio, en Mindwave PSDs gelijkaardig, maar een verhoogd breedbandig vermogen werd waargenomen voor Muse spectra, die ook een grotere variatie leken te hebben dan de andere systemen. Pieken bij 8-12 Hz (alfa-band) waren zichtbaar in de spectra die bij elk bezoek werden verkregen met de B-Alert, Enobio, en Mindwave systemen. Terwijl er een duidelijke alfa-piek was voor de Muse-vermogenspectra bij bezoek 2, werd er geen piek waargenomen in de spectra van bezoek 1.
Figuur 4. Fp1 Power Spectral Densities (PSDs) van alle vier EEG-systemen in de EO-conditie bij Bezoek 1 (A) en Bezoek 2 (B) en EC-conditie bij Bezoek 1 (C) en Bezoek 2 (D).
Fp1 Channel Resting EEG Test/Retest Comparison
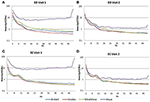
In de EC-conditie lag de power spectral ratio tussen 0,975 en 1,025 voor B-Alert, Enobio, en Mindwave (figuur 5A). De PSD-verhoudingen van het Muse-systeem varieerden meer dan die van de andere drie systemen, met verhoudingen tussen 1,125 en 1,225. In de EO-conditie bleek er iets meer variatie te zijn voor Enobio in de langzame golven Delta (1-3 Hz), Theta (3-7 Hz), en langzame alpha (8-10) en voor B-Alert en Mindwave in de snellere golven Beta (13-30 Hz) en Gamma (25-40 Hz). De verhoudingen lagen echter nog steeds tussen 0,975 en 1,05. Net als bij de EC-conditie vertoonde de test/hertest voor Muse een grotere variatie, met verhoudingen tot 1,2 (figuur 5B).
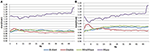
Figuur 5. Test-hertest ratio’s voor EC (A) en EO (B) conditie.
Discussie
Deze studie vergeleek het kwantitatieve EEG-signaal en de test-hertest betrouwbaarheid van medische en consumenten EEG-systemen om hun potentiële toepassing in klinisch onderzoek en klinische trials te evalueren. Nieuw gepopulariseerde EEG-systemen voor consumenten werden geëvalueerd vanwege hun lage kosten, brede toegankelijkheid, en potentieel voor thuisstudies in uitdagende populaties. Tot de populaire toepassingen van EEG-systemen voor consumenten behoren meditatie- en relaxatietraining en het omgaan met angst of pijn. Recente onderzoeken hebben hun nut buiten gaming onderzocht: NeuroSky bleek in staat om het begin van fase 1-slaap te detecteren (Van Hal et al., 2014) en er is ook interesse geweest in het beoordelen van consumenten EEG binnen hersencomputer-interfaces (Bialas en Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). De toepassing van eenvoudigere EEG-systemen (6-kanalen, bijvoorbeeld) wordt ook onderzocht voor noodsituaties (Jakab et al., 2014). Een eerdere evaluatie, hoewel gebruikmakend van een complexere headset, toonde aan dat commercieel verkrijgbare multi-lead consumenten EEG-systemen, zoals de Emotiv EPOC 16-elektrode pet, ook waarde kunnen hebben bij het evalueren van klinische omstandigheden (Schiff et al., 2016).
Deze studie leverde bewijs dat EEG-gegevens van redelijk goede kwaliteit met succes kunnen worden verzameld met consumenten EEG’s. Er waren echter verschillen in de vermogenstoename, testhertest, en vorm van de alfa-piek waargenomen bij 8-13 Hz. Mindwave vertoonde over het algemeen vergelijkbare Fp1-vermogenspectra als de medische systemen, met een lichte breedbandtoename ten opzichte van B-Alert en Enobio. Muse vertoonde een breedbandige toename in de vermogenspectra, die een weerspiegeling kan zijn van artefacten in de gegevens die door een droge elektrode zijn verkregen.
De EEG-systemen voor consumenten vertoonden een beduidend gemakkelijker en snellere instelling, die optimaal is voor het beoogde gebruik in amusement en zelfhulptoepassingen. De kwaliteit van de gegevens werd echter negatief beïnvloed door de gevoeligheid voor artefacten van de droge elektrode. Zoals verwacht was de gegevenskwaliteit vooral minder tijdens EO. Het ontbreken van de mogelijkheid om impedantietests uit te voeren en de toepassing op het frontale gebied, dat bijzonder gevoelig is voor oogknipperen en spierbewegingen bij het openen van de ogen, hebben waarschijnlijk ook bijgedragen tot deze relatieve artefacten. Bovendien is de beoordeling door EEG-systemen van de consument van nature beperkt en beperkt tot het enige anatomische hersengebied dat door de weinige kanalen wordt bestreken, zodat evaluaties van meerdere netwerken uitgesloten zijn.
Droge elektroden kunnen na verloop van tijd ook meer ongemak veroorzaken en een groter risico inhouden dat ze verkeerd op het voorhoofd worden geplaatst, wat leidt tot onnauwkeurige signaalverwerving en test/hertest. In vergelijking met apparatuur van medische kwaliteit was de betrouwbaarheid van de test/hertest lager bij EEG-systemen voor consumenten. De betrouwbaarheid werd gemeten met een test-hertest acquisitie voor alle systemen (figuur 5). Terwijl B-Alert, Enobio en Mindwave redelijk goed presteerden, had Muse een relatief lage betrouwbaarheid. Verder, terwijl een duidelijke alpha piek werd aangetoond voor Muse op Bezoek 2 (Figuur 4), suggereert de afwezigheid van een alpha piek op Bezoek 1 een gebrek aan consistentie dat te wijten kan zijn aan artefacten. Consistente betrouwbare metingen van hersenactiviteit zijn van cruciaal belang in klinische studies bij het monitoren van ziekteprogressie en het evalueren van de werkzaamheid van een experimenteel therapeuticum. Hoewel de consumentensystemen nuttig kunnen zijn voor een snelle beoordeling wanneer de tijd beperkt is, kunnen deze beperkingen van consumenten EEG hun toepassingen in onderzoek en klinische proeven belemmeren en een systeem van medische kwaliteit met hoge test-hertest betrouwbaarheid wordt aanbevolen voor gebruik als een farmacodynamisch eindpunt in klinische beoordelingen.
Ultimately, the comparison of medical and consumer EEG systems under experimental conditions highlighted differentiation in performance and, particularly, specific limitations of use that could hinder the applications of consumer systems in research and clinical trials settings. Anderzijds zijn de medische multi-lead systemen minder ideaal voor amusementsdoeleinden die een snelle opstelling en gegevensverwerking vereisen van een minimaal aantal elektroden. De belangrijkste beperking van deze studie berust op de kleine omvang van de studiepopulatie en het gebrek aan randomisatie van de volgorde van de systemen die voor de acquisitie werden gebruikt. Gegevens werden verworven in dezelfde volgorde van systemen om effecten van tijd van acquisitie die EEG als gevolg van circadiane ritmes kunnen beïnvloeden te vermijden. EEG power metrieken hebben echter bewezen zeer betrouwbaar en herhaalbaar te zijn voor individuen bij gebruik van standaard EEG systemen. Om deze reden werd de geselecteerde steekproefgrootte als informatief beschouwd.
Concluderend kan worden gesteld dat EEG-gegevens met succes kunnen worden verzameld met alle vier geteste systemen, waaronder EEG-systemen voor consumenten, met variërende beperkingen op bruikbaarheid, gegevenskwaliteit en betrouwbaarheid die hun optimale toepassingen begeleiden, waaronder in klinische proefsettings. Gevoeligheid voor artefacten en variabiliteit in test/hertest betrouwbaarheid geassocieerd met de huidige consument EEG-systemen suggereren het gebruik van medische kwaliteit EEG-systeem voor robuuste klinische cross-sectionele en longitudinale EEG dataverzamelingen.
Author Contributions
ER en AV: namen deel aan de conceptie en het ontwerp van het project, de analyse en interpretatie van de gegevens en manuscript voorbereiding. SW, CB, en GR: hebben deelgenomen aan de conceptie en het ontwerp van het project, de uitvoering ervan, de analyse en interpretatie van gegevens en manuscript voorbereiding. Alle auteurs waren betrokken bij het opstellen, schrijven en herzien van het manuscript en ze hebben allemaal de definitieve versie van het manuscript gelezen en goedgekeurd.
Funding
Deze studie werd ondersteund door Biogen.
Conflict of Interest Statement
ER en AV: Biogen medewerker. SW en CB: Advanced Brain Monitoring, Inc werknemer. GR: Neuroelectrics employee.
Acknowledgments
We willen graag de studiedeelnemers erkennen voor hun tijd en bijdragen aan deze studie. Het Biogen team heeft deelgenomen aan de opzet van de studie, de analyse en interpretatie van de gegevens, het schrijven van het rapport en de beslissing om het artikel in te dienen voor publicatie.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Corticale bronnen van elektro-encefalografische ritmes in rusttoestand bij aan de ziekte van Parkinson gerelateerde dementie en de ziekte van Alzheimer. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). “Development of EEG biomarkers for Alzheimer’s disease,” in GTC Biomarkers Summit (San Diego, CA).
Bialas, P., and Milanowski, P. (2014). A high frequency steady-state visually evoked potential based brain computer interface using consumer-grade EEG headset. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). Kwantitatief EEG en LORETA: waardevolle hulpmiddelen bij het onderscheiden van FTD van AD? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., and ChiehLee, T. (2015). Frequency power and coherence of electroencephalography are correlated with the severity of Alzheimer’s disease: a multicenter analysis in Taiwan. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Kwantitatieve EEG markers relateren aan de ernst van de ziekte van Alzheimer in de prospectieve dementie registry Austria (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). EEG dominante frequentie piek differentieert tussen de ziekte van Alzheimer en frontotemporale lobaire degeneratie. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Nieuw draadloos elektro-encefalografiesysteem met een minimale voorbereidingstijd voor gebruik in noodsituaties en prehospitale zorg. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., and Jo, S. (2015). Kwantitatieve evaluatie van een goedkope niet-invasieve hybride interface op basis van EEG en oogbeweging. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). “Deep networks using auto-encoders for PD prodromal analysis,” in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Gebruik van EEG om ADHD te diagnosticeren. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011). Anatomical substrate and scalp EEG markers are correlated in subjects with cognitive impairment and Alzheimer’s disease. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Verschillen in kwantitatief EEG tussen frontotemporale dementie en de ziekte van Alzheimer zoals onthuld door LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Investigation of resting-state EEG functional connectivity in frontotemporal lobar degeneration. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., and Soria-Frisch, A. (2016). “EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients,” in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). Hoge thalamocorticale theta coherentie bij patiënten met de ziekte van Parkinson. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Een goedkoop, gebruiksvriendelijk elektro-encefalografisch opnamesysteem voor de beoordeling van hepatische encefalopathie. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., and Johnson, R. (2015). “A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Integratie van een EEG-biomarker met de evaluatie van ADHD door een clinicus. Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). “Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017). Zijn we er al? Evaluating commercial grade brain-computer interface for control of computer applications by individuals with cerebral palsy. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., and Bossemeyer, R. (2014). Low-cost EEG-gebaseerde slaapdetectie. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., and Verma, A. (2016). “Identification of neurophysiological biomarkers of MCI using resting state, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar