- Background and Introduction
- Casuspresentatie
- Discussie
- Pathofysiologie van ADI
- Literatuursearch
- Oorzaken van ADI
- Klinische presentatie van ADI
- Geassocieerde Complicaties van ADI
- Beheersbenaderingen van ADI
- Conclusie
- Data Beschikbaarheid
- Ethics Statement
- Toestemming tot deelname
- Bijdragen van de auteur
- Funding
- Conflict of Interest Statement
- Acknowledgments
Background and Introduction
Hypothalamic Adipsic Diabetes Insipidus (ADI), een zeldzaam syndroom met heterogene klinische presentatie, wordt gekarakteriseerd door een samenstel van defecten in de homeostatische mechanismen voor de waterhuishouding. Deze omvatten osmoregulatie van het dorstmechanisme, arginine vasopressine secretie, en renale vermogen om urine te concentreren. Minder dan honderd ernstige gevallen zijn wereldwijd gemeld gedurende de laatste vier decennia (1).
De behandeling van dergelijke patiënten is uiterst uitdagend omdat deze patiënten de neiging hebben te lijden aan grote schommelingen in plasmanatrium, zelfs wanneer de DI goed onder controle is (2).
Wij rapporteren een geval van ernstige ADI die postoperatief optrad na een cerebrale arterioveneuze malformatie (AVM) operatie. Wij beschrijven de mogelijke pathogenese in dit geval en geven een overzicht van de literatuur voor alle soortgelijke gerapporteerde gevallen en beschrijven de mogelijke betrokken mechanismen, klinische presentatie, acute zowel als chronische behandeling, en prognose.
Casuspresentatie
Een 27-jarige dame presenteerde zich met een linker frontale intracerebrale bloeding met intraventriculaire uitbreiding secundair aan een basale ganglia groot complex (AVM) met complexe arteriële feeders van linker middelste cerebrale slagaders (MCA), en anterieure cerebrale slagaders (ACA) met Spetzler Martin Grading Scale van 3 (3).
Na aanvankelijk herstel van decompressieve craniotomie en stolsel evacuatie operatie, onderging ze een electieve AVM excisie operatie ~ 2 weken later. Tijdens de AVM-operatie meldden de chirurgen hevige bloedingen uit de aanvoerende vaten (het MCA, de ACA en de choroïdale vaten) met ernstige intracerebrale bloeding en intra-ventriculaire bloeding die een massale bloedtransfusie van tot 32 eenheden intra-operatief noodzakelijk maakten. Zij werd in coma gebracht met barbituraat en geïnduceerde hypotensie om cerebraal oedeem te minimaliseren (4).
Ze begon polyurie te vertonen met grote volumes urine intra-operatief kort na de episode van overvloedige intra-operatieve bloeding. Hoewel pre-operatief haar natriumconcentraties normaal waren, waren de natriumconcentraties onmiddellijk (binnen het eerste uur) postoperatief hoger binnen het bereik van 151-160 mmol/L in combinatie met een lage osmolaliteit van de urine <130 mosm/L. Voorbijgaande DI werd overwogen en zij werd gestart met intraveneus desmopressine (IV desmopressine) 1 mcg dat dagelijks werd toegediend samen met 3,5-4 L halve sterkte zoutoplossing infusie gedurende 3 opeenvolgende dagen.
Nadat zij echter longoedeem ontwikkelde (waarschijnlijk een gevolg van de massale bloedtransfusie intraoperatief, intraveneuze hypotone vloeistoffen, en gelijktijdig IV desmopressine) op postoperatieve dag 4, werd IV desmopressine gestaakt, en vers bevroren plasma en diuretica (intraveneus furosemide 40 mg) werden toegediend om het extra-vasculaire oedeem te verminderen. In het daaropvolgende uur begon zij opnieuw polyurie te ontwikkelen met een urineproductie van 800 mL in één uur en haar natriumconcentraties stegen naar 172 mmol/L. Met het oog op het bijkomende postoperatieve cerebrale oedeem werd besloten de natriumconcentraties gericht te verlagen, zodat de natriumdaling binnen 5-10 mmol/L/dag bleef, met een streefwaarde van 155 mmol/L. Een lage dosis van IV desmopressine 0,25 mcg werd toegediend, en een titratieregime werd voorgesteld om de urineproductie per uur op minder dan 100 mL/uur te houden. Zij had IV 0,75 mcg desmopressine nodig op postoperatieve dag 5, en vervolgens IV 0,25 mcg tweemaal daags op dag 6 toen zij een streefwaarde van 155 mmol/L had bereikt. Deze natriumconcentratie kon met de desmopressinedosering nog 2 dagen worden gehandhaafd.
Op dag 9, postoperatief, werd desmopressine gestaakt omdat zij in staat was om een lage urineproductie te handhaven zonder desmopressine, en de natriumconcentraties stabiel waren. In dit stadium werd aangenomen dat zij het syndroom van inadequate antidiuretische hormoonafscheiding (SIADH) had ontwikkeld en werden de vloeistoffen beperkt tot 1 liter per dag. Haar natriumconcentraties bleven stabiel op 134-138 mmol/L gedurende deze week.
Op postoperatieve dag 14 ontwikkelde ze opnieuw polyurie met stijgende natriumconcentraties en serum osmolaliteit. Op dit moment werd IV desmopressine hervat met 0,25 mcg tweemaal daags. De natriumconcentraties konden op 138-150 mmol/L worden gehouden met IV desmopressine (0,25 mcg tweemaal daags) en vloeistoffen. Ze had een triphasische fase doorgemaakt met een periode van voorbijgaande DI, gevolgd door SIADH, en vervolgens permanente DI (zie figuur 1). De serum cortisol, groeihormoon, insuline-achtige-groeifactor-1, schildklierfunctie, en prolactine niveaus waren allemaal binnen het normale bereik.

Figuur 1. Grafiek met alle seriële metingen bij onze patiënte gedurende de ziekenhuisopname.
Na een ventriculoperitoneale shuntplaatsing (gedaan om de intracraniële druk op peil te houden) 6 weken na de AVM-excisie, werd ze overgeplaatst naar de revalidatieafdelingen en werd het intraveneuze desmopressine regime omgezet in een subcutaan (SC) regime (zie figuur 1). Toen de nasogastrische sondevoeding werd gestaakt, probeerden we de vloeistoffen te reguleren door dorst. Bloedonderzoek toonde stijgende natriumspiegels tot 165 mmol/L en zij had geen dorst tijdens deze periode van hypernatriëmie ondanks een serum osmolaliteit van 350 mosm/kg. Zij bleef adipsisch ondanks herstel van afasie. Er werd geen dorstschaal gebruikt, omdat ze bij navraag verbaal zei dat ze helemaal geen dorst had, en een dorstschaal kon niet worden toegepast. Daarom moesten de vloeistoffen worden gereguleerd om de natriumbalans te handhaven. Haar urineproductie was vast en haar natriumbalans goed geregeld op een SC regime van desmopressine 0,5 mcg in de ochtend en 0,375 mcg ’s nachts, met gereguleerde vloeistoffen van 1,5-2 L per dag. Ze had geen aanwijzingen voor thermoregulatoire stoornissen. Polyetheretherketone (PEEK) cranioplastie werd ~4 maanden na de initiële operatie uitgevoerd.
Na 5 maanden van intensieve multidisciplinaire revalidatie had ze nog steeds een niet-functionele dominante rechterhand en significante cognitieve stoornissen, en een veilige dosering en zelftoediening van subcutane desmopressine was niet mogelijk op de lange termijn.
Een proef met nasaal desmopressine en oraal desmopressine toonde een significante variabele absorptie die leidde tot grotere fluctuaties in de natriumconcentraties. Hierna besloten we de sublinguale desmopressine te gebruiken die beschikbaar is als desmopressine Melt. Na verschillende doseringsschema’s te hebben uitgeprobeerd, slaagden wij erin de urineproductie vast te stellen op ongeveer 2 L/dag met desmopressine Melt oraal lyophilizaat 120 mcg (2 tabletten) ’s morgens en 60 mcg (1 tablet) ’s avonds. Bij deze dosis had zij echter hyponatriëmie op bepaalde tijdstippen van de dag. We hebben de dosis verder getitreerd door de desmopressine tabletten met een pincet of een tang uit de blisterverpakking te halen en de tabletten met behulp van een pillensnijder in stukjes van precies een kwart (elk 15 mcg) te snijden. Met een regime van 90 mcg (1,5 tablet) in de ochtend en 75 mcg (1,25 tablet) in de avond bereikten we vergelijkbare resultaten als met het subcutane regime. Met dit regime, en een gereguleerde vochtinname van 2 liter per dag, werden haar natriumconcentraties binnen het bereik van 135-150 mmol/L gehouden zonder grote schommelingen of cognitieve symptomen. Deze dosering stond haar ook toe om overdag verhoogde activiteit te hebben voor revalidatie en ze was in staat om goed te slapen zonder gestoord te worden door polyurie ’s nachts.
Zie figuur 1 voor de seriële natriummetingen bij deze patiënte gedurende de hospitalisatieperiode met de hierboven beschreven gebeurtenissen.
Gezien de klinische voorgeschiedenis en het feit dat haar hypofyse en hypothalamus grotendeels intact zijn, is het onwaarschijnlijk dat ze significante defecten had in de baroregulatie.
Discussie
Pathofysiologie van ADI
In fysiologische omstandigheden worden plasma natrium, osmolaliteit, en waterbalans binnen nauwe marges gehouden secundair aan een zorgvuldig samenspel tussen dorst en waterinname, neurohypophyseal vasopressine secretie, en de antidiurese bij de renale distale collecterende tubuli.
Perifere signalen (oropharyngeale, darm osmosensoren, osmolaliteit van het bloed) coderen informatie over de huidige toestand van hydratatie in real time en deze worden centraal geïntegreerd (5). Een toestand van uitdroging zal leiden tot stimulerende signalen naar het subfornicaal-orgaan (SFO), dat hiërarchisch signalen zendt naar het organum-vasculosum van de lamina terminalis (OVLT), en de mediane preoptische nucleus (MnPO) (6). De MnPO, die als “centrale detector” kan fungeren, zendt stimulerende signalen naar de hypothalamische kernen om de afgifte van vasopressine te verhogen en zendt ook een verhoogd dorstsignaal via de SFO en OVLT (7, 8). De dorst gerelateerde neurale paden die de SFO en OVLT verbinden met de cingulate en insulaire cortex resulteert in de bewuste perceptie van dorst (7, 8). In de toestand van adequate hydratatie daarentegen, leiden de signalen van de perifere sensoren tot een remming van deze gebieden, en negatieve feedback van het MnPO leidt tot onderdrukking van de dorst en een lagere vasopressine secretie en afgifte (rode circuit). In feite, neuronen in de MnPO, OVLT, en SFO zijn uitgebreid en wederzijds met elkaar verbonden, omdat optogenetische en chemogenetische activering van neuronen in een van deze gebieden kan de dorst te stimuleren (9). Verstoring van de bloedtoevoer met celbeschadiging tot gevolg zal dus leiden tot adipia. Gevallen van ADI als gevolg van auto-immuniteit tegen neuronale cellen van de SFO en OVLT zijn ook gepubliceerd, wat wijst op het functionele belang van deze neuronale sensoren in de dorstcontrole (10).
De AVP neuronen vertonen “fasische” activiteit van actiepotentialen met intervallen waarin AVP wordt vrijgegeven aan de axon terminals. De afgifte van vasopressine wordt gereguleerd door de osmosensorische input van het MnPO, via baroreceptoren en er is ook een anticiperende regulatie waarbij de vasopressine-afgifte wordt gestimuleerd vóór de maaltijd (prandiaal), bij hyperthermie en in een circadiaans patroon (11). Er is een circadiaan dagelijks patroon van vasopressine-afgifte in de circulatie met een toename van de niveaus tussen 24:00 en 02:00 uur en een geleidelijke afname van de niveaus gedurende de dag met een dieptepunt tussen 16:00 en 20:00 uur (12). Deze circadiane toename om middernacht, veroorzaakt door een toename van de vasopressine-afgifte, is gedeeltelijk het gevolg van een versterkte synaptische excitatie van magnocellulaire neurosecretieve neuronen door de suprachiasmatische kern, waarvan bekend is dat zij het circadiane ritme reguleert (11). Bij ADI is de osmosensorische regulatie van de vasopressine secretie het meest aangetast en andere effecten kunnen variëren, afhankelijk van de plaats en de omvang van het letsel, terwijl bekend is dat de baroreceptor respons bij veel patiënten met beperkt letsel behouden blijft, zoals in één studie is aangetoond (13).
AVP werkt via vasopressine-2 (V2) receptoren op de renale collecterende kanalen om de waterpermeabiliteit te verhogen, wat leidt tot verminderde urinevorming. De reabsorptie van water wordt geregeld door regulatie van het waterkanaal, aquaporine-2 (AQP2). AVP induceert op korte termijn intracellulaire translocatie van AQP2-dragende vesikels naar de apicale plasmamembraan en reguleert zo de AQP2-trafiek. Op de lange termijn, met adequate AVP concentraties, reguleert het de transcriptie van het AQP2 gen om de overvloed aan AQP2 eiwitten in de verzamelbuis te verhogen (14). Bij ADI stellen wij dat het waarschijnlijk is dat de acute osmosensorische respons meer wordt beïnvloed dan de chronische respons. Vandaar dat er een relatieve overvloed van aquaporine zal zijn, maar de acute trafficking naar het apicale membraan zal worden beïnvloed.
Zie figuur 2 voor een gedetailleerde illustratie van de mechanismen.
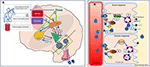
Figuur 2. Schematische weergave van de regulering van de vochtbalans bij de mens. (A) De controle en regulering van de vasopressine secretie in de hersenen. (A) Perifere signalen (orofaryngeale, darmosensoren, osmolaliteit van het bloed) coderen informatie over de huidige staat van hydratatie in real time (1) en centraal geïntegreerd (2). Een toestand van uitdroging leidt tot stimulerende signalen naar de SFO die hiërarchisch signalen zendt naar de OVLT en de MnPO (3). De MnPO, die als “centrale detector” kan fungeren, zendt stimulerende signalen naar de hypothalamische kernen om de afgifte van vasopressine te verhogen (4), en zendt ook een verhoogd dorstsignaal via de SFO en de OVLT (5, blauwe schakeling in het diagram). Daarentegen is er in de toestand van adequate hydratatie signalen van de perifere sensoren, een remming van deze gebieden en negatieve feedback van MnPO wat leidt tot onderdrukking van dorst en lagere vasopressine secretie en afgifte (rode circuit 6). De dorst gerelateerde neurale paden die de SFO en OVLT verbinden met de cingulate en insulaire cortex resulteert in de bewuste perceptie van dorst (7). In adipsische DI, bij afwezigheid van osmosensorische stimuli zijn geassocieerde neurale circuits als gevolg van celbeschadiging, stimulerende afgifte, of inhibitie van vasopressine en de bewuste perceptie van dorst beide verstoord. (B) Het werkingsmechanisme van vasopressine op de nierverzameltubuli. (B) Vasopressine in de bloedcirculatie hecht zich aan de vasopressine receptor 2 op het luminale oppervlak van de hoofdcellen van de distale verzamelbuis in de nieren (1). In de acute fase vormt het via synthese van cAMP uit ATP door AC (adenylaat cyclase) proteïne kinase A (2) dat de translocatie van aquaporine stimuleert van het opslagblaasje naar het apicale membraan en het luminale oppervlak van het bloed (3). Hierdoor wordt water in de cel getransporteerd (4) en vervolgens in de circulatie opgenomen (5). In de chronische fase, via cAMP gemedieerde transcriptionele controle van het aquaporine gen (6) kunnen verhoogde niveaus van het aquaporine waterkanaal in de hoofdcellen worden gevonden (7). Bij adipsische DI is de acute respons waarschijnlijk meer aangetast dan de chronische respons, omdat de osmosensorische gerelateerde vasopressine secretie is aangetast.
Literatuursearch
We voerden een systematische literatuursearch uit met inbegrip van Pubmed, Scopus en Embase voor gevallen die als case report of case series van ADI zijn gerapporteerd van de jaren 1980 tot 2018. We gebruikten de zoekterm: Adipsia, Adipsic disorder, en Adipsic DI en we beperkten de zoekactie tot de Engelse taal en tot Humans. We doorzochten ook alle andere referenties die geïdentificeerd werden tijdens het lezen van elk case report/case series. Wij vonden 25 referenties (10, 13, 15-39) met een totaal van 45 gevallen gerapporteerd in de literatuur. We hebben alle case reports samengevat in Tabel 1.
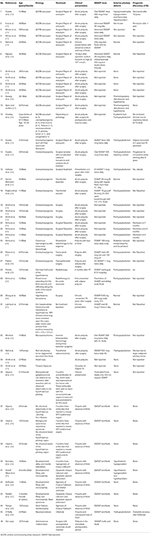
Tabel 1. Demografische gegevens, etiologie, klinische presentatie, behandeling en prognose van patiënten met adipsic diabetes insipidus gerapporteerd in de literatuur.
Oorzaken van ADI
Veertig procent (17/46) van de gevallen van ADI die in de literatuur zijn beschreven, waren secundair aan voorste communicerende slagader (ACOM) aneurysma breuk en post-chirurgische clipping met behulp van een frontale craniectomie benadering. In één geval werd de dubbele pathologie van craniopharyngioma en ACOM aneurysma beschreven (15). De arteriële toevoer van de OVLT is beschreven als afkomstig van vier bronnen (40): (1) een superieure mediane bron vertakkend van de voorste communicerende slagader, (2) en (3) twee laterale bronnen afkomstig van slagaders die aftakken van elke voorste cerebrale slagader onder de voorste communicerende slagader, en (4) een inferieure mediane bron opstijgend van onder het optisch chiasme. Kenmerkend is dat de haarvaten die dit orgaan bekleden buiten de bloed-hersenbarrière liggen, zodat een verandering in de osmolaliteit gemakkelijk door deze organen kan worden waargenomen (41). Er zij op gewezen dat verbeteringen in de chirurgische technieken en het gebruik van coiling in plaats van clipping deze complicaties kunnen verminderen. Voor patiënten in goede klinische omstandigheden met gescheurde aneurysma’s van de voorste circulatie die geschikt zijn voor coiling, blijkt uit gegevens van een meta-analyse dat coiling geassocieerd is met een beter resultaat (42). In vergelijking met clipping waarbij beide uiteinden van de ACA worden geclipt met onderbreking van de bloedtoevoer naar de hypothalamus, is de procedure van het inbrengen van een spoel in het aneurysma in staat om de toevoerleidingen naar de hypothalamus in de meeste gevallen te behouden.
De tweede oorzaak van ADI is beschreven als suprasellair craniofaryngioom (17/46). In deze gevallen gaat het vaak om een trans-frontale excisie en herstel na de operatie is in sommige gevallen beschreven. Een geval van caverneus hemangioom met soortgelijke manifestatie na een bloedingsepisode is ook beschreven (26).
Hypothalamische tumoren inclusief hamartoom, pijnappelkliertumor, en kiemceltumor kunnen zich presenteren met ADI (26, 29, 30). Een geval van hepatocellulair carcinoom met metastase naar de hypothalamus en als gevolg daarvan ADI is gemeld (31).
Interessant is dat slechts twee gevallen van hypofysetumoren met ADI zijn beschreven (18, 32). Beide gevallen hadden een agressieve tumor met meervoudige trans-frontale resectie en intracraniële bloeding intra-operatief. Eén geval is ook beschreven in relatie tot hoofdletsel en blootstelling aan tolueen (13).
Vier gevallen zijn beschreven met plotselinge acute presentatie van polyurie en hypernatremie. Deze patiënten hadden geen structurele afwijkingen in de hypothalamus en gedetailleerd onderzoek toonde bewijs van antilichamen tegen de OVLT-organen. In deze gevallen is een onderliggende auto-immuunpathologie gepostuleerd (10, 33).
Congenitale of vroegkinderlijke gevallen bij patiënten met ontwikkelingsproblemen van het corpus callosum zijn ook beschreven met manifestatie van ADI (34-38). Een geval van neurosarcoïdose waarbij de voorste hypofyse, de achterste hypofyse en de hypothalamus uitgebreid waren aangetast, met ADI, is ook beschreven (39).
Klinische presentatie van ADI
De klinische presentatie in de meeste beschreven gevallen is polyurie in de onmiddellijke week na chirurgisch knippen voor AVM of na craniotomie. De biochemische presentatie is hypernatriëmie met verhoogde osmolaliteit van het serum in aanwezigheid van onaangepaste verdunde urine in grote volumes. Als het dorstgevoel wordt beoordeeld met behulp van een dorstschaal, melden deze ADI-patiënten weinig of minimale dorst ondanks de hypernatriëmie. Interessant is dat deze patiënten een normale reactie op hypotensie hebben en dat hun baroreceptor mechanisme intact is (13).
Onze patiënt doorliep een driefasige fase van initiële DI, gevolgd door SIADH en vervolgens permanente DI. Dit patroon beschreven als triphasic respons is beschreven na hypofyse en craniopharyngioma operaties. De pathofysiologie van de driefasige respons lijkt te worden verklaard door vroege hypothalamus dysfunctie (gekenmerkt door polyurie en hypernatriëmie), vervolgens vrijkomen van voorgevormde vasopressine uit de opslagblaasjes in de hypofyse achteraan (niet gerelateerd aan enige stimulus) (gekenmerkt door SIADH) en, tenslotte, uitputting van de vasopressine voorraden (permanente DI) (43). Bij onze patiënt is het waarschijnlijk dat in de derde fase de deficiëntie in de respons op osmolaliteit in de afgifte van vasopressine wordt ontmaskerd nadat SIADH is opgelost, in plaats van een absolute depletie van vasopressine.
Geassocieerde Complicaties van ADI
Weinig casusrapporten hebben thermoregulatoire stoornissen beschreven. Panhypopituitarism is gemeld in craniopharyngioma gevallen en in hypofysetumor gevallen alleen en was niet aanwezig in onze patiënt.
Hoewel niet consequent gemeld, andere belangrijke complicaties van de hypernatremie omvatten diepe veneuze trombose; vandaar laag moleculair gewicht heparine kan worden geïndiceerd tijdens acute ziekte en immobilisatie (18).
Hypothalamus obesitas en slaap apneu is ook vaak gemeld (18). In één case-serie (13), waarin zij de AVP-respons op hypotensie evalueerden, vonden zij dat de patiënten met craniofaryngiomen ook een verlies van baro-gereguleerde AVP-respons hadden. Deze patiënten hadden aanwijzingen voor panhypopituitarisme, wat erop wijst dat de operatie aan hun tumoren meer wijdverspreide schade aan de hypofyse had achtergelaten, met inbegrip van de achterste hypofyse die de laatste gemeenschappelijke route voor AVP-secretie is.
Beheersbenaderingen van ADI
Het beheer van deze gevallen is beschreven (15, 18). Voorlichting van de patiënt en de familie over de principes van de waterbalans en het beheer is van cruciaal belang. De waterinname kan worden vastgesteld op 1,5-2 L per dag en vervolgens kan desmopressine worden getitreerd. Dagelijks bijhouden van het gewicht is nuttig om dehydratie of overbelasting met vocht op te sporen. Het wordt aanbevolen om wekelijks plasma-natriumconcentraties te bepalen om schommelingen te controleren. Ondanks strikte controle is het moeilijk om de plasma-natriumconcentratie de klok rond zodanig te regelen dat fysiologische osmoregulatie wordt nagebootst. Gezien het risico van snelle schommelingen in de natriumconcentraties, en de symptomen van hyponatriëmie die bij het lage referentiebereik worden waargenomen, is het raadzaam de natriumconcentraties binnen het hogere referentiebereik te houden.
Desmopressine het synthetische analoog van AVP werd voor het eerst geïntroduceerd voor de behandeling van DI in 1972 (44). De meeste patiënten doen het goed met lage doses desmopressine die tweemaal daags worden gegeven. Er is een fijne balans en natrium niveaus kunnen schommelen naar zeer lage niveaus met minieme dosis-escalaties.
Onze patiënt deed het zeer goed op zeer lage doses parenterale toedieningen waarvan bekend is dat ze de laagste variabiliteit in biologische beschikbaarheid hebben (45). De absorptie van intranasale formuleringen is zeer variabel, vooral bij kinderen of volwassenen met cognitieve problemen, omdat zij de oplossing mogelijk niet op een consistente manier inhaleren (46, 47). Orale formuleringen zijn een goede optie omdat verhoging van de dosis leidt tot een langere werkingsduur, maar geen piekeffect heeft (48-50). We probeerden deze vorm in verschillende doses van 50-100 mcg, maar we vonden significante dag-tot-dag variaties in effecten met deze formulering. Sublinguale desmopressine (Minirin Melt) is sinds 2005 verkrijgbaar. Farmacologische studies hebben aangetoond dat de sublinguale route resulteert in een hogere biologische beschikbaarheid van ~60% in vergelijking met de orale route (49, 50). Verfijnde doses sublinguale desmopressine konden worden bereikt door elke 60 mcg tablet te versnijden, waardoor de dosis sublinguaal kon worden aangepast van 65 tot 90 mcg. Een vergelijkbaar farmacokinetisch profiel van dergelijke gesplitste tabletten is beschreven (51). Het is bekend dat gelijktijdige inname van voedsel de absorptiesnelheid en -omvang met 40% vermindert. Daarom is het het beste om voedselconsumptie binnen een uur voor en na toediening van sublinguale desmopressine tabletten te vermijden. Onlangs is een gedetailleerd protocol voor vochttoediening met dagelijkse natriumcontrole met een vaste dosis onderhuids desmopressine beschreven (28), waaruit blijkt hoe moeilijk het is om dit van dag tot dag te controleren. Een ander recent case report (27) heeft ook melding gemaakt van het gebruik van de sublinguale desmopressine vorm voor ADI in een dosis van 60 en 120 mcg per dag. Het gebruik van sublinguale desmopressine kan een nuttig alternatief zijn in gevallen waarin een optimaal effect niet kan worden bereikt met andere formuleringen. Deze patiënten vereisen een strikte controle van het dagelijkse gewicht, urinevolume en vochtinname de klok rond. Gezien de cognitieve stoornissen en de geheugenstoornissen die deze patiënten meestal hebben, hebben ze meestal een verzorger nodig om de vochtinname te controleren om ervoor te zorgen dat ze het vereiste volume drinken.
In ons overzicht van gevallen hadden 6 patiënten een remissie van ADI, waarvan 2 gerelateerd waren aan ACOM aneurysma (15, 16) en 4 gerelateerd waren aan craniopharyngioma (15, 26). Eén patiënt met neurosarcoïdose had een remissie met Infliximab-therapie (39). Dergelijke observaties kunnen suggereren dat zowel osmoreceptoren die dorst reguleren als hun efferente paden meer neuroplasticiteit vertonen dan die welke AVP productie reguleren (26).
Conclusie
ADI is een uiterst zeldzame complicatie van hypothalamus aandoeningen die resulteert in een verlies van functie in het dorstcentrum. Door de hiërarchische controle vanuit het dorstcentrum, gaat de afwezigheid van dorst ook gepaard met verlies van vasopressine regulatie en polyurie. Personen die lijden aan ADI moeten voorzichtig worden behandeld met lage doses desmopressine en vochtbalans. Met de huidige monitoring en gepersonaliseerde zorg benaderingen, is het nog steeds niet mogelijk om rond-de-klok quasi-fysiologische osmoregulatie na te bootsen.
Data Beschikbaarheid
Alle datasets gegenereerd voor deze studie zijn opgenomen in het manuscript/supplementary files.
Ethics Statement
Verschriftelijke geïnformeerde toestemming werd verkregen van de persoon (personen) voor de publicatie van alle potentieel identificeerbare beelden of gegevens die in dit artikel zijn opgenomen.
Toestemming tot deelname
We hebben schriftelijke toestemming verkregen van de nabestaanden van de patiënt om dit manuscript te schrijven en te publiceren.
Bijdragen van de auteur
RD was de primaire endocrinoloog die de vochtbalans van de patiënt beheerde, het idee conceptualiseerde, het manuscript schreef, het literatuuronderzoek deed, de gegevens verkreeg, het uiteindelijke manuscript schreef en beoordeelde. HC, AC, en JH waren coassistenten betrokken bij de behandeling van deze patiënt, en beoordeelden het uiteindelijke manuscript. HT was de anesthesist die verantwoordelijk was voor deze patiënt tijdens de intensive care fase, bedacht het idee, en beoordeelde het uiteindelijke manuscript kritisch. KC was de hoofdrevalidatiearts die verantwoordelijk was voor deze patiënt, zij heeft het idee geconceptualiseerd en het uiteindelijke manuscript kritisch beoordeeld. BB conceptualiseerde het idee en evalueerde kritisch het uiteindelijke manuscript.
Funding
RD werd gedeeltelijk ondersteund door de Center Grant van National Medical Research Council (NMRC/CG/017/2013) en National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij danken de patiënte en haar ouders voor het toestaan van het schrijven en publiceren van dit manuscript.
1. Eisenberg Y, Frohman LA. Adipsic diabetes insipidus: a review. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Abnormalities of thirst regulation. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. A proposed grading system for arteriovenous malformations. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. The use of barbiturate-induced coma during cerebrovascular neurosurgery procedures: a review of the literature. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarchical neural architecture underlying thirst regulation. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regeling van dorst en vasopressine-afgifte. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. From sensory circumventricular organs to cerebral cortex: neural pathways controlling thirst and hunger. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. The median preoptic nucleus: front and centre for the regulation of body fluid, sodium, temperature, sleep and cardiovascular homeostasis. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmuniteit voor de natriumniveausensor in de hersenen veroorzaakt essentiële hypernatriëmie. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulation of vasopressin secretion and thirst in health and disease. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. De neurale basis van homeostatische en anticiperende dorst. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulatie van vasopressineafgifte bij adipsische diabetes insipidus. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Moleculaire mechanismen die aquaporine-2 reguleren in het verzamelriool van de nier. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogene patronen van herstel van dorst bij volwassen patiënten met adipsische diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renal compensatory adaptation for water handling in a patient with adipsic diabetes insipidus after clipping of a ruptured aneurysm of the anterior communicating artery. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus after clipping of anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Hypothalamic adipsic syndrome: diagnosis and management. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsic hypernatremia and diabetes insipidus following anterior communicating artery aneurysm clipping: diagnostic and therapeutic challenges in the amnestic rehabilitation patient. Hersenletsel. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract |Ref Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Chronic hypernatremia and hypothermia following subarachnoid haemorrhage. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia and hypothermia after subarachnoid haemorrhage. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Klinische inzichten in adipsic diabetes insipidus: een grote case serie. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypothalamic obesity complicated by adipsic central diabetes insipidus following surgical resection of a craniopharyngioma. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Severe rhabdomyolysis due to adipsic hypernatremia after craniopharyngioma surgery. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objectieve beoordeling van dorstherstel bij patiënten met adipsische diabetes insipidus. Hypofyse. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus secundair aan craniopharyngioma resectie. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Dagelijkse natriummonitoring en vochtinname protocol: voorkomen van recidiverende ziekenhuisopname bij adipsische diabetes insipidus. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsie bij een diabetes insipidus patiënt. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juvenile-onset jicht en adipsic diabetes insipidus: een case report en literatuuroverzicht. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Severe hyperosmolarity and hypernatremia in an adipsic young woman. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipsic diabetes insipidus following pituitary surgery for a macroprolactinoma. Hypofyse. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia without hypothalamic lesions accompanied by autoantibodies to subfornical organ. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasia of the corpus callosum associated with adipsic hypernatremia and hypothalamic hypogonadotropinism: a case report and review of the literature. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Chronic hypernatremia from a congenital defect in osmoregulation of thirst and vasopressin. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essential hypernatremia, antidiuretic hormone and neurohypophysin secretion: response to chlorpropamide. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Adipsic hypernatremia in two sisters. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. 38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Een geval van chronische hypernatriëmie met corpus callosum agenese. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiological remission and recovery of thirst appreciation after infliximab therapy in adipsic diabetes insipidus secondary to neurosarcoidosis. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. The circumventricular organs: an atlas of comparative anatomy and vascularization. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurochirurgisch clippen voor mensen met een aneurysmatische subarachnoïdale bloeding. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Waterbalansstoornissen na neurochirurgie: de triphasic response revisited. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effecten van DDAVP, een synthetisch analoog van vasopressine, bij patiënten met craniale diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Pharmacokinetics and pharmacodynamics of desmopressin administered orally versus intravenously at daytime versus night-time in healthy men aged 55-70 years. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressine 30 jaar klinisch gebruik: een veiligheidsevaluatie. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Behandeling van neurohypophyseale diabetes insipidus. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmacokinetiek van 1-deamino-8-D-arginine vasopressine na verschillende toedieningswegen in gezonde vrijwilligers. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmacokinetiek, farmacodynamiek, werkzaamheid en veiligheid op lange termijn van oraal 1-deamino-8-D-arginine vasopressine bij volwassen patiënten met centrale diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasma pharmacokinetics of desmopressin following sublingual administration: an exploratory dose-escalation study in healthy male volunteers. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressine lyophilisate for the treatment of central diabetes insipidus: first experience in very young infants. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar