- Introduction
- Materialen en methoden
- Inclusiecriteria
- Ovariële stimulatie en eicelpickup
- Embryotransferbeleid
- Primaire uitkomstmaten en statistische analyse
- Resultaten
- Oöcyt en Embryo Parameters
- Zwangerschapsuitkomsten en cumulatief levend geboortecijfer (CLBR)
- Discussie
- Conclusie
- Beschikbaarheid van gegevens
- Ethiekverklaring
- Author Contributions
- Funding
- Conflict of Interest Statement
- Acknowledgments
Introduction
Recently a novel system, the POSEIDON criteria, was developed to classify infertility patients with low prognosis undergoing assisted reproductive technology (ART) treatment (1). Het is een nuttig systeem voor de identificatie en classificatie van patiënten met verminderde ovariële reserve of slechte ovariële respons (POR), dat een leidraad vormt voor de diagnose en het beheer van deze patiënten (2). Er zijn vier subgroepen voorgesteld op basis van kwantitatieve en kwalitatieve parameters, waaronder leeftijd, ovariële reserve biomarkers, en ovariële respons. De nieuwe criteria, die een meer gedetailleerde stratificatie van POR introduceren, hebben de heterogeniteit van patiënten die voldoen aan de Bologna-criteria aanzienlijk verminderd (3), wat een onderscheid kan maken tussen subgroepen van patiënten binnen de POR-populatie die kunnen worden geïdentificeerd en baat kunnen hebben bij specifieke interventies (4). Hoewel de POSEIDON criteria werden opgesteld, samen met enkele specifieke behandelingsaanbevelingen voorgesteld voor de specifieke patiëntsubgroepen (5), blijft er onvoldoende bewijs om de geldigheid van de parameters gebruikt in de POSEIDON criteria, alsook de uitkomstbeoordeling van verschillende subgroepen te ondersteunen.
Van de vier groepen op basis van de POSEIDON criteria, is groep 1 ongetwijfeld de beste prognostische groep gezien hun jongere leeftijd en normale ovariële reserve, terwijl groep 4 de slechtste prognose heeft door de gevorderde leeftijd en verminderde ovariële reserve. Een interessante vraag is echter wie een beter zwangerschapsresultaat zou bereiken, de oudere vrouwen (groep 2) met normale ovariële reserve of de jonge vrouwen (groep 3) met verminderde ovariële reserve. Het cumulatief geboortecijfer (CLBR) wordt beschouwd als een maatstaf bij uitstek voor het succes van een IVF-behandeling (6). Tot nu toe zijn er zeer weinig rapporten over de CLBRs van de vier patiëntengroepen gedefinieerd door de POSEIDON criteria.
De karakteristieken en prognose van de patiënten moeten worden gebruikt om klinische management strategieën te ontwikkelen. Het doel van deze studie is om de patiënten met een lage prognose te karakteriseren om de besluitvorming over de behandeling te vergemakkelijken. In deze studie werden de basiskenmerken en uitkomsten van patiëntengroepen gedefinieerd door de POSEIDON-criteria geanalyseerd, en CLBR resulterend uit één geaspireerde in-vitrofertilisatie (IVF)/intracytoplasmatische sperma-injectie (ICSI)-cyclus werd voorgesteld als de primaire uitkomstmaat voor patiënten met een lage prognose die een IVF-behandeling ondergaan (7).
Materialen en methoden
Deze retrospectieve studie omvatte 18.455 verse geaspireerde IVF-cycli met daaropvolgende ingevroren embryotransfers van januari 2014 tot januari 2017 in ons centrum. Het resultaat van de levendgeborenen werd gedurende ten minste 2 jaar gevolgd tot januari 2019. De studie werd goedgekeurd door de ethische commissie voor de klinische toepassing van menselijke geassisteerde voortplantingstechnologie van Northwest Women’s and Children’s Hospital (nr. 2018002). De ethische commissie keurde deze studie goed en zag af van de noodzaak om geïnformeerde toestemming te verkrijgen. Al het onderzoek werd uitgevoerd in overeenstemming met relevante richtlijnen en regelgeving.
Inclusiecriteria
Patiënten werden gecategoriseerd volgens POSEIDON-criteria:
Lage prognosepatiënten
Groep 1 (n = 879 cycli): Leeftijd < 35, antraal follikelgetal (AFC) ≥ 5, aantal opgehaalde oöcyten ≤ 9 in de vorige cyclus;
Groep 2 (n = 482 cycli): Leeftijd ≥ 35, AFC≥5, aantal opgehaalde oöcyten ≤ 9 in de vorige cyclus;
Groep 3 (n = 858 cycli): Leeftijd < 35, AFC < 5;
Groep 4 (n = 1.306 cycli): Leeftijd ≥ 35, AFC < 5;
Niet-lage prognose patiënten
Groep 5 (n = 664 cycli): AFC ≥ 5, eerdere ovariële stimulatie > 9 oöcyten;
Groep 6 (n = 13708 cycli): AFC ≥ 5, geen eerdere ovariële stimulatie.
Stroomdiagram en gegevensverwerkingsprocedure zijn vermeld in figuur 1. De demografische en basale kenmerken van de patiënten zijn vermeld in tabel 1.
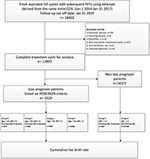
Figuur 1. Stroomdiagram en gegevensverwerking.
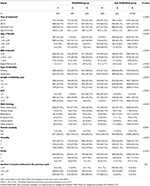
Tabel 1. Demografische gegevens en basiskenmerken.
Ovariële stimulatie en eicelpickup
Het protocol voor ovariële stimulatie (OS) werd individueel bepaald op basis van de leeftijd van de vrouw, de body mass index (BMI), het basale follikelstimulerende hormoon (FSH) en het aantal antrale follikels (AFC). 94,33% van de IVF-patiënten kregen recombinant en/of urinaire gonadotrofines (rFSH/hMG) in het GnRH-agonistprotocol of het GnRH-antagonistprotocol, gevolgd door IVF of ICSI. Voor vrouwen met verminderde ovariële reserve werd het milde stimulatieprotocol of de luteale fase ovariële stimulatie of natuurlijke cyclus gebruikt. Menselijke menopauzale gonadotrofine (hMG, Li Zhu, China) werd toegevoegd in het milde ovulatieprotocol of het Shanghai-protocol, afhankelijk van de respons van de patiënten op stimulatie. Humaan choriongonadotrofine (hCG) 4.000-10.000 IE of recombinant hCG (r-hCG, MerckSerono S.p.A.) 250μg werd toegediend wanneer 2-3 follikels de grootte van 17 mm of hoger bereikten. Zesendertig uur later werden de eicellen teruggehaald met behulp van transvaginale echografie-geleide aspiratie. De ovariële stimulatieparameters van elke groep staan vermeld in Tabel 2.

Tabel 2. Parameters voor ovariële stimulatie.
Embryotransferbeleid
De procedures voor de behandeling van eicellen en de ontwikkeling van embryo’s, evenals het scoresysteem voor embryo’s, werden beschreven in onze eerdere artikelen (8, 9). Graad 1-3 embryo’s op dag 3 werden beschouwd als bruikbare embryo’s, en graad 1-2 embryo’s werden beschouwd als embryo’s van goede kwaliteit. Alle verse embryotransfers (ET’s) werden uitgevoerd op dag 3 of dag 5. In gevallen met een voldoende aantal (≥ 3-4) embryo’s van goede kwaliteit op dag 3, werd blastocystentransfer op dag 5 toegepast. Naast de overgebrachte embryo’s werden extra embryo’s van patiënten op dag 3 of in het blastocyststadium (dag 5-6) verglaasd. Graad 1-3 klievingsstadium embryo’s op dag 3 en blastocysten met Gardner score boven 4CC werden gecryopreserveerd (Cryo-top, open systeem, Kuwayama). De methoden en de Frozen ET procedure zijn in detail beschreven in eerdere verificatiestudie van ons team (8, 9). Als de implantatie in de verse cyclus mislukte, zou de ingevroren-ontdooide embryotransfer (FET) worden uitgevoerd met gebruikmaking van de resterende verglaasde embryo’s of blastocysten. Patiënten jonger dan 35 jaar met embryo’s van goede kwaliteit werden aangemoedigd tot een één-embryotransfer. Een beleid van een enkele embryotransfer werd ook toegepast bij patiënten met een abnormale baarmoeder (b.v. littekenvorming, misvorming van de baarmoeder) en/of andere gevallen die in strijd waren met een tweelingzwangerschap. Progesteron intramusculaire injectie (60 mg/dag) werd gegeven voor ondersteuning van de luteale fase vanaf de dag van de eicelpickup tot een negatief serum beta-hCG of 8 weken zwangerschap.
Primaire uitkomstmaten en statistische analyse
Het primaire resultaat was cumulatieve levendgeborene (CLB) gedefinieerd als ten minste één levendgeborene als gevolg van één geaspireerde ART-cyclus in de verse ET of in de daaropvolgende FET in verhouding tot het aantal teruggehaalde eicellen. De teller van de CLBR-berekening was de som van het aantal levendgeborenen in de FET’s en het aantal levendgeborenen in de verse cycli. Alleen de eerste bevalling werd meegeteld in de analyse als een patiënt meerdere bevallingen had. De CLBR werd gedefinieerd als de cumulatieve levendgeborene per transvaginale oöcytenaspiratie volgens de terminologie (7, 10) Een behandelingscyclus werd gedefinieerd als een oöcytenpickup. Met een volledige behandelingscyclus werd een behandelingscyclus bedoeld waarbij een levende geboorte werd bereikt of een behandelingscyclus waarbij geen levende geboorte werd bereikt met alle teruggeplaatste embryo’s. Het cumulatieve levendgeboortecijfer in deze studie werd berekend op basis van de volledige behandelingscyclus, zodat de patiënten (n = 337) van niet-volledige behandeling werden uitgesloten.
De gegevensverwerking en statistische analyse werden uitgevoerd met behulp van EmpowerStats-software (www.empowerstats.com) en statistische softwarepakketten R. Om de odds ratio (OR) van CLBR in verschillende patiëntengroepen te beoordelen, werd een meervoudig variabel regressiemodel opgesteld met potentiële verstorende factoren als variabelen en gecorrigeerd voor het jaar van behandeling, vrouwelijke BMI, type infertiliteit, duur van de infertiliteit, graviditeit, pariteit, belangrijkste etiologie, OS protocol, gonadotrofine type, en FSH startdosis. Patiënten werden gedurende 3 jaar ingeschreven, gedurende welke de IVF procedure werd herzien. Om vertekening door deze factor te elimineren, werd het cumulatieve geboortecijfer gecorrigeerd voor het jaar van behandeling. Vrouwelijke BMI, type onvruchtbaarheid, duur van de onvruchtbaarheid, graviditeit, pariteit, en belangrijkste etiologie waren belangrijke factoren die zwangerschap en levendgeboorte beïnvloedden op basis van ervaring of literatuur. OS protocol, gonadotrofine type en FSH startdosis zijn de belangrijkste indicatoren om het aantal opgehaalde oöcyten te beïnvloeden en uiteindelijk de cumulatieve kans op levendgeborenen.
Resultaten
Oöcyt en Embryo Parameters

Tabel 3. Oöcyten en embryo parameters en CLBRs.
Zwangerschapsuitkomsten en cumulatief levend geboortecijfer (CLBR)
Inconsistent met het distributiepatroon van het aantal oöcyten en embryo’s per groep, was het CLBRs in de volgorde van hoogste naar laagste 44.6% in groep 1 (n = 879), 35,5% in groep 3 (n = 858), 24,5% in groep 2 (n = 482) en 12,7% in groep 4 (n = 1306). Er werd een meervoudige-variabele regressieanalyse uitgevoerd met variabelen die als verstorende factoren kunnen fungeren, zoals beschreven in de tabellen 1 en 2. De aangepaste odds ratio’s (OR’s) van CLBR met hun 95% betrouwbaarheidsintervallen (CI’s) werden getoond in Tabel 4. In overeenstemming met de trend van de niet-gecorrigeerde resultaten was de CLBR in groep 3 (OR 0,9, 95% CI 0,7-1,2, p = 0,615) iets lager en groep 5 (OR 1,3, 95% CI 0,9-1,7, p = 0,111) was iets hoger dan de CLBR in groep 1 zonder significant statistisch verschil. De CLBR in groep 2 was significant lager dan in groep 1 (OR 0,6, 95% CI 0,4-0,8, p = 0,004) en de CLBR in groep 4 was het laagst (OR 0,4, 95% CI 0,3-0,6, p < 0,001) in vergelijking met groep 1. Tabel 5 toonde de zwangerschapsuitkomsten per verse transfer of FET bij patiënten met een lage prognose. De implantatiecijfers in de oudere groepen (groep 2 en groep 4) waren significant lager dan in de jonge groepen (groep 1 en groep 3).

Tabel 4. Logistische regressieanalyse voor CLBRs.

Tabel 5. Zwangerschapsuitkomsten per overplaatsing van zowel verse als ingevroren embryo’s bij patiënten met een lage prognose.
Figuur 2 toonde de trendgrafiek van de belangrijkste gebeurtenissen bij patiënten met een lage prognose. Er was een kruising van trendlijnen tussen groep 2 en groep 3 na de embryotransfer. Patiënten in groep 2 (leeftijd ≥35; AFC ≥ 5) hadden een hogere AFC, meer teruggehaalde oöcyten, meer embryo’s en meer embryo’s van goede kwaliteit, maar een lager implantatiepercentage en CLBR. Daarentegen hadden de patiënten in groep 3 (leeftijd < 35; AFC < 5) weliswaar minder oöcyten en embryo’s, maar de CLBR bleek hoger dan die in groep 2. De SWOT-analyse van 4 groepen patiënten met een lage prognose, gedefinieerd volgens de POSEIDON-criteria, wordt getoond in figuur 3.
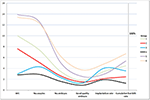
Figuur 2. Trenddiagram van belangrijke gebeurtenissen bij patiënten met een lage prognose. Er was een kruising van trendlijnen tussen groep 2 (rood) en groep 3 (blauw) na embryotransfer. De X-as geeft het gemiddelde aantal AFC weer, het aantal oöcyten, het aantal embryo’s, het aantal embryo’s van goede kwaliteit, het implantatiepercentage en het cumulatieve geboortecijfer. De Y-as links staat voor het aantal van de eerste vier variabelen (n) en de Y-as rechts voor het percentage van de laatste twee variabelen (%).

Figuur 3. SWOT-analyse van 4 groepen patiënten met een lage prognose, gedefinieerd volgens de POSEIDON-criteria.
Discussie
De belangrijkste bevinding van deze retrospectieve studie bij een populatie die volgens de POSEIDON-criteria was gedefinieerd, was dat de CLBR het hoogst was in groep 1, gevolgd door groep 3 en groep 2, en het laagst in groep 4. Volgens onze resultaten was de CLBR van de jonge vrouwen met slechte ovariële reserve (groep 3) iets lager dan die van jonge vrouwen met goede ovariële reserve en eerdere lage responder (groep 1). Hoewel de patiënten in groep 2 (leeftijd ≥ 35; AFC ≥ 5) een betere ovariële reserve, meer oöcyten en meer embryo’s hadden, waren de CLBR en het implantatiepercentage daarentegen lager dan bij de patiënten van groep 3 met een slechtere ovariële reserve, minder oöcyten en minder embryo’s. Deze bevinding kan de ontwikkeling van managementstrategieën voor patiënten met een lage prognose vergemakkelijken.
De innovatieve POSEIDON-criteria hebben tot doel patiënten met een lage prognose te identificeren en te stratificeren in vier verschillende groepen op basis van de leeftijd van de vrouw, AFC en ovariële respons in de vorige cyclus (4). De patiënten in groep 2 werden gekenmerkt door goede ovariële reserve en gevorderde leeftijd, precies het tegenovergestelde van groep 3 patiënten met slechte ovariële reserve maar op jongere leeftijd. Studies (11-13) hebben aangetoond dat CLBR toeneemt met het aantal teruggehaalde oöcyten, zelfs bij vrouwen van gevorderde leeftijd (14). Er werd gesuggereerd dat het aantal opgehaalde oöcyten een zeer belangrijke variabele is die onafhankelijk geassocieerd is met CLBR. Patiënten in groep 2 met een groter aantal oöcyten zouden naar verwachting een betere prognose hebben dan patiënten in groep 3, omdat patiënten in groep 2 meer embryo’s hadden om over te plaatsen. De CLBR en het implantatiepercentage waren echter omgekeerd hoger in groep 2 dan in groep 3.
Onze resultaten zijn consistent met eerdere studies (15, 16) over het verband tussen ovariële reserve en zwangerschapsuitkomst. Chang et al. (15) vonden dat er lagere percentages van normale bevruchting, splitsing, embryo’s van goede kwaliteit, implantatie en zwangerschap waren bij oudere vrouwen dan bij jongere vrouwen met verminderde ovariële reserve. De voornaamste reden was de nadelige invloed van ouder wordende eicellen op de uitkomst van de zwangerschap (laag implantatiepercentage en hoog zwangerschapsverliespercentage) als gevolg van chromosomale afwijkingen (17) en cytoplasmatische disfunctie (18). De afname van de vruchtbaarheid met het ouder worden heeft zowel betrekking op de kwantiteit als op de kwaliteit van de eicel. Implantatie en miskraam zijn gerelateerd aan de kwaliteit van de oöcyten, maar niet noodzakelijkerwijs aan de ovariële reserve (16). De goede ovariële reserve in groep 2 zou de mogelijkheid verhogen om meer oöcyten en embryo’s voor transfer te verkrijgen, maar tegelijkertijd zou het hogere aneuploïdiecijfer leiden tot een laag implantatiecijfer en een hoog miskraamcijfer.
In termen van de behandeling van patiënten in groep 2, moet meer aandacht worden besteed aan het ontwikkelen van strategieën om de kwaliteit van de oöcyten te verbeteren in plaats van de kwantiteit van de oöcyten of de hoeveelheid embryo’s. Omdat in groep 2 op dag 3 meer embryo’s worden verkregen, is het kweken van embryo’s tot het blastocyststadium voor overbrenging een goede optie. Dag 5-6 embryo’s hebben een lager percentage segmentale aneuploïdie (19) en een hogere levensvatbaarheid voor implantatie (20) dan dag 2-3 embryo’s. Preïmplantatie genetische tests voor aneuploïdie (PGT-A) zijn ook nuttig voor gevorderde vrouwen om een euploïd embryo te selecteren voor overbrenging (21). Een optimale stimulatie van de eierstokken om de kwaliteit van de oöcyten te verbeteren (22, 23) zou een alternatieve optie kunnen zijn. Supplementen zoals dehydroepiandrosteron werden geprobeerd om de follikelontwikkeling te verbeteren (24), hoewel er onvoldoende bewijs is om het gebruik ervan bij deze patiënten te ondersteunen.
De patiënten in groep 3 (leeftijd < 35; AFC < 5) hadden een slechte ovariële reserve, van wie slechte responders met een slechte zwangerschapsuitkomst werden verwacht. Interessant was dat de oöcytenproductie (145,3% opgehaalde oöcyten per AFC) in groep 3 significant hoger was dan in de andere groepen, hoewel de FSH-startdosis niet significant was verhoogd (Tabel 2). Dit suggereert dat de respons van antrale follikels op gonadotrofine mogelijk de grens van zijn vermogen heeft bereikt, daarom zal er geen extra voordeel in oöcytenaantal zijn om de dagelijkse gonadotrofine doses verder te verhogen (25). Het evalueren van de gevoeligheid van de eierstokken voor FSH is een sleutelelement om het succespercentage van IVF bij deze patiënten met een lage prognose te verbeteren en nieuwe behandelingsperspectieven te openen (26). De hoge oöcytenproductie per AFC in groep 3 ondersteunde ook de gerapporteerde aanbeveling van een maximale dagelijkse dosis van 300 IE rFSH (5). Voor de patiënten in groep 3 zouden meer inspanningen moeten worden gericht op het verhogen van het aantal oöcyten, omdat de klinische zwangerschapsuitkomst geruststellend is zodra oöcyten zijn verworven.
De patiënten in groep 5 waren de niet-lage prognose patiënten die een goede ovariële respons hadden (meer dan 9 oöcyten bij vorige retrieval), maar de meeste van deze patiënten zijn er niet in geslaagd om in de vorige IVF cyclus te bevallen. Vergeleken met een andere niet-lage prognose patiënten met eerste IVF-behandeling (groep 6), hoewel de patiënten in groep 5 meer AFC en aantal teruggevonden oöcyten hebben, waren de embryonale ontwikkeling en het zwangerschapsresultaat inferieur aan die in groep 6. Daarom kan het falen bij eerste IVF-patiënten met een goede ovariële respons de slechte prognose zijn voor latere IVF-behandeling.
Pelvic-tubal factor is de meest voorkomende oorzaak van onvruchtbaarheid, goed voor ongeveer 10,8-78,3% van de onvruchtbare vrouwen in China (27, 28). Bij de tubale factor gaat het vooral om afsluiting van de tubus en peritoneale pathologie die verklevingen veroorzaakt, en die werd gediagnosticeerd met hysterosalpingografie en laparoscopie. De meest voorkomende oorzaak van tubal factor infertiliteit werd toegeschreven aan pelvic inflammatory disease (PID), salpingitis en endometriose (29). In de patiëntengroepen van deze studie is de tubale factor de belangrijkste onvruchtbaarheidsoorzaak, variërend van 62,9 tot 71,4%, wat hoger is dan bij onvruchtbare vrouwen in andere landen en regio’s. Daarom moet men voorzichtig zijn bij het interpreteren van de bredere implicaties van de bevindingen.
Beperkingen houden verband met de retrospectieve aard van de studie en het feit dat de gegevens afkomstig waren van één enkel centrum verzwakt ook de universaliteit van onze waarnemingen. Andere mogelijke beperkingen kunnen zijn dat een niet-GnRH analoog protocol werd gebruikt bij sommige vrouwen met verminderde ovariële reserve in plaats van bij die met normale ovariële reserve. De verse cycli die geen oöcyten opleverden, werden niet in deze studie opgenomen, bijvoorbeeld cycli met annulering van ovariële stimulatie.
De resultaten van deze studie kunnen nieuwe inzichten verschaffen voor de ontwikkeling van managementstrategieën voor patiënten met een lage prognose. Er werd een SWOT-analyse uitgevoerd om het management voor patiënten met een lage prognose in de kliniek te helpen, die werd opgesteld op basis van de POSEIDON-rapporten (1, 2, 4, 5) en de gegevens in deze studie. De responsiviteit van antrale follikels op gonadotrofine was extreem hoger in groep 3 dan in de andere groepen. Gezien het bevredigende CLBR resultaat in groep 3, stellen wij voor om, om de oöcytenopbrengst te verhogen, meer ovariële stimulaties te proberen maar niet hardere ovariële stimulatie door middel van een te hoge dagelijkse dosis gonadotrofine. Hoewel de patiënten in groep 2 meer ovariële reserve en ook meer oöcyten en embryo’s hebben, was de CLBR lager dan verwacht. De strategie voor groep 2 zou moeten zijn om het geboortecijfer te verbeteren in plaats van het aantal gewonnen oöcyten te verhogen.
Conclusie
In conclusie, inconsistent met het verdelingspatroon van de hoeveelheid oöcyten en embryo’s per patiëntengroep, waren de CLBRs in de volgorde van hoogste naar laagste in groep 1 (jonge vrouwen met goede ovariële reserve), groep 3 (jonge vrouwen met slechte ovariële reserve), groep 2 (vrouwen op gevorderde leeftijd met goede ovariële reserve), en ten slotte groep 4 (vrouwen op gevorderde leeftijd met slechte ovariële reserve.
Beschikbaarheid van gegevens
De ruwe gegevens die de conclusies van dit manuscript ondersteunen, zullen door de auteurs, zonder onnodig voorbehoud, beschikbaar worden gesteld aan elke gekwalificeerde onderzoeker.
Ethiekverklaring
De studie werd goedgekeurd door de ethische commissie voor de klinische toepassing van menselijke geassisteerde voortplantingstechnologie van het Northwest Women’s and Children’s Hospital (No. 2018002). De ethische commissie die deze studie goedkeurde, zag af van de noodzaak om geïnformeerde toestemming te verkrijgen. Al het onderzoek werd uitgevoerd in overeenstemming met de relevante richtlijnen en voorschriften.
Author Contributions
WS en JS bedachten en ontwierpen de studie. WS en WZ hebben het manuscript opgesteld en herzien. WS, ZZ, en WZ analyseerden en interpreteerden de gegevens. LT, ZZ, en HZ verzamelden en zuiverden de gegevens. Alle auteurs hebben de definitieve versie van het manuscript gelezen en goedgekeurd.
Funding
De studie werd gefinancierd door Algemene projecten van sociale ontwikkeling in de provincie Shaanxi (nr. 2018SF-247) en Personeelstrainingsprogramma van Noordwest vrouwen- en kinderziekenhuis (2018ZD02).
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
We danken alle clinici, wetenschappers en embryologen in het Northwest Women and Children’s Hospital voor hun hulp bij het verzamelen van de gegevens, en alle patiënten voor hun bijdrage aan deze studie. Wij danken Dr. Xinglin Chen van de afdeling Epidemiologie en Biostatistiek, X&Y solutions Inc. in Boston voor haar bijdrage aan de statistische ondersteuning.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. A new more detailed stratification of low responders to ovarian stimulation: from a poor ovarian response to a low prognosis concept. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. De nieuwe POSEIDON stratificatie van “Lage prognose patiënten in geassisteerde voortplantingstechnologie” en de voorgestelde marker van succesvolle uitkomst. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus over de definitie van ‘slechte respons’ op ovariële stimulatie voor in vitro fertilisatie: de Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Het definiëren van lage prognose patiënten die geassisteerde voortplantingstechnologie ondergaan: POSEIDON criteria – het waarom. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Factoren gerelateerd aan klinische zwangerschap na vitrified-warmed embryo transfer: een retrospectieve en multivariate logistische regressie analyse van 2313 transfer cycli. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multinational analysis including approximately 15,000 women. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Associatie tussen het aantal teruggehaalde oöcyten en het cumulatieve geboortecijfer bij vrouwen van 35-40 jaar die lange GnRH agonist IVF/ICSI cycli ondergingen. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Cumulative live birth rate prognosis based on the number of aspirated oocytes in previous ART cycles. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. 14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Cumulatieve geboortecijfers en aantal teruggehaalde eicellen bij vrouwen op gevorderde leeftijd. A single centre analysis including 4500 women >/ = 38 years old. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Egg quality and pregnancy outcome in young infertile women with diminished ovarian reserve. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Oöcytenveroudering ten grondslag aan vrouwelijke reproductieve veroudering: biologische mechanismen en therapeutische strategieën. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparison of pregnancy outcomes after vitrification at the cleavage and blastocyst stage: a meta-analysis. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteale fase ovariële stimulatie kan oöcyte retrieval en oöcytkwaliteit verbeteren bij slechte ovariële responders die in vitro fertilisatie ondergaan: voorlopige resultaten van een single-center prospectieve pilotstudie. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacy of dehydroepiandrosterone (DHEA) to overcome the effect of ovarian ageing (DITTO): a proof of principle double blinded randomized placebo controlled trial. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Understanding follicular output rate (FORT) and its implications for POSEIDON criteria. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Epidemiologisch onderzoek naar onvruchtbaarheid in drie provincies van China. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologie en etiologie van oviduct onvruchtbaarheid. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar