- Lear Outcomes
- De structuren van metalen
- Eenhedencellen van metalen
- Voorbeeld 1: Berekening van atoomstraal en dichtheid voor metalen, deel 1
- Check Your Learning
- Voorbeeld 2: Berekening van atoomstraal en dichtheid voor metalen, deel 2
- Deel 1
- Deel 2
- Check Your Learning
- De structuren van Ionische kristallen
- Voorbeeld 3: Bezetting van tetrahedrale gaten
- Check Your Learning
- Voorbeeld 4: Stoichiometrie van Ionische Verbindingen
- Check Your Learning
- Enkelementscellen van ionische verbindingen
- Berekening van ionenstralingen
- Voorbeeld 5: Berekening van ionstraal
- Check Your Learning
- Röntgenkristallografie
- Voorbeeld 6: Met behulp van de Bragg-vergelijking
- Check Your Learning
- Portret van een chemicus: X-ray Crystallographer Rosalind Franklin
- Key Concepts and Summary
- Key Equations
- Try It
- Glossary
Lear Outcomes
- Beschrijf de ordening van atomen en ionen in kristallijne structuren
- Bereken ionstraal met behulp van eenheidscelafmetingen
- Leg het gebruik uit van röntgendiffractiemetingen bij het bepalen van kristallijne structuren
Meer dan 90% van de in de natuur voorkomende en door de mens gemaakte vaste stoffen zijn kristallijn.röntgendiffractiemetingen bij het bepalen van kristallijne structuren
Meer dan 90% van de in de natuur voorkomende en door de mens gemaakte vaste stoffen zijn kristallijn. De meeste vaste stoffen vormen zich met een regelmatige rangschikking van hun deeltjes, omdat de totale attractieve interacties tussen de deeltjes maximaal zijn, en de totale intermoleculaire energie minimaal, wanneer de deeltjes zich op de meest efficiënte manier samenpakken. De regelmatige ordening op atomair niveau wordt vaak weerspiegeld op macroscopisch niveau. In deze module zullen we enkele details over de structuren van metallische en ionische kristallijne vaste stoffen onderzoeken, en leren hoe deze structuren experimenteel worden bepaald.
De structuren van metalen
We beginnen onze bespreking van kristallijne vaste stoffen met het beschouwen van elementaire metalen, die relatief eenvoudig zijn omdat elk slechts één type atoom bevat. Een zuiver metaal is een kristallijne vaste stof met metaalatomen dicht opeen gepakt in een repeterend patroon. Sommige eigenschappen van metalen in het algemeen, zoals hun buigzaamheid en taaiheid, zijn grotendeels te danken aan het feit dat identieke atomen in een regelmatig patroon zijn gerangschikt. De verschillende eigenschappen van het ene metaal ten opzichte van het andere hangen gedeeltelijk af van de grootte van hun atomen en de specifieke ruimtelijke ordening ervan. We zullen de overeenkomsten en verschillen van vier van de meest voorkomende metaalkristalgeometrieën in de volgende secties onderzoeken.
Eenhedencellen van metalen
De structuur van een kristallijne vaste stof, of het nu een metaal is of niet, kan het best worden beschreven door de eenvoudigste repeterende eenheid te beschouwen, die de eenheidscel wordt genoemd. De eenheidscel bestaat uit roosterpunten die de plaatsen van atomen of ionen voorstellen. De gehele structuur bestaat dan uit deze eenheidscel die zich herhaalt in drie dimensies, zoals geïllustreerd in figuur 1.

Figuur 1. Een eenheidscel toont de plaatsen van de roosterpunten die zich in alle richtingen herhalen.
Laten we ons onderzoek naar de kristalroosterstructuur en de eenheidscellen beginnen met de meest eenvoudige structuur en de meest elementaire eenheidscel. Om dit te visualiseren, stelt u zich voor een groot aantal identieke bollen te nemen, zoals tennisballen, en ze gelijkmatig in een container te rangschikken. De eenvoudigste manier om dit te doen is door lagen te maken waarin de bollen in de ene laag direct boven die in de laag eronder liggen, zoals geïllustreerd in figuur 2. Deze ordening wordt eenvoudige kubische structuur genoemd, en de eenheidscel wordt de eenvoudige kubische eenheidscel of primitieve kubische eenheidscel genoemd.

Figuur 2. Wanneer metaalatomen zijn gerangschikt met bollen in een laag direct boven of onder bollen in een andere laag, wordt de roosterstructuur eenvoudig kubisch genoemd. Merk op dat de bollen met elkaar in contact staan.
In een eenvoudige kubische structuur zijn de bollen niet zo dicht opeengepakt als zij zouden kunnen zijn, en zij “vullen” slechts ongeveer 52% van het volume van de container. Dit is een betrekkelijk inefficiënte ordening, en slechts één metaal (polonium, Po) kristalliseert in een eenvoudige kubische structuur. Zoals te zien is in figuur 3, bestaat een vaste stof met een dergelijke ordening uit vlakken (of lagen) waarin elk atoom alleen contact heeft met de vier naaste buren in zijn laag; een atoom direct erboven in de laag erboven; en een atoom direct eronder in de laag eronder. Het aantal andere deeltjes waarmee elk deeltje in een kristallijne vaste stof contact maakt, wordt zijn coördinatiegetal genoemd. Voor een poloniumatoom in een eenvoudige kubische matrix is het coördinatiegetal dus zes.

Figuur 3. In een eenvoudig kubisch rooster is de eenheidscel die zich in alle richtingen herhaalt, een kubus gedefinieerd door de middelpunten van acht atomen, zoals te zien is in figuur 4. Atomen op aangrenzende hoekpunten van dit rooster hebben een coördinatiegetal van zes. Atomen op aangrenzende hoeken van deze eenheidscel raken elkaar, zodat de randlengte van deze cel gelijk is aan twee atomaire stralen, of één atomaire diameter. Een kubische eenheidscel bevat alleen de delen van deze atomen die er binnen liggen. Aangezien een atoom op een hoek van een eenvoudige kubische eenheidscel in totaal door acht eenheidscellen wordt omvat, bevindt zich slechts een achtste van dat atoom binnen een specifieke eenheidscel. En aangezien elke enkelvoudige kubische eenheidscel een atoom op elk van zijn acht “hoeken” heeft, bevindt zich 8 keer een atoom in een enkelvoudige kubische eenheidscel.

Figuur 4. Een eenvoudige kubische roostercel bevat een achtste van een atoom op elk van de acht hoeken, dus in totaal één atoom.
Voorbeeld 1: Berekening van atoomstraal en dichtheid voor metalen, deel 1
De randlengte van de eenheidscel van alfa-polonium is 336 pm.
- Bepaal de straal van een poloniumatoom.
- Bepaal de dichtheid van alfa-polonium.
Check Your Learning
De randlengte van de eenheidscel voor nikkel is 0,3524 nm. De dichtheid van nikkel is 8,90 g/cm3. Kristalliseert nikkel in een eenvoudige kubische structuur? Leg uit.
De meeste metaalkristallen hebben één van de vier grote typen eenheidscellen. Voorlopig zullen wij ons concentreren op de drie kubische eenheidscellen: de enkelvoudige kubische (die wij reeds hebben gezien), de lichaamsgecentreerde kubische eenheidscel en de gezichtsgecentreerde kubische eenheidscel – die alle zijn afgebeeld in figuur 5. (Merk op dat er in feite zeven verschillende roostersystemen zijn, waarvan sommige meer dan één roostertype hebben, voor een totaal van 14 verschillende typen eenheidscellen. De meer gecompliceerde geometrieën laten we voor later in deze module.)

Figuur 5. Kubische eenheidscellen van metalen tonen (in de bovenste figuren) de plaatsen van de roosterpunten en (in de onderste figuren) de metaalatomen die zich in de eenheidscel bevinden.
Sommige metalen kristalliseren in een ordening die een kubische eenheidscel heeft met atomen op alle hoeken en een atoom in het centrum, zoals in figuur 6 is te zien. Dit wordt een body-centered cubic (BCC) solid genoemd. Atomen in de hoeken van een BCC eenheidscel komen niet met elkaar in contact, maar met het atoom in het centrum. Een BCC eenheidscel bevat twee atomen: een achtste van een atoom op elk van de acht hoeken (8 keer een atoom uit de hoeken) plus een atoom uit het centrum. Elk atoom in deze structuur raakt vier atomen in de laag erboven en vier atomen in de laag eronder. Een atoom in een BCC-structuur heeft dus een coördinatiegetal van acht.

Figuur 6. In een lichaamsgecentreerde kubusstructuur raken atomen in een bepaalde laag elkaar niet. Elk atoom raakt vier atomen in de laag erboven en vier atomen in de laag eronder.
Atomen in BCC-opstellingen zijn veel efficiënter opeengepakt dan in een eenvoudige kubische structuur, die ongeveer 68% van het totale volume inneemt. Isomorfe metalen met een BCC-structuur zijn onder meer K, Ba, Cr, Mo, W, en Fe bij kamertemperatuur. (Van elementen of verbindingen die met dezelfde structuur kristalliseren, wordt gezegd dat ze isomorf zijn.)
Vele andere metalen, zoals aluminium, koper en lood, kristalliseren in een ordening met een kubische eenheidscel met atomen op alle hoeken en in het midden van elk zijvlak, zoals geïllustreerd in figuur 7. Deze ordening wordt een face-centered cubic (FCC) vaste stof genoemd. Een FCC eenheidscel bevat vier atomen: een achtste van een atoom op elk van de acht hoeken (8 maal 1 atoom van de hoeken) en een half atoom op elk van de zes zijvlakken (6 maal 1 atoom van de zijvlakken). De atomen op de hoeken raken de atomen in de middelpunten van de aangrenzende vlakken langs de gezichtsdiagonalen van de kubus. Omdat de atomen op identieke roosterpunten liggen, hebben ze identieke omgevingen.

Figuur 7. Een face-centered cubic solid heeft atomen op de hoeken en, zoals de naam al aangeeft, in de middelpunten van de vlakken van zijn eenheidscellen.
Atomen in een FCC-opstelling zijn zo dicht mogelijk opeengepakt, waarbij atomen 74% van het volume innemen. Deze structuur wordt ook wel cubic closest packing (CCP) genoemd. In CCP zijn er drie herhalende lagen van hexagonaal geplaatste atomen. Elk atoom raakt zes atomen in zijn eigen laag, drie in de laag erboven, en drie in de laag eronder. In deze opstelling raakt elk atoom 12 nabije buren, en heeft dus een coördinatiegetal van 12. Dat FCC- en CCP-opstellingen gelijkwaardig zijn, is misschien niet meteen duidelijk, maar waarom ze eigenlijk dezelfde structuur zijn, wordt geïllustreerd in figuur 8.
Figuur 8. Een CCP-opstelling bestaat uit drie zich herhalende lagen (ABCABC…) van hexagonaal gerangschikte atomen. Atomen in een CCP-structuur hebben een coördinatiegetal van 12, omdat ze contact maken met zes atomen in hun laag, plus drie atomen in de laag erboven en drie atomen in de laag eronder. Door ons perspectief te draaien, kunnen we zien dat een CCP-structuur een eenheidscel heeft met een vlak dat een atoom van laag A in een hoek bevat, atomen van laag B over een diagonaal (op twee hoeken en in het midden van het vlak), en een atoom van laag C in de overgebleven hoek. Dit is hetzelfde als een face-centered cubic arrangement.
Omdat de nauwste pakking de totale aantrekkingskracht tussen atomen maximaliseert en de totale intermoleculaire energie minimaliseert, pakken de atomen in de meeste metalen zich op deze manier in. In eenvoudige metallische kristalstructuren vinden we twee typen van nauwere pakking: CCP, dat we al eerder tegenkwamen, en hexagonal closest packing (HCP), te zien in figuur 9. Beide bestaan uit zich herhalende lagen van hexagonaal gerangschikte atomen. Bij beide typen wordt een tweede laag (B) op de eerste laag (A) geplaatst, zodat elk atoom in de tweede laag in contact staat met drie atomen in de eerste laag. De derde laag is op een van de twee volgende manieren gepositioneerd. In HCP bevinden atomen in de derde laag zich direct boven atomen in de eerste laag (d.w.z. de derde laag is ook van type A), en de stapeling bestaat uit afwisselend dicht opeen gepakte lagen van type A en type B (d.w.z. ABABAB⋯). In CCP bevinden atomen in de derde laag zich niet boven atomen in een van de eerste twee lagen (d.w.z. de derde laag is van het type C), en de stapeling bestaat uit afwisselend dicht op elkaar gepakte lagen van het type A, type B en type C (d.w.z. ABCABCABC⋯). Ongeveer tweederde van alle metalen kristalliseren in dicht opeen gepakte arrays met coördinatiegetallen van 12. Metalen die in een HCP-structuur kristalliseren zijn onder meer Cd, Co, Li, Mg, Na, en Zn, en metalen die in een CCP-structuur kristalliseren zijn onder meer Ag, Al, Ca, Cu, Ni, Pb, en Pt.
Figuur 9. In beide types zijn de atomen zo compact mogelijk ingepakt. De zeshoekige dichtste pakking bestaat uit twee alternerende lagen (ABABAB…). Kubische dichtste verpakking bestaat uit drie afwisselende lagen (ABCABCABC…).
Voorbeeld 2: Berekening van atoomstraal en dichtheid voor metalen, deel 2
Calcium kristalliseert in een face-centered kubische structuur. De randlengte van de eenheidscel is 558,8 pm.
- Wat is de atoomstraal van Ca in deze structuur?
- Bereken de dichtheid van Ca.
Check Your Learning
Zilver kristalliseert in een FCC-structuur. De randlengte van de eenheidscel is 409 pm.
- Wat is de atoomstraal van Ag in deze structuur?
- Bereken de dichtheid van Ag.
In het algemeen wordt een eenheidscel gedefinieerd door de lengten van drie assen (a, b, en c) en de hoeken (α, β, en γ) ertussen, zoals geïllustreerd in figuur 10. De assen zijn gedefinieerd als de lengtes tussen punten in het ruimtelrooster. Bijgevolg verbinden de eenheidscelassen punten met identieke omgevingen.

Figuur 10. Een eenheidscel wordt gedefinieerd door de lengten van de drie assen (a, b, en c) en de hoeken (α, β, en γ) tussen de assen.
Er zijn zeven verschillende roostersystemen, waarvan sommige meer dan één type rooster hebben, voor een totaal van veertien verschillende eenheidscellen, die de in figuur 11 getoonde vormen hebben.

Figuur 11. Er zijn zeven verschillende roostersystemen en 14 verschillende eenheidscellen.
De structuren van Ionische kristallen
Ionische kristallen bestaan uit twee of meer verschillende soorten ionen die gewoonlijk verschillende afmetingen hebben. De verpakking van deze ionen in een kristalstructuur is complexer dan de verpakking van metaalatomen die dezelfde grootte hebben.
De meeste mono-atomaire ionen gedragen zich als geladen bollen, en hun aantrekkingskracht op ionen met tegengestelde lading is in elke richting hetzelfde. Bijgevolg ontstaan stabiele structuren voor ionische verbindingen (1) wanneer ionen met één lading door zoveel mogelijk ionen met de tegengestelde lading worden omgeven en (2) wanneer de kationen en anionen met elkaar in contact zijn. De structuur wordt bepaald door twee belangrijke factoren: de relatieve grootte van de ionen en de verhouding tussen het aantal positieve en negatieve ionen in de verbinding.
Figuur 12. Kationen kunnen twee soorten gaten tussen anionen bezetten: octahedrale gaten of tetrahedrale gaten.
In eenvoudige ionische structuren vinden we gewoonlijk de anionen, die gewoonlijk groter zijn dan de kationen, gerangschikt in een dicht bij elkaar liggende rij. (Zoals eerder gezien, maken extra elektronen die worden aangetrokken door dezelfde kern de anionen groter en minder elektronen die worden aangetrokken door dezelfde kern maken de kationen kleiner in vergelijking met de atomen waaruit zij zijn gevormd). De kleinere kationen bezetten gewoonlijk een van de twee soorten gaten (of tussenruimten) die tussen de anionen overblijven. De kleinste van de gaten bevindt zich tussen drie anionen in één vlak en één anion in een aangrenzend vlak. De vier anionen die dit gat omgeven zijn gerangschikt op de hoeken van een tetraëder, zodat het gat een tetraëdergat wordt genoemd. Het grotere type gat bevindt zich in het centrum van zes anionen (drie in één laag en drie in een aangrenzende laag) die zich op de hoeken van een octaëder bevinden; dit wordt een octaëdervormig gat genoemd. Figuur 12 illustreert beide soorten gaten.
Afhankelijk van de relatieve grootte van de kationen en anionen, kunnen de kationen van een ionische verbinding tetrahedrale of octahedrale gaten bezetten, zoals geïllustreerd in figuur 13. Relatief kleine kationen bezetten tetrahedral gaten, en grotere kationen bezetten octahedral gaten. Als de kationen te groot zijn om in de octahedrale gaten te passen, kunnen de anionen een meer open structuur aannemen, zoals een eenvoudige kubische array. De grotere kationen kunnen dan de grotere kubische gaten bezetten die door de meer open ruimte mogelijk worden gemaakt.

Figuur 13. De grootte van een kation en de vorm van het gat dat door de verbinding wordt ingenomen, staan in direct verband met elkaar.
Er zijn twee tetrahedrale gaten voor elk anion in een HCP- of CCP-array van anionen. Een verbinding die kristalliseert in een dicht opeen gepakte array van anionen met kationen in de tetrahedral gaten kan een maximum kation:anion verhouding van 2:1 hebben; alle van de tetrahedral gaten worden gevuld bij deze verhouding. Voorbeelden zijn Li2O, Na2O, Li2S, en Na2S. Verbindingen met een verhouding van minder dan 2:1 kunnen ook kristalliseren in een dicht bij elkaar liggende rij van anionen met kationen in de tetrahedrale gaten, als de ionische maten passen. In deze verbindingen blijven echter enkele van de tetrahedrale gaten vacant.
Voorbeeld 3: Bezetting van tetrahedrale gaten
Zinksulfide is een belangrijke industriële bron van zink en wordt ook gebruikt als een wit pigment in verf. Zinksulfide kristalliseert met zinkionen die de helft van de tetrahedrale gaten innemen in een dicht opeen gepakte rij van sulfide-ionen. Wat is de formule van zinksulfide?
Check Your Learning
Lithiumselenide kan worden beschreven als een dicht opeengepakte rij selenide-ionen met lithium-ionen in alle tetrahedrale gaten. Wat is de formule van lithium selenide?
De verhouding van octahedrale gaten tot anionen in een HCP- of CCP-structuur is 1:1. Verbindingen met kationen in octahedrale gaten in een dicht opeen gepakte reeks van anionen kunnen dus een maximale kation:anion verhouding van 1:1 hebben. In NiO, MnS, NaCl, en KH, bijvoorbeeld, zijn alle octahedrale gaten gevuld. Verhoudingen van minder dan 1:1 worden waargenomen wanneer sommige van de octahedrale gaten leeg blijven.
Voorbeeld 4: Stoichiometrie van Ionische Verbindingen
Saffier is aluminiumoxide. Aluminiumoxide kristalliseert met aluminiumionen in twee-derde van de octahedrale gaten in een dicht opeen gepakte rij van oxide-ionen. Wat is de formule van aluminiumoxide?
Check Your Learning
Het witte pigment titaniumoxide kristalliseert met titaniumionen in de helft van de octahedrale gaten in een dicht opeengepakte rij van oxide-ionen. Wat is de formule van titaniumoxide?
In een eenvoudige kubische array van anionen is er voor elk anion in de array één kubisch gat dat door een kation kan worden bezet. In CsCl, en in andere verbindingen met dezelfde structuur, zijn alle kubische gaten bezet. In SrH2, UO2, SrCl2, en CaF2 is de helft van de kubische gaten bezet.
Verschillende soorten ionische verbindingen kristalliseren vaak in dezelfde structuur wanneer de relatieve grootte van hun ionen en hun stoichiometrie (de twee belangrijkste kenmerken die de structuur bepalen) vergelijkbaar zijn.
Enkelementscellen van ionische verbindingen
Vele ionische verbindingen kristalliseren met kubische eenheidscellen, en we zullen deze verbindingen gebruiken om de algemene kenmerken van ionische structuren te beschrijven.
Wanneer een ionische verbinding is samengesteld uit kationen en anionen van gelijke grootte in een 1:1 verhouding, vormt zij gewoonlijk een eenvoudige kubische structuur. Cesiumchloride, CsCl, (afgebeeld in figuur 14) is hier een voorbeeld van, waarbij Cs+ en Cl- stralen hebben van respectievelijk 174 pm en 181 pm. We kunnen dit zien als chloride-ionen die een eenvoudige kubische eenheidscel vormen, met een cesium-ion in het centrum; of als cesium-ionen die een eenheidscel vormen met een chloride-ion in het centrum; of als eenvoudige kubische eenheidscellen gevormd door Cs+-ionen die eenheidscellen gevormd door Cl-ionen overlappen. Cesiumionen en chloride-ionen raken elkaar langs de lichaamsdiagonalen van de eenheidscellen. Per eenheidscel is één cesiumion en één chloride-ion aanwezig, hetgeen de l:l stoichiometrie oplevert die de formule voor cesiumchloride voorschrijft. Merk op dat er geen roosterpunt in het midden van de cel is, en CsCl is geen BCC structuur omdat een cesiumion niet identiek is aan een chloride-ion.

Figuur 14. Ionische verbindingen met kationen en anionen van gelijke grootte, zoals CsCl, vormen gewoonlijk een eenvoudige kubische structuur. Zij kunnen worden beschreven door eenheidscellen met hetzij kationen op de hoeken, hetzij anionen op de hoeken.
We hebben gezegd dat de plaats van de roosterpunten arbitrair is. Dit wordt geïllustreerd door een alternatieve beschrijving van de CsCl-structuur waarin de roosterpunten zich in de centra van de cesiumionen bevinden. In deze beschrijving bevinden de cesiumionen zich op de roosterpunten op de hoeken van de cel, en het chloride-ion bevindt zich in het midden van de cel. De twee eenheidscellen zijn verschillend, maar zij beschrijven identieke structuren.
Wanneer een ionische verbinding is samengesteld uit een 1:1 verhouding van kationen en anionen die aanzienlijk in grootte verschillen, kristalliseert zij typisch met een FCC eenheidscel, zoals die in figuur 15 wordt getoond. Natriumchloride, NaCl, is hier een voorbeeld van, met Na+ en Cl- met stralen van respectievelijk 102 pm en 181 pm. We kunnen dit zien als een FCC cel met chloride-ionen, waarbij de natrium-ionen zich in de octahedrale gaten in het midden van de celranden en in het midden van de cel bevinden. De natrium- en chloride-ionen raken elkaar langs de celranden. De eenheidscel bevat vier natriumionen en vier chloride-ionen, wat de stoichiometrie 1:1 oplevert die vereist is voor de formule NaCl.
Figuur 15. Ionische verbindingen met anionen die veel groter zijn dan kationen, zoals NaCl, vormen meestal een FCC-structuur. Zij kunnen worden beschreven door FCC-eenheidscellen met kationen in de octahedrale gaten.
De kubische vorm van zinksulfide, zinkblende, kristalliseert ook in een FCC-eenheidscel, zoals geïllustreerd in figuur 16. Deze structuur bevat sulfide-ionen op de roosterpunten van een FCC-rooster. (De rangschikking van de sulfide-ionen is identiek aan de rangschikking van de chloride-ionen in natriumchloride). De straal van een zinkion is slechts ongeveer 40% van de straal van een sulfide-ion, dus deze kleine Zn2+ ionen bevinden zich in alternerende tetrahedrale gaten, dat wil zeggen, in de ene helft van de tetrahedrale gaten. Er zijn vier zinkionen en vier sulfide-ionen in de eenheidscel, waardoor de empirische formule ZnS.

Figuur 16. ZnS, zinksulfide (of zinkblende) vormt een FCC-eenheidscel met sulfide-ionen op de roosterpunten en veel kleinere zinkionen die de helft van de tetrahedrale gaten in de structuur bezetten.
Een calciumfluoride-eenheidscel, zoals die in figuur 17, is ook een FCC-eenheidscel, maar in dit geval bevinden de kationen zich op de roosterpunten; equivalente calciumionen bevinden zich op de roosterpunten van een FCC-rooster. Alle tetrahedral sites in de FCC array van calciumionen worden bezet door fluoride-ionen. Er zijn vier calciumionen en acht fluoride-ionen in een eenheidscel, wat een calcium:fluorverhouding geeft van l:2, zoals de chemische formule CaF2 vereist. Bij nadere bestudering van figuur 17 ziet men een eenvoudige kubische array van fluoride-ionen met calciumionen in de ene helft van de kubische gaten. De structuur kan niet worden beschreven in termen van een ruimtelijk rooster van punten op de fluoride-ionen omdat de fluoride-ionen niet allemaal een identieke omgeving hebben. De oriëntatie van de vier calciumionen rond de fluoride-ionen verschilt.

Figuur 17. Calciumfluoride, CaF2, vormt een FCC-eenheidscel met calciumionen (groen) in de roosterpunten en fluoride-ionen (rood) die alle tetrahedral sites tussen hen bezetten.
Berekening van ionenstralingen
Als we de randlengte van een eenheidscel van een ionische verbinding en de plaats van de ionen in de cel kennen, kunnen we ionenstralingen voor de ionen in de verbinding berekenen als we aannamen maken over individuele ionenvormen en contacten.
Voorbeeld 5: Berekening van ionstraal
De randlengte van de eenheidscel van LiCl (NaCl-achtige structuur, FCC) is 0.514 nm of 5,14 Å. Aangenomen dat het lithiumion klein genoeg is zodat de chloride-ionen met elkaar in contact komen, zoals in figuur 15, bereken dan de ionstraal voor het chloride-ion.
Noot: De lengte-eenheid angstrom, Å, wordt vaak gebruikt om afmetingen op atomaire schaal weer te geven en is gelijk aan 10-10 m.
Check Your Learning
De randlengte van de eenheidscel van KCl (NaCl-achtige structuur, FCC) bedraagt 6,28 Å. Bereken, uitgaande van anion-kation contact langs de celrand, de straal van het kaliumion. De straal van het chloride-ion is 1,82 Å.
Het is belangrijk te beseffen dat waarden voor ionische stralen berekend op basis van de randlengten van eenheidscellen afhankelijk zijn van talrijke aannames, zoals een perfecte bolvorm voor ionen, die op zijn best benaderingen zijn. Dergelijke berekende waarden zijn dus zelf benaderingen en vergelijkingen kunnen niet te ver worden doorgedreven. Niettemin is deze methode nuttig gebleken voor de berekening van ionische stralen uit experimentele metingen zoals röntgenkristallografische bepalingen.
Röntgenkristallografie
De grootte van de eenheidscel en de rangschikking van atomen in een kristal kunnen worden bepaald uit metingen van de diffractie van röntgenstralen door het kristal, röntgenkristallografie genoemd. Diffractie is de verandering van de reisrichting van een elektromagnetische golf wanneer deze een fysische barrière ontmoet waarvan de afmetingen vergelijkbaar zijn met die van de golflengte van het licht. Röntgenstraling is elektromagnetische straling met golflengten die ongeveer even lang zijn als de afstand tussen naburige atomen in kristallen (in de orde van enkele Å).
Wanneer een bundel monochromatische röntgenstralen een kristal treft, worden de stralen in alle richtingen verstrooid door de atomen in het kristal. Wanneer verstrooide golven die in dezelfde richting gaan, elkaar tegenkomen, ondergaan zij interferentie, een proces waarbij de golven combineren en een vergroting of verkleining van de amplitude (intensiteit) veroorzaken, afhankelijk van de mate waarin de maxima van de gecombineerde golven van elkaar gescheiden zijn (zie figuur 18).
Figuur 18. Lichtgolven die dezelfde ruimte innemen ondervinden interferentie, en combineren tot golven met een grotere (a) of kleinere (b) intensiteit, afhankelijk van de scheiding van hun maxima en minima.
Wanneer röntgenstralen met een bepaalde golflengte, λ, worden verstrooid door atomen in aangrenzende kristalvlakken die op een afstand, d, van elkaar zijn verwijderd, kunnen zij constructieve interferentie ondergaan wanneer het verschil tussen de afstanden die door de twee golven vóór hun combinatie zijn afgelegd een gehele factor, n, van de golflengte is. Aan deze voorwaarde is voldaan wanneer de hoek van de verstrooide bundel, θ, met de golflengte en de interatomaire afstand is verbonden door de vergelijking:
n{\lambda }=2d{sin}theta
Deze relatie staat bekend als de Bragg-vergelijking, ter ere van W. H. Bragg, de Engelse natuurkundige die dit verschijnsel voor het eerst heeft verklaard. Figuur 19 illustreert twee voorbeelden van verstrooide golven van dezelfde twee kristalvlakken. De linker figuur toont golven die worden gebroken onder de Bragghoek, hetgeen constructieve interferentie oplevert, terwijl de rechter figuur diffractie toont onder een andere hoek die niet aan de Bragg-voorwaarde voldoet, hetgeen destructieve interferentie oplevert.
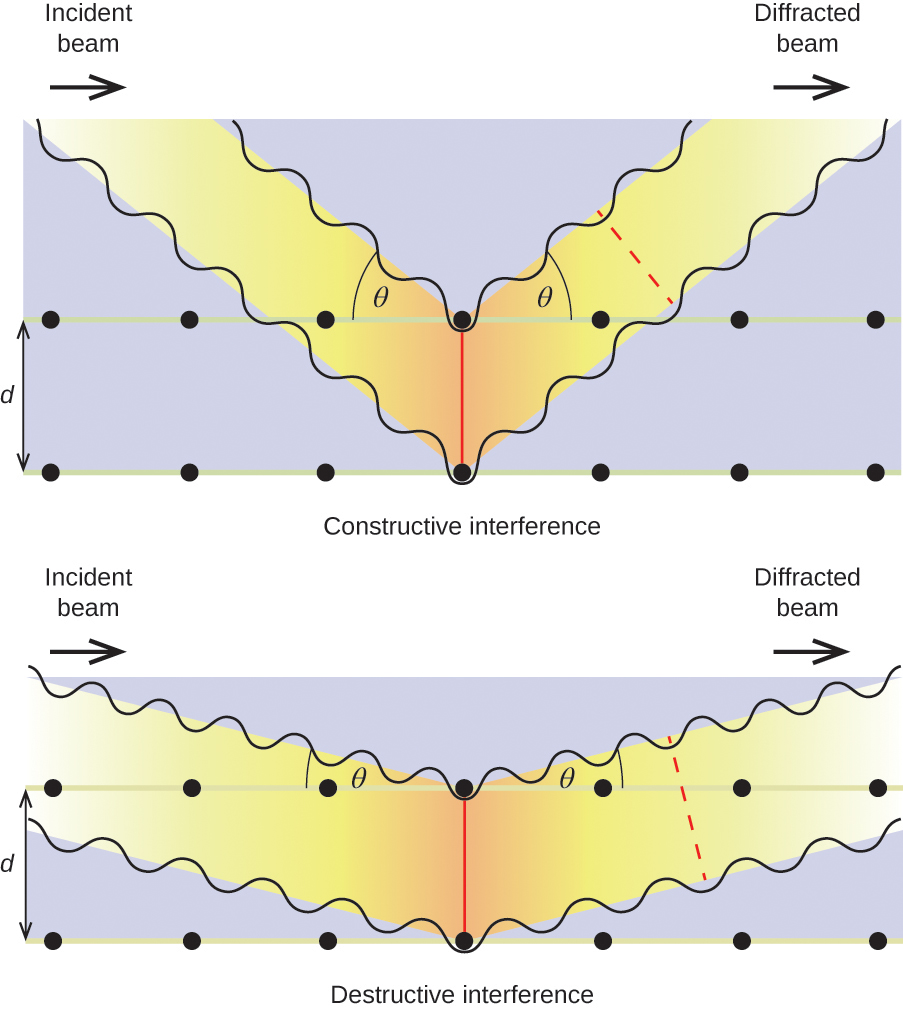
Figuur 19. De diffractie van röntgenstralen die door de atomen in een kristal worden verstrooid, maakt het mogelijk de afstand tussen de atomen te bepalen. Het bovenste beeld toont de constructieve interferentie tussen twee verstrooide golven en een resulterende verstrooide golf van hoge intensiteit. De onderste afbeelding toont de destructieve interferentie en een golf met een lage intensiteit die wordt afgeleid.
Een röntgendiffractometer, zoals die in figuur 20, kan worden gebruikt om de hoeken te meten waaronder röntgenstraling wordt gebroken bij interactie met een kristal zoals hierboven beschreven. Uit dergelijke metingen kan de Bragg-vergelijking worden gebruikt om afstanden tussen atomen te berekenen, zoals in het volgende voorbeeld wordt gedemonstreerd.
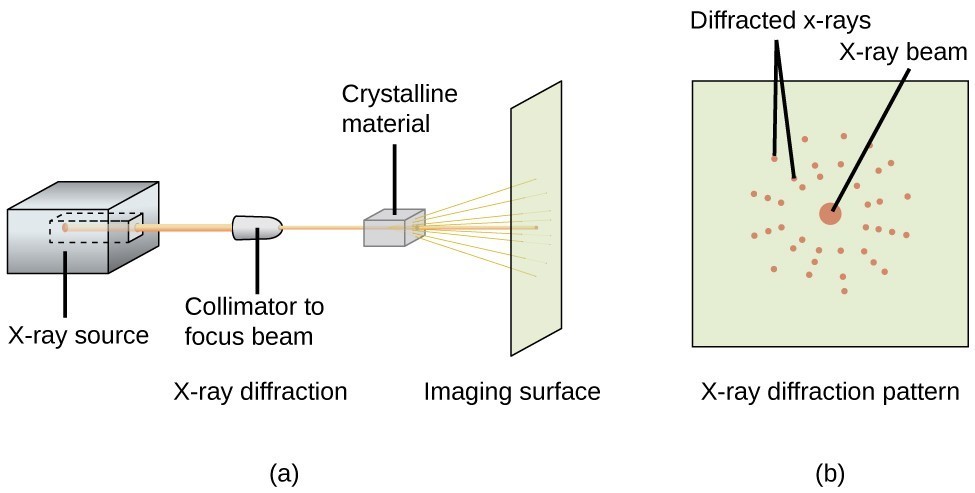
Figuur 20. In een diffractometer (a) treft een bundel röntgenstralen een kristallijn materiaal, waarbij een röntgendiffractiepatroon (b) wordt geproduceerd dat kan worden geanalyseerd om de kristalstructuur te bepalen.
Hier kunt u het transcript van “Celebrating Crystallography – An animated adventure” bekijken (opent in een nieuw venster).
Voorbeeld 6: Met behulp van de Bragg-vergelijking
In een diffractometer werd met röntgenstraling met een golflengte van 0,1315 nm een diffractiepatroon voor koper gemaakt. De eerste-ordediffractie (n = 1) vond plaats onder een hoek θ = 25,25°. Bepaal de afstand tussen de diffracterende vlakken in koper.
Check Your Learning
Een kristal met een afstand tussen de vlakken gelijk aan 0,394 nm diffundeert röntgenstraling met een golflengte van 0,147 nm. Wat is de hoek voor de eerste-ordediffractie?
Portret van een chemicus: X-ray Crystallographer Rosalind Franklin

Figuur 21. Deze illustratie toont een röntgendiffractiebeeld dat lijkt op het beeld dat Franklin in haar onderzoek vond. (credit: National Institutes of Health)
De ontdekking van de structuur van DNA in 1953 door Francis Crick en James Watson is een van de grote prestaties in de geschiedenis van de wetenschap. Zij kregen de Nobelprijs voor fysiologie of geneeskunde in 1962, samen met Maurice Wilkins, die experimenteel bewijs leverde voor de structuur van DNA. De Britse chemicus Rosalind Franklin leverde een onschatbare bijdrage aan deze monumentale prestatie door haar werk bij het meten van röntgendiffractiebeelden van DNA. In het begin van haar carrière bleek Franklins onderzoek naar de structuur van kolen van nut te zijn voor de Britse oorlogsinspanningen. Nadat ze begin jaren 1950 haar aandacht had verlegd naar biologische systemen, ontdekten Franklin en doctoraatsstudent Raymond Gosling dat DNA uit twee vormen bestaat: een lange, dunne vezel die gevormd wordt wanneer hij nat is (type “B”) en een korte, brede vezel die gevormd wordt wanneer hij gedroogd is (type “A”). Haar röntgendiffractiebeelden van DNA (Figuur 21) leverden de cruciale informatie die Watson en Crick in staat stelden te bevestigen dat DNA een dubbele helix vormt, en de details van de grootte en structuur ervan vast te stellen.
Franklin verrichtte ook baanbrekend onderzoek naar virussen en het RNA dat hun genetische informatie bevat, en bracht nieuwe informatie aan het licht die de hoeveelheid kennis op dit gebied radicaal veranderde. Nadat ze eierstokkanker had gekregen, bleef Franklin doorwerken tot haar dood in 1958 op 37-jarige leeftijd. Een van de vele postume erkenningen van haar werk was dat de Chicago Medical School of Finch University of Health Sciences in 2004 haar naam veranderde in de Rosalind Franklin University of Medicine and Science, en een afbeelding van haar beroemde röntgendiffractie-afbeelding van DNA aannam als het officiële universiteitslogo.
Key Concepts and Summary
De structuren van kristallijne metalen en eenvoudige ionische verbindingen kunnen worden beschreven in termen van pakking van bollen. Metaalatomen kunnen zich oppakken in hexagonale dicht opeen gepakte structuren, kubische dicht opeen gepakte structuren, lichaamsgecentreerde structuren, en eenvoudige kubische structuren. De anionen in eenvoudige ionische structuren nemen gewoonlijk één van deze structuren aan, en de kationen bezetten de ruimten die tussen de anionen overblijven. Kleine kationen bezetten gewoonlijk tetrahedrale gaten in een dicht opeen gepakte rij anionen. Grotere kationen bezetten meestal octahedrale gaten. Nog grotere kationen kunnen kubische gaten bezetten in een eenvoudige kubische opstelling van anionen. De structuur van een vaste stof kan worden beschreven door de grootte en vorm van een eenheidscel en de inhoud van de cel aan te geven. Het type structuur en de afmetingen van de eenheidscel kunnen worden bepaald door röntgendiffractiemetingen.
Key Equations
- n{lambda }=2d{sin}theta
Try It
- Beschrijf de kristalstructuur van ijzer, dat kristalliseert met twee equivalente metaalatomen in een kubische eenheidscel.
- Beschrijf de kristalstructuur van Pt, dat met vier equivalente metaalatomen in een kubische eenheidscel kristalliseert.
- Wat is het coördinatiegetal van een chroomatoom in de lichaamsgecentreerde kubische structuur van chroom?
- Wat is het coördinatiegetal van een aluminiumatoom in de gezichtsgecentreerde kubische structuur van aluminium?
- Kobaltmetaal kristalliseert in een hexagonale dicht opeen gepakte structuur. Wat is het coördinatiegetal van een kobaltatoom?
- Nikkelmetaal kristalliseert in een kubische dichtst gepakte structuur. Wat is het coördinatiegetal van een nikkelatoom?
- Wolfraam kristalliseert in een lichaam-gecentreerde kubische eenheidscel met een randlengte van 3,165 Å.
- Wat is de atomaire straal van wolfraam in deze structuur?
- Bereken de dichtheid van wolfraam.
- Platina (atomaire straal = 1,38 Å) kristalliseert in een kubische dicht opeengepakte structuur. Bereken de randlengte van de face-centered cubic eenheidscel en de dichtheid van platina.
- Barium kristalliseert in een body-centered cubic eenheidscel met een randlengte van 5.025 Å
- Wat is de atomaire straal van barium in deze structuur?
- Bereken de dichtheid van barium.
- Aluminium (atomaire straal = 1,43 Å) kristalliseert in een kubische dicht opeengepakte structuur. Bereken de randlengte van de face-centered cubic eenheidscel en de dichtheid van aluminium.
- De dichtheid van aluminium is 2,7 g/cm3; die van silicium is 2,3 g/cm3. Leg uit waarom Si de lagere dichtheid heeft, ook al heeft het zwaardere atomen.
- De vrije ruimte in een metaal kan worden gevonden door het volume van de atomen in een eenheidscel af te trekken van het volume van de cel. Bereken het percentage vrije ruimte in elk van de drie kubische roosters als alle atomen in elk even groot zijn en hun naaste buren raken. Welke van deze structuren vertegenwoordigt de meest efficiënte verpakking? Dat wil zeggen, welke pakt in met de minste ongebruikte ruimte?
- Cadmiumsulfide, soms door kunstenaars gebruikt als geel pigment, kristalliseert met cadmium, dat de helft van de tetrahedrale gaten inneemt in een dicht opeengepakte rij sulfide-ionen. Wat is de formule van cadmiumsulfide? Leg uw antwoord uit.
- Een verbinding van cadmium, tin en fosfor wordt gebruikt bij de fabricage van sommige halfgeleiders. Het kristalliseert met cadmium bezet een vierde van de tetrahedrale gaten en tin bezet een vierde van de tetrahedrale gaten in een dicht opeengepakte array van fosfide-ionen. Wat is de formule van de verbinding? Leg uw antwoord uit.
- Wat is de formule van het magnetische kobaltoxide, dat wordt gebruikt in opnametapes en kristalliseert met kobaltatomen die een achtste van de tetrahedrale gaten en de helft van de octahedrale gaten in een dicht opeengepakte array van oxide-ionen bezetten?
- Een verbinding die zink, aluminium en zwavel bevat, kristalliseert met een dicht opeengepakte array van sulfide-ionen. Zinkionen bevinden zich in een achtste van de tetrahedrale gaten en aluminiumionen in de helft van de octahedrale gaten. Wat is de empirische formule van deze verbinding?
- Een verbinding van thallium en jodium kristalliseert in een eenvoudige kubische array van jodide-ionen met thallium-ionen in alle kubische gaten. Wat is de formule van dit jodide? Leg uw antwoord uit.
- Welk van de volgende elementen reageert met zwavel om een vaste stof te vormen waarin de zwavelatomen een dicht opeen gepakte array vormen met alle octahedrale gaten bezet: Li, Na, Be, Ca, of Al?
- Wat is het massapercentage titaan in rutiel, een mineraal dat titaan en zuurstof bevat, als de structuur kan worden beschreven als een dicht opeengepakte array van oxide-ionen met titaanionen in de helft van de octaëdervormige gaten? Wat is het oxidatiegetal van titaan?
- Verklar waarom de chemisch gelijksoortige alkalimetaalchloriden NaCl en CsCl verschillende structuren hebben, terwijl de chemisch verschillende NaCl en MnS dezelfde structuur hebben.
- Toen mineralen uit het gesmolten magma werden gevormd, bezetten verschillende ionen dezelfde cites in de kristallen. Lithium komt vaak samen met magnesium in mineralen voor, ondanks het verschil in lading van hun ionen. Geef een verklaring.
- Rubidiumjodide kristalliseert met een kubische eenheidscel die jodide-ionen bevat op de hoeken en een rubidiumion in het centrum. Wat is de formule van de verbinding?
- Een van de verschillende mangaanoxiden kristalliseert met een kubische eenheidscel die mangaanionen bevat op de hoeken en in het centrum. De oxide-ionen bevinden zich in het midden van elke rand van de eenheidscel. Wat is de formule van de verbinding?
- NaH kristalliseert met dezelfde kristalstructuur als NaCl. De randlengte van de kubische eenheidscel van NaH is 4,880 Å.
- Bereken de ionstraal van H-. (De ionstraal van Li+ is 0,0,95 Å.)
- Bereken de dichtheid van NaH.
- Thallium(I)-jodide kristalliseert met dezelfde structuur als CsCl. De randlengte van de eenheidscel van TlI is 4,20 Å.
- Bereken de ionstraal van TI+. (De ionstraal van I- is 2,16 Å.)
- Bereken de dichtheid van TlI.
- Een kubische eenheidscel bevat mangaanionen op de hoeken en fluoride-ionen in het midden van elke rand.
- Wat is de empirische formule van deze verbinding? Leg uw antwoord uit.
- Wat is het coördinatiegetal van het Mn3+ ion?
- Bereken de randlengte van de eenheidscel als de straal van een Mn3+ ion 0,65 A is.
- Bereken de dichtheid van de verbinding.
- Wat is de afstand tussen kristalvlakken die röntgenstraling met een golflengte van 1,541 nm bij een hoek θ van 15,55° diffunderen (eerste-orde-reflectie)?
- Een diffractometer die röntgenstraling met een golflengte van 0,2287 nm gebruikt, produceert een eerste-orde-diffractiepiek bij een kristalhoek θ = 16,21°. Bepaal de afstand tussen de diffracterende vlakken in dit kristal.
- Een metaal met een afstand tussen de vlakken gelijk aan 0,4164 nm diffracteert röntgenstraling met een golflengte van 0,2879 nm. Wat is de diffractiehoek voor de eerste-orde-diffractiepiek?
- Goud kristalliseert in een face-centered cubic eenheidscel. De tweede-orde-reflectie (n = 2) van röntgenstraling voor de vlakken die de boven- en onderkant van de eenheidscellen vormen, ligt bij θ = 22,20°. De golflengte van de röntgenstraling is 1,54 Å. Wat is de dichtheid van metallisch goud?
- Als een elektron in een aangeslagen molybdeenatoom van de L- naar de K-schil valt, wordt er een röntgenstraling uitgezonden. Deze röntgenstraling wordt onder een hoek van 7,75° afgebogen door vlakken met een onderlinge afstand van 2,64 Å. Wat is het energieverschil tussen de K-schil en de L-schil in molybdeen, uitgaande van een eerste-orde diffractie?
Glossary
lichaamsgecentreerde kubus (BCC) vaste stof: kristallijne structuur met een kubische eenheidscel met roosterpunten op de hoeken en in het midden van de cel
lichaamsgecentreerde kubische eenheidscel: eenvoudigste zich herhalende eenheid van een lichaamsgecentreerd kubisch kristal; het is een kubus met roosterpunten op elke hoek en in het midden van de kubus
Bragg-vergelijking: vergelijking die betrekking heeft op de hoeken waaronder röntgenstraling door de atomen in een kristal wordt gebroken
coordinatiegetal: aantal atomen dat het dichtst bij een bepaald atoom in een kristal of bij het centrale metaalatoom in een complex ligt
cubic closest packing (CCP): kristalstructuur waarin vlakken van dicht opeengepakte atomen of ionen zijn gestapeld als een reeks van drie alternerende lagen met verschillende relatieve oriëntaties (ABC)
diffractie: Omleiding van elektromagnetische straling die optreedt wanneer deze een fysieke barrière van geschikte afmetingen tegenkomt
face-centered cubic (FCC) solid: kristallijne structuur bestaande uit een kubische eenheidscel met roosterpunten op de hoeken en in het midden van elk face
face-centered cubic eenheidscel: eenvoudigste zich herhalende eenheid van een face-centered cubic kristal; het is een kubus met roosterpunten op elke hoek en in het midden van elk vlak
hexagonal closest packing (HCP): kristallijne structuur waarin dicht opeengepakte lagen atomen of ionen zijn gestapeld als een reeks van twee afwisselende lagen met verschillende relatieve oriëntaties (AB)
gat: (ook, spleet) ruimte tussen atomen binnen een kristal
isomorf: dezelfde kristalstructuur bezittend
octahedraal gat: open ruimte in een kristal in het centrum van zes deeltjes die zich op de hoeken van een octaëder bevinden
eenvoudige kubische eenheidscel: (ook, primitieve kubische eenheidscel) eenheidscel in de eenvoudige kubische structuur
eenvoudige kubische structuur: kristalstructuur met een kubische eenheidscel met alleen op de hoeken roosterpunten
ruimte rooster: alle punten binnen een kristal die identieke omgevingen hebben
tetrahedraal gat: tetrahedrale ruimte gevormd door vier atomen of ionen in een kristal
eenheidscel: kleinste deel van een ruimterooster dat in drie dimensies wordt herhaald om het gehele rooster te vormen
röntgenkristallografie: experimentele techniek voor het bepalen van afstanden tussen atomen in een kristal door het meten van de hoeken waaronder röntgenstralen worden gebroken wanneer ze door het kristal gaan


