Intracellulaire signalen, zoals schade aan het DNA van de cel, sturen apoptose hoofdzakelijk aan via de intrinsieke weg. De intrinsieke apoptoseweg, waarbij geconserveerde signaaleiwitten betrokken zijn, is fysiek verbonden met mitochondriën en is bij vertebraten gevoelig voor mitochondriale oxidatieve stress. De route wordt beïnvloed door leden van de Bcl-familie die aan het mitochondriale membraan zijn gebonden, waaronder Bax- en Bcl-2-gen, die respectievelijk als pro- of anti-apoptotische regulerende eiwitten fungeren.
Overzicht van de intrinsieke-apoptoseweg
De intrinsieke-apoptoseweg wordt op gang gebracht door bijvoorbeeld chemotherapie en/of radiotherapie. Het wordt geactiveerd door een reeks exogene en endogene stimuli, zoals DNA-schade, ischemie, en oxidatieve stress. Bovendien speelt het een belangrijke functie in de ontwikkeling en in de eliminatie van beschadigde cellen.
In de intrinsieke route is het functionele gevolg van pro-apoptotische signalering de verstoring van de mitochondriale membraan en het vrijkomen van cytochroom c in het cytoplasma, waar het een complex of apoptosoom vormt met apoptotic protease activating factor 1 (APAF1) en de inactieve vorm van caspase-9. Dit complex hydrolyseert adenosososoom 1 (APAF1) en de inactieve vorm van caspase-9. Dit complex hydrolyseert adenosine trifosfaat om caspase-9 te klieven en te activeren. De initiator caspase-9 splitst en activeert vervolgens de uitvoerende caspasen-3/6/7, wat leidt tot celapoptose. Dit is totaal verschillend van de extracellulaire signalen, die gewoonlijk door cytotoxische cellen van het immuunsysteem worden opgewekt en apoptose voornamelijk via de extrinsieke route in gang zetten.
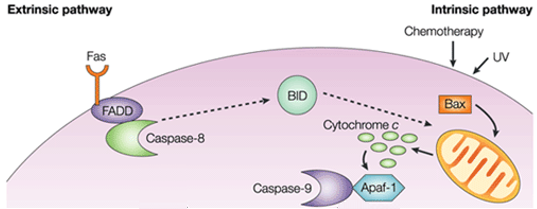
Figuur 1. Verschil tussen extrinsieke en intrinsieke pathway.
Proces en regulatie van de intrinsieke apoptose pathway
De intrinsieke apoptose pathway induceert apoptose door directe activering van caspase-3 of door splitsing van bid (BH3-interacting domain death agonist), wat resulteert in mitochondriale disfunctie en daaropvolgende vrijgave van cytochroom c en activering van caspasen-9 en caspasen-3. Caspase-3 bevordert de typische apoptose-kenmerken, waaronder DNA-fragmentatie en celdood in verschillende weefsels.
De B-cel lymfoom 2 (Bcl-2) eiwitfamilie controleert nauwgezet de activering van de intrinsieke pathway. Het wordt aangetroffen in folliculair lymfoom en voor het eerst geïdentificeerd als een van de genen die betrokken zijn bij de celdood door ofwel pro-apoptotische apoptose te activeren ofwel anti-apoptotische apoptose te remmen. Eiwitten in één subgroep, waaronder Bid, Bad, Bim, Bmf, Puma en Noxa, bevatten een enkel Bcl-2 homologie 3 domein (BH3-only eiwitten) en hebben pro-apoptotische activiteit. Twee andere subsets van eiwitten hebben meerdere BH domeinen. De eerste subset, waaronder Bcl-2 geassocieerd X-eiwit (Bax), Bcl-2 homologe antagonist/moordenaar (Bak) en Bcl-2 familie apoptose regulator (Bok), is pro-apoptotisch; de andere subset, waaronder Bcl-2, Bcl-XL en Mcl-1, is anti-apoptotisch. De mitochondriale route wordt gedeeltelijk beïnvloed door leden van de Bcl-familie die aan het mitochondriale membraan zijn gebonden, waaronder zowel de pro-apoptotische regulerende eiwitten Bax als de anti-apoptotische regulerende eiwitten Bcl-2.
De pro-apoptotische moleculen veroorzaken permeabilisatie van het buitenste mitochondriale membraan, wat leidt tot uitstroom van cytochroom c, dat de adaptor Apaf-1 en de initiator caspase-9 in het cytosol bindt om het apoptosoomcomplex te vormen. Dit stimuleert caspase-9, dat op zijn beurt de effector-caspasen activeert. Het mitochondrium laat ook een eiwit genaamd Smac/DIABLO los in het cytosol. Smac/DIABLO bevordert indirect apoptose door de effecten te blokkeren van een groep anti-apoptotische eiwitten die inhibitor of apoptosis proteins (IAP’s) worden genoemd.
De anti-apoptotische eiwitten Bcl-2 en Bcl-XL remmen de afgifte van cytochroom c, terwijl Bax, Bak en Bid, alle pro-apoptotische eiwitten, de afgifte ervan uit de mitochondriën bevorderen. Cytochroom c en desoxyadenosinetrifosfaat (dATP) binden zich aan APAF-1 en vormen een multimeer complex dat pro-caspase-9, een apoptose-bevorderend protease dat op zijn beurt de caspase cascade activeert, wat resulteert in celapoptose, rekruteert en activeert. Tijdens dit proces zijn caspase-2, caspase-8, caspase-9 en caspase-10 betrokken bij de initiatie van apoptose. Caspase-3, caspase-6 en caspase-7 zijn betrokken bij apoptose. Caspase-3 en caspase-7 reguleren de remming van DNA-herstel en starten de DNA-afbraak. Bovendien reguleert caspase-6 de desintegratie van de lamina en het cytoskelet.
Intrinsieke apoptoseweg in de pathofysiologie
De meeste chemotherapeutische en gerichte kankertherapieën doden tumorcellen door het opwekken van pro-dood signalering die de intrinsieke apoptoseweg van geprogrammeerde celdood in gang zet. Het keerpunt in de apoptotische cascade is mitochondriale permeabilisatie van de buitenmembraan (MOMP); zodra dit heeft plaatsgevonden, leidt mitochondriale permeabilisatie tot de vorming van een apoptosoom, dat caspase activering vergemakkelijkt en vervolgens de andere kenmerken van apoptotische celdood in gang zet. De cellulaire beslissing om MOMP te starten wordt gecontroleerd door een delicaat evenwicht tussen de pro- en anti-apoptotische moleculen van de BCL-2 familie.
Een van de redenen voor resistentie tegen chemotherapie is het falen van tumorcellen om tot apoptose over te gaan als gevolg van defecten in de intrinsieke apoptotische route (b.v. veranderingen in p53). Ondanks aanzienlijke verbeteringen in de behandeling blijven de genezingspercentages voor veel kankers suboptimaal. De opkomst van cytotoxische chemotherapie heeft geleid tot een curatieve therapie voor een subset van kankers, hoewel intrinsieke resistentie tegen behandeling moeilijk te voorspellen is voor individuele patiënten. De golf van moleculair gerichte therapieën heeft zich geconcentreerd op geneesmiddel-activerende mutaties en is derhalve beperkt tot specifieke subgroepen van patiënten. De intrinsieke mitochondriale weg van apoptose is een veelbelovend doelwit voor nieuwe therapieën, en het succesvol aanpakken van deze weg heeft het potentieel om het therapeutische landschap van de therapie voor een verscheidenheid van kankers te veranderen.