Inleiding
β amyloïd en gefosforyleerde tau-eiwitten zijn pathologische kenmerken van de ziekte van Alzheimer (AD) die zich opstapelen en op voorspelbare wijze verspreiden door neurale netwerken, waardoor progressieve metabolische afwijkingen, neuronale schade en celdood ontstaan. Neurobeeldvorming vergemakkelijkt een gedetailleerde beoordeling van deze pathologische veranderingen bij patiënten die een workup ondergaan voor cognitieve achteruitgang. Voorheen was een definitieve diagnose van AD alleen mogelijk door postmortale observatie en neuro-anatomische stadiëring van deze eiwitaggregaten. Recente vooruitgang op het gebied van moleculaire beeldvorming maakt het echter mogelijk amyloïd- en tau-afzettingen in levende menselijke hersenen te visualiseren en heeft ons dichter bij een in vivo definitieve diagnose van AD gebracht.
Structurele beeldvorming
De richtlijnen van de American Academy of Neurology (AAN) voor diagnostische workup van mensen met cognitieve klachten1 bevelen structurele beeldvorming van de hersenen aan met niet-contrast CT of MRI bij elke persoon met een positieve klinische voorgeschiedenis en objectieve cognitieve veranderingen. In deze context is de primaire rol van beeldvorming van de hersenen het uitsluiten van niet-degeneratieve structurele laesies, waarvan 5% mogelijk niet uit de klinische anamnese of lichamelijk onderzoek blijkt2 en die mogelijk behandelbaar zijn. De AAN beveelt ook aan vasculaire dementie (VaD), dementie met Lewy lichaampjes (DLB), en frontotemporale dementie (FTD) klinisch uit te sluiten. Structurele beeldvorming kan de diagnostische zekerheid verbeteren en de klinische diagnose in 19% tot 28% veranderen, evenals het management in 15% van de klinische gevallen.2
De beeldvormingsmodaliteiten bij uitstek voor het beoordelen van structurele atrofie zijn CT en MRI. Ziekte-specifieke patronen van atrofie zijn grondig beschreven en gevalideerd met behulp van deze modaliteiten. Hoewel atrofie waarneembaar is op CT, resulteren de lagere ruimtelijke resolutie en het inferieure grijs/witte stof contrast in het verlies van potentieel bruikbare subtiele waarnemingen betreffende neurodegeneratieve veranderingen. Daarom vertrouwen clinici vaak op MRI om het patroon en de ernst van structurele veranderingen te beoordelen, om niet-neurodegeneratieve oorzaken van cognitieve achteruitgang uit te sluiten, en om de ernst en omvang van veranderingen in de witte stof te evalueren, zoals hieronder in meer detail wordt besproken.
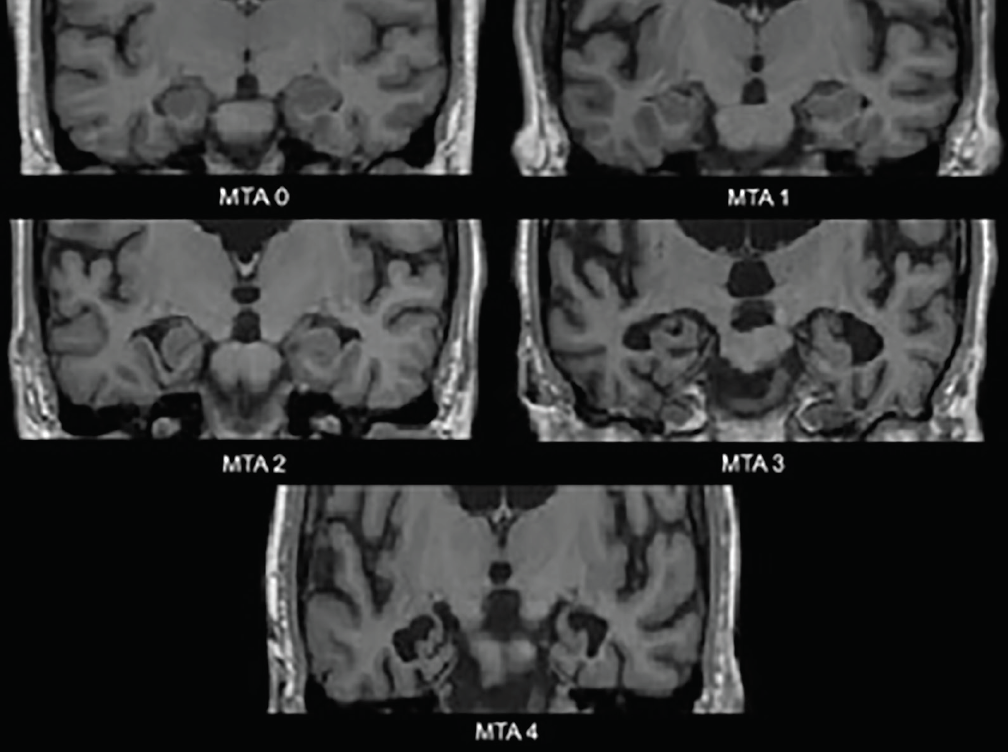
De vroegste neurodegeneratieve veranderingen bij AD treden op in de mediale temporale kwabben – de hippocampus, entorhinale cortex, en parahippocampale gyrus. Naarmate atrofie optreedt, worden de vaatspleet en de temporale hoorn van de laterale ventrikel verwijdt; deze veranderingen worden het best beoordeeld in het coronale vlak. Een veel gebruikte visuele beoordeling schaal gebaseerd op deze structuren-de mediale temporale atrofie (MTA) schaal (figuur 1)-is klinisch3 en neuropathologisch4 gevalideerd. Verschillende studies die gebruikmaken van deze schaal of de structuren die hij beoordeelt, hebben een significant vermogen aangetoond om mensen met de ziekte van Alzheimer te onderscheiden van leeftijdsgematchte controles4 of mensen met DLB4 of vasculaire cognitieve stoornissen (VCI).5 Mediale temporale atrofie is ook voorspellend voor de conversie van amnestische milde cognitieve stoornissen (MCI) naar Alzheimerdementie.3
Klik om groter te zien
Figuur 1. Mediale temporale atrofie (MTA) schaal ratings. MTA 0-geen tot minimale gapping van het vaatvlies fissuur; MTA 1-subtiele verbreding van het vaatvlies fissuur; MTA 2-verdere verbreding van het vaatvlies fissuur die fuseert met de temporale hoorn van het laterale ventrikel, lichte daling van de hoogte van de hippocampus formatie; MTA 3-gematigde afname van de hoogte van de hippocampusvorming, opvallende vergroting van de temporale hoorn van de laterale ventrikel; MTA 4-sterke afname van de hoogte van de hippocampusvorming, opvallende vergroting van de temporale hoorn van de laterale ventrikel.
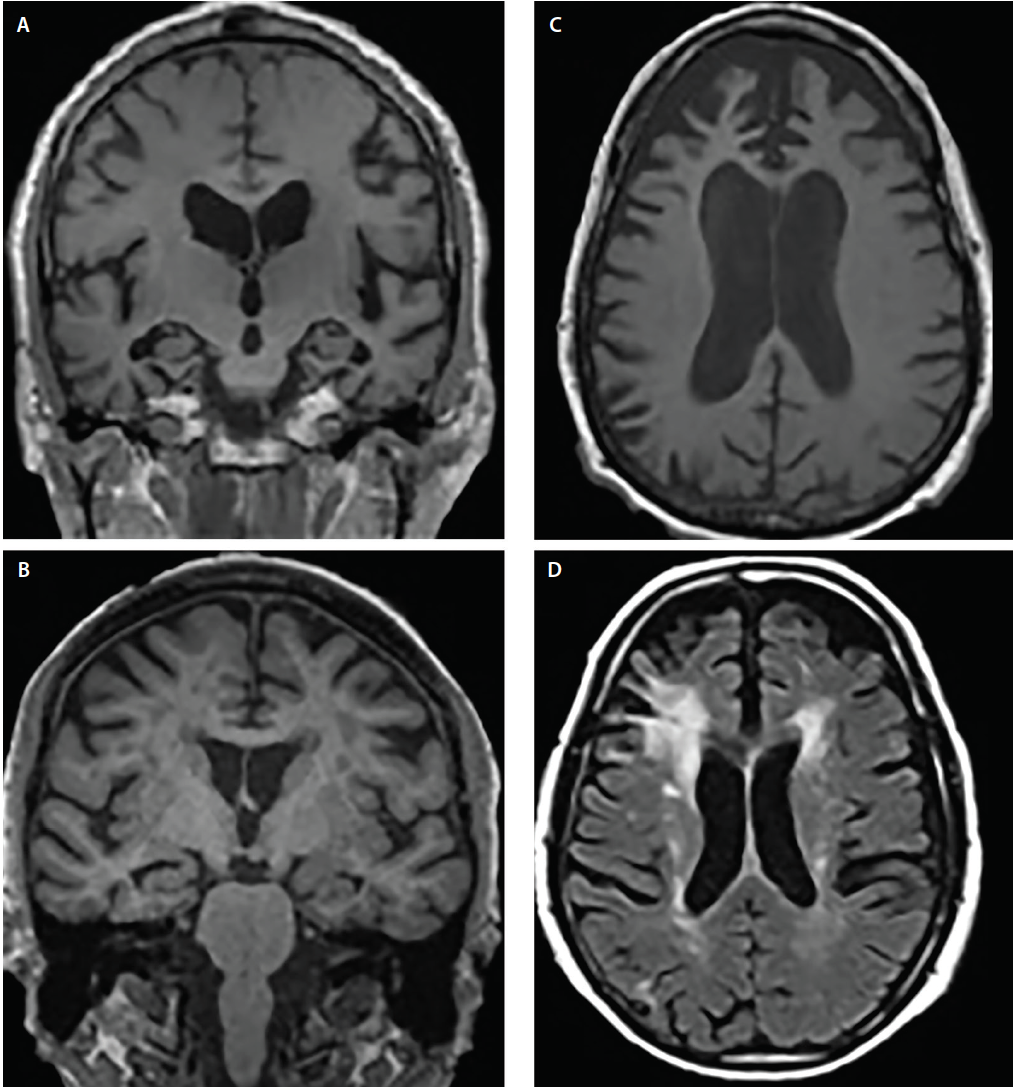
Dementiesyndromen vertonen gewoonlijk canonieke atrofie patronen6 die corresponderen met cognitieve en gedragssymptomen; de betrokken structuren kunnen elkaar echter overlappen. Bijvoorbeeld, AD en DLB tonen beide betrokkenheid van de mediale temporale kwab, maar verschillende beeldvormende en neuropathologische studies hebben aangetoond dat, in vergelijking met AD, DLB aanzienlijk minder predilectie heeft voor mediale temporale structuren4,5 (figuur 2).
Klik om groter te zien
Figuur 2. Structurele atrofie patronen bij de ziekte van Alzheimer (AD) (A), dementie met Lewy lichaampjes (DLB) (B), frontotemporale dementie (FTD) (C) en vasculaire dementie (VaD) (D). Coronale T1-gewogen MRI toont gegeneraliseerde corticale atrofie maar verschillende gradaties van hippocampale atrofie in AD (A) en DLB (B). Axiale T1-gewogen MRI toont bvFTD atrofie met een focale predilectie voor de mediale en laterale prefrontale cortex (C). Axiale T2-gewogen MRI toont confluente periventriculaire cap en halo witte stof hypointensiteiten (WMHs) waarbij de corona radiata betrokken is en zich uitstrekt tot in de laterale prefrontale neocortex, milde verspreide WMHs en WMHs van de subependymale ventriculaire bekleding en septum pellucidum in VaD (D).
Zowel AD als frontotemporale kwabdegeneratie (FTLD) hebben overlappende gebieden van atrofie, waaronder gebieden van prefrontale, orbitofrontale en anterieure insulaire cortexen, evenals de anterieure en mediale temporale kwabben.6 Ten opzichte van elkaar vertoont AD echter significant meer atrofie in de laterale pariëtale en occipitale cortex, terwijl FTLD meer atrofie vertoont in de frontale kwabben (figuur 2).6
Het is belangrijk om systematisch alle hersengebieden te beoordelen, waarbij zowel gebieden met structurele atrofie als gebieden met anatomische sparing worden opgemerkt, om zo veel mogelijk gebruik te maken van diagnostische beeldvorming. Een groot, multicenter onderzoek beoordeelde onlangs het vermogen van 6 visuele beoordelingsschalen om 186 pathologisch bevestigde gevallen van AD, DLB en FTLD correct te classificeren.6 Dit onderzoek toonde aan dat het gelijktijdig beoordelen van meerdere ziektespecifieke gebieden significant betere discriminatie opleverde dan het focussen op een enkel gebied.4
Vasculaire schade is een belangrijke overweging bij het beoordelen van personen met cognitieve stoornissen. Ischemische veranderingen komen vaak voor bij normale veroudering en worden versneld door veel voorkomende comorbiditeiten (bijv. hypertensie, diabetes en hypercholesterolemie). Vasculaire bijdragen aan cognitieve stoornissen worden vaak afgeleid wanneer significante witte stof hyperintensiteiten (WMH), corticale beroertes, of strategisch gelegen lacunes worden gedetecteerd op T2-gewogen of fluid attenuated inversion recovery (FLAIR) sequenties. Lacunaire beroerten van de basale ganglia en WMH in het centrum semiovale en corona radiata zijn indicatoren van chronische ischemische schade door kleine bloedvaten (figuur 2). Periventriculaire kapjes zijn daarentegen vaak van niet-ischemische oorsprong en weerspiegelen subependymale gliosis.7 Er bestaan verschillende WMH-ernstschalen (bv. de Fazekas-schaal)7 die in klinische settings kunnen worden gebruikt. Alle scoringsalgoritmen zijn het erover eens dat wijdverspreide confluente WMH en subcorticale lacunaire infarcten, althans gedeeltelijk, waarschijnlijk bijdragen tot cognitieve achteruitgang.7
Diffusie tensor imaging (DTI) is een nieuwe MRI-sequentie die gevoelig is voor de diffusie van water door weefsel en die de integriteit van de witte stof beoordeelt omdat de architectuur van axonen de waterstroom beperkt. Gemiddelde diffusie en fractionele anisotropie worden vaak gebruikt om neurodegeneratieve veranderingen op DTI te karakteriseren. De eerste meet de grootte van de diffusie en de laatste meet of water bij voorkeur in één richting stroomt zoals verwacht in gezonde axonen. Verlaagde gemiddelde diffusie en verminderde fractionele anisotropie zijn consequent gerapporteerd in zowel MCI en dementie AD populaties.8 Verschillende studies hebben ook DTI veranderingen geïdentificeerd in asymptomatische personen met een risico op het ontwikkelen van AD9 wat aangeeft dat deze veranderingen vroeg in het ziektebeloop optreden. Naast het beoordelen van witte stof integriteit, kan DTI worden gebruikt om grove structurele connectiviteit tussen corticale regio’s te modelleren met behulp van tractografie algoritmen. Dit heeft aan belang gewonnen op het gebied van AD, omdat er aanwijzingen zijn dat amyloïde en tau pathologie zich kan verspreiden via hersenverbindingen.10 Hoewel DTI potentieel vertoont als een maat voor de integriteit van de witte stof, beperken de gevoeligheid voor beweging en andere technische beperkingen, althans voorlopig, de klinische toepassing ervan.
Functional Imaging
Hypometabolisme van de hersenen wordt gemakkelijk waargenomen bij neurodegeneratieve aandoeningen en kan helpen bij de differentiële diagnose. De functie van de neuronen is afhankelijk van zuurstof en glucose uit het bloed, waarvan de toevoer wordt vergemakkelijkt door regionale vasodilatatie. 18F-fluorodeoxyglucose positron emissie tomografie (FDG-PET) geeft indirect de mate van corticale activiteit weer en kan gemakkelijk worden gebruikt om neurodegeneratieve veranderingen zichtbaar te maken door gebruik te maken van deze metabole afhankelijkheid van glucose.
De karakteristieke hypometabole corticale signatuur van AD bestaat uit vroege veranderingen in het achterste cingulate (PCC); precuneus; temporale, pariëtale, en, in latere stadia, frontale cortices. Dit patroon manifesteert zich al vroeg, zelfs presymptomatisch,11 en is klinisch nuttig om AD van FTD te onderscheiden.12 In tegenstelling tot AD vertoont de metabole signatuur van FTD hypometabolisme in het frontale, anterieure temporale, basale ganglia en thalamus, waarbij de posterieure associatiecortices relatief gespaard blijven.13 In klinisch onzekere situaties kunnen clinici deze metabole signaturen gebruiken om AD van FTD te onderscheiden.12 Hoewel de neocorticale metabole signatuur van DLB een verwarrende overlap kan vertonen met die van AD, kunnen DLB-gevallen ook occipitale hypometabolisme vertonen.14
Het Center for Medicare & Medicaid Services acht FDG-PET alleen “redelijk en noodzakelijk” voor mensen die voldoen aan de criteria voor zowel AD als FTD, bij wie een volledige diagnostische workup volgens de AAN-richtlijnen1 niet definitief een etiologie heeft vastgesteld.15
Functionele MRI (fMRI) kan ook hersenactiviteit meten door sequenties te gebruiken die gevoelig zijn voor temporele veranderingen in zuurstofrijk/zuurstofrijk hemoglobine als gevolg van hersenactiviteit. Op deze manier is fMRI verwant met FDG-PET omdat de veranderingen in hemoglobine worden aangedreven door het glucosemetabolisme dat nodig is voor de hersenactiviteit. Temporele afhankelijkheden tussen regio’s kunnen worden gebruikt om functionele connectiviteit af te leiden (d.w.z. welke regio’s actief met elkaar communiceren). In vergelijking met FDG-PET biedt fMRI een betere ruimtelijke resolutie, waardoor de connectiviteit nauwkeuriger in kaart kan worden gebracht. Een ander voordeel van fMRI is dat het kan worden verkregen tijdens de uitvoering van een taak of in rust. In het eerste geval worden connectiviteitspatronen geïdentificeerd die worden aangestuurd door specifieke actieve toestanden, terwijl in het tweede geval connectiviteitspatronen worden geïdentificeerd die aanwezig zijn in rust en bekend staan als het default mode network (DMN). Het DMN wordt gedefinieerd door functionele hubs, de PCC en de precuneus, die in verbinding staan met een dorsaal mediaal subsysteem en een mediaal temporaal subsysteem.16 Aangenomen wordt dat de afzetting van amyloïd begint in de functionele hubs van het DMN. Het is bekend dat het DMN wordt aangetast bij AD.16 Daarentegen wordt het DMN gespaard bij FTD terwijl salience of aandachtsnetwerken worden aangetast.17 Momenteel is fMRI-technologie beperkt tot onderzoekstoepassingen, maar er wordt actief gezocht naar mogelijkheden om relevante klinisch toepasbare algoritmen te ontwikkelen.
Molecular Imaging
De maatstaf voor een definitieve diagnose van AD is postmortaal neuropathologisch hersenonderzoek. Zelfs in de handen van ervaren dementiedeskundigen bereikt de klinische diagnose van AD slechts de verontrustende sensitiviteit van 70,9% tot 87,3% en specificiteit van 44,3% tot 70,8%.18 Het meest relevant voor een verbeterde klinische diagnostische nauwkeurigheid van AD is de ontwikkeling van radioactief gemerkte PET beeldvormende tracers met specifieke affiniteit voor AD-gerelateerde ß amyloïd en gefosforyleerde tau aggregaten (figuur 3), die in vivo demonstratie van de onderliggende neuropathologie mogelijk maken (tabel), wat vroeger alleen postmortaal mogelijk was. Axiale amyloïd-PET met amyloïd-negatieve (A) en amyloïd-positieve scans (B). In amyloïd negatieve beelden (A) vertoont het radiotracer signaal een lage intensiteit en is beperkt tot niet-specifieke witte stof binding. De grijs/witte stof overgang is bewaard gebleven. Bij positieve amyloïdbeelden (B) heeft het radiotracer-signaal een hoge intensiteit en strekt het zich diffuus uit tot in de grijze corticale gebieden, waardoor de grijs/witte stof overgang niet meer zichtbaar is. Coronale tau-PET toont tau-negatieve (C) en tau-positieve (D) scans. Bij tau-negatieve scans is er een minimaal, aspecifiek radiotracer-signaal van lage intensiteit in de mediale temporale, basale voorhersenen en basale ganglia. In tau-positieve scans (D) is het radiotracer signaal van hogere intensiteit en betreft het de inferieure en laterale temporale cortex volgens het bekende traject van progressie van neurofibrillaire tangles.
Klik om groter te zien
Figuur 3. Axiale amyloïd-PET met amyloïd-negatieve (A) en amyloïd-positieve scans (B). Bij amyloïd negatieve opnamen (A) vertoont het radiotracer signaal een lage intensiteit en is beperkt tot niet-specifieke witte stof binding. De grijs/witte stof overgang is bewaard gebleven. Bij positieve amyloïdbeelden (B) heeft het radiotracer-signaal een hoge intensiteit en strekt het zich diffuus uit tot in de grijze corticale gebieden, waardoor de grijs/witte stof overgang niet meer zichtbaar is. Coronale tau-PET toont tau-negatieve (C) en tau-positieve (D) scans. Bij tau-negatieve scans is er een minimaal, aspecifiek radiotracer-signaal van lage intensiteit in de mediale temporale, basale voorhersenen en basale ganglia. In tau-positieve scans (D) is het radiotracer signaal van hogere intensiteit en betreft het de inferieure en laterale temporale cortex volgens het bekende traject van progressie van neurofibrillaire tangles.
Amyloïd Positron Emissie Tomografie
Amyloïd, en meer recent, tau beeldvorming hebben een revolutie teweeggebracht in ons vermogen om AD pathologie te visualiseren, zelfs in presymp-tomatische stadia.19 Amyloïd PET beeldvormingstracers zijn valide en betrouwbaar voor het in vivo opsporen van AD pathologie in verschillende stadia van de ziekte. Deze beeldvormingstracers binden specifieke conformatiemotieven van het amyloïd eiwit en resulteren in een traceropname die nauw gecorreleerd is met de postmortale amyloïdafzetting.20
Vergeleken met tau begint de amyloïdpathologie in een meer diffuus verdeeld regionaal patroon dat zich verspreidt van de basale delen van de frontale, temporale en occipitale kwabben tot de dorsale neocorticale associatiegebieden met pas in een laat stadium betrokkenheid van de primaire sensorische en motorische cortices.21 De meest opvallende gebieden van traceropname zijn de frontale, pariëtale en laterale temporale cortex (figuur 3), waarbij de opname 1,5 tot 2 keer hoger is bij mensen met AD in vergelijking met controlegroepen22 of mensen met andere vormen van dementie.23
Amyloïd PET-beelden worden beoordeeld op corticale traceropname in karakteristieke gebieden van AD amyloïdverdeling. Positieve scans tonen verlies van onderscheid tussen grijze en witte stof naarmate de traceropname zich uitbreidt tot in de neocortex. Negatieve scans behouden het onderscheid tussen grijze en witte stof en tonen alleen binding in de witte stof buiten de doelwitten.24 Beeldvormingspatronen voor Amyloïd PET kunnen cognitieve achteruitgang op betrouwbare wijze voorspellen, zowel bij gezonde mensen als bij mensen met MCI.20
18F-florbetapir, 18F-florbetaben, en 18F-flutemetamol zijn door de Food and Drug Administration (FDA) goedgekeurd voor klinisch gebruik.20 Verzekeringsmaatschappijen hebben de technologie echter niet omarmd, vanwege de kosten en het risico van klinisch overgebruik bij afwezigheid van disease-modifying therapieën en bewezen kostenvoordelen. Een meta-analyse meldde een sensitiviteit van 95% en een specificiteit van 57% van een positieve amyloïd PET-scan voor het voorspellen van conversie van MCI naar AD.25
De onzekere relatie tussen kosten, risico’s en baten heeft geleid tot de ontwikkeling van criteria voor gepast gebruik van amyloïdbeeldvorming, die de noodzaak van amyloïd PET-evaluatie toeschrijven aan personen met onverklaard MCI, atypische AD-presentaties en beginnende dementie.26 Deskundigen hebben ook ongepaste indicaties voor amyloïdbeeldvorming geïdentificeerd, waaronder een op zichzelf staande evaluatie van cognitieve problemen voorafgaand aan een grondige klinische, cognitieve, laboratorium- en structurele neurobeeldvormingsworkup; bij afwezigheid van objectieve cognitieve stoornissen; bij een hoge waarschijnlijkheid van AD (d.w.z. bij afwezigheid van een klinische equipoise; en voor staging van de ernst van de dementie.
De IDEAS-studie (imaging dementia-evidence for amyloid scanning), een lopende studie van het Center for Medicare and Medicaid Services, valideert momenteel de criteria voor gepast gebruik en evalueert de invloed van PET-bepaalde amyloïdstatus op het ziektebeheer en de langetermijnuitkomsten voor Medicare-begunstigden met MCI of atypische presentaties. Tussentijdse analyse toonde aan dat het integreren van amyloïd PET in de klinische workup resulteerde in veranderingen in het ziektebeleid bij 60,2% van de mensen met MCI en 63,5% van de mensen met dementie.27 Langetermijnresultaten worden nog bepaald.
Tau Positron Emissie Tomografie
Tau is het tweede eiwit dat wordt afgezet in de hersenen van mensen met AD. Tau PET imaging tracers worden momenteel ontwikkeld en zijn reeds veelbelovend. Net als amyloïd PET richten tau PET tracers zich op bepaalde conformatiemotieven van gefosforyleerd tau. De specificiteit van tau tracers is postmortaal gevalideerd,28 en het waargenomen tau PET signaal komt sterk overeen met de anatomische verdeling van neurofibrillaire klitten die momenteel gebruikt wordt voor een neuropathologische diagnose van AD.29 De vroegste stadia van tau pathologie die gevisualiseerd kunnen worden met tau PET beeldvorming zijn de neurofibrillaire klitafzettingen in de entorhinale cortex en de hippocampus. Vervolgens worden tau-afzettingen detecteerbaar in de inferieure en laterale temporale (Figuur 3), gevolgd door de pariëtale en occipitale, en ten slotte de frontale cortex volgens de gevestigde Braak en Braak pathologische staging van tau-afzetting door de hersenen.21 Tau-tracers zijn niet zonder diagnostische beperkingen en worden verder ontwikkeld om hun klinische rol beter te definiëren. Aangezien de binding van tau-tracers echter dynamisch verandert gedurende het gehele klinische beloop van AD, zal deze beeldvormingsmodaliteit waarschijnlijk een belangrijke rol spelen bij het in vivo in kaart brengen van de ernst van de ziekte.30
Toekomstige aanwijzingen
Gezien het feit dat AD-pathologie gemakkelijk kan worden gedetecteerd tot 20 jaar voor de diagnose van dementie19 en een voorspelbare stapsgewijze verdeling volgt, is het onderzoek nu gericht op vroege presymptomatische detectie en verbetering van de diagnostische nauwkeurigheid door het gebruik van biomarkers (tabel).31 Een voorgesteld kader voor amyloïd-tau-neurodegeneratie (ATN) onderzoek, gericht op het detecteren van 3 biomarkerveranderingen in de hersenen, voorspelt de klinische relevantie van multimodale beeldvorming.31 Het ATN classificatiesysteem is agnostisch ten opzichte van klinische syndromen en vangt het volledige spectrum van neurodegeneratieve ziekten door een AD biomarker lens. Na verdere ontwikkeling en verfijning wordt verwacht dat de ATN, door objectieve in vivo biomarker categorisatie, de klinische diagnostische nauwkeurigheid drastisch zal verbeteren en de kwaliteit van de zorg zal verbeteren.
Conclusie
Neuro-imaging biedt unieke informatie over de onderliggende etiologie van cognitieve stoornissen en vergemakkelijkt de begeleiding van patiënten en families door een angstige en onzekere ervaring. Alle neurodegeneratieve ziekten vertonen een aanzienlijke klinische heterogeniteit, en vóór de meest recente vooruitgang op het gebied van moleculaire beeldvorming kon geen van deze ziekten definitief worden gediagnosticeerd vóór het overlijden. De moderne beeldvormingstechnologie voor de hersenen is in staat om veelvoudige epifenomenen te detecteren die de onderliggende neuropathologie weerspiegelen, waarvan sommige zich vrij dicht bij de bron van de ziekte bevinden. De meest betrouwbare klinische diagnose is momenteel gebaseerd op een integratie van klinische voorgeschiedenis, waarnemingen van de arts, lichamelijk onderzoek, medische workup, neuropsychologische testen en geïnformeerde interpretatie van diagnostische neuroimaging. Naarmate de ATN biomarkers verder worden verfijnd, zullen klinische diagnoses eerder en definitiever worden gesteld bij levende patiënten, minder afhankelijk zijn van symptoomclassificatie, en mogelijkheden bieden voor eerdere behandelingsinterventie die het traject van neurodegeneratieve ziekte kan veranderen.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Rapport van de Subcommissie Kwaliteitsnormen van de American Academy of Neurologie. Neurologie. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Mediale temporale kwabatrofie op MRI differentieert de ziekte van Alzheimer van dementie met Lewy-lichaampjes en vasculaire cognitieve stoornissen: een prospectieve studie met pathologische verificatie van de diagnose. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion tensor imaging of normal-appearing white matter in mild cognitive impairment and early Alzheimer disease: preliminary evidence of axonal degeneration in the temporal lobe. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET verbetert de nauwkeurigheid bij het onderscheiden van frontotemporale dementie en de ziekte van Alzheimer. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebral glucose metabolism in patients with frontotemporal dementia. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardized 18F-FDG PET diagnosis of mild cognitive impairment, Alzheimer’s disease, and other dementias. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Accessed May 4, 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegeneratieve ziekten richten zich op grootschalige menselijke hersennetwerken. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. De diagnostische waarde van FDG en amyloïd PET bij de ziekte van Alzheimer-een systematische review. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropathologische stadiëring van Alzheimer-gerelateerde veranderingen. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Voorspellende nauwkeurigheid van amyloïdbeeldvorming voor progressie van milde cognitieve stoornis naar de ziekte van Alzheimer met verschillende duur van follow-up: een meta-analyse. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiography validation of novel tau PET tracer -MK-6240 on human postmortem brain tissue. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Vroege klinische PET-beeldvormingsresultaten met het nieuwe PHF-tau radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluatie van tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Naar een biologische definitie van de ziekte van Alzheimer. Alzheimers Dement. 2018;14(4):535-562.
MRA en DS melden geen disclosures.
LGA heeft gediend als lid van een adviesraad voor Eli Lilly.