Het Aufbau-Principe
Om de elektronenconfiguratie voor een bepaald atoom te bepalen, kunnen we de structuren “bouwen” in de volgorde van de atoomnummers. Beginnend met waterstof, en verder door de perioden van het periodiek systeem, voegen we een proton per keer toe aan de kern en een elektron aan de juiste subschil, totdat we de elektronenconfiguraties van alle elementen hebben beschreven. Deze procedure wordt het Aufbau-principe genoemd, van het Duitse woord Aufbau (“opbouwen”). Elk toegevoegd elektron bezet de subschil met de laagst beschikbare energie (in de volgorde van figuur), binnen de beperkingen die worden opgelegd door de toegestane kwantumgetallen volgens het Pauli uitsluitingsprincipe. Elektronen komen pas in de hogere energiesubschalen nadat de lagere energiesubschalen volledig zijn gevuld. Figuur 3 illustreert de traditionele manier om de volgorde van vulling van atomaire banen te onthouden.
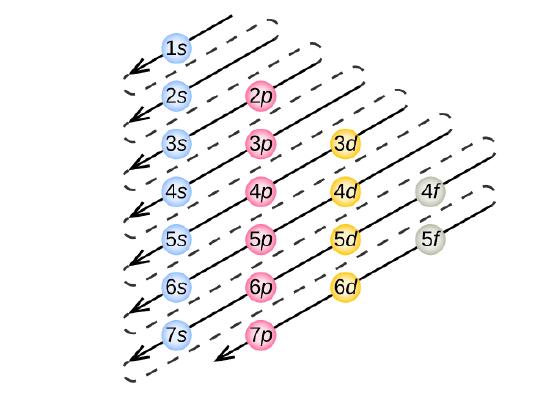
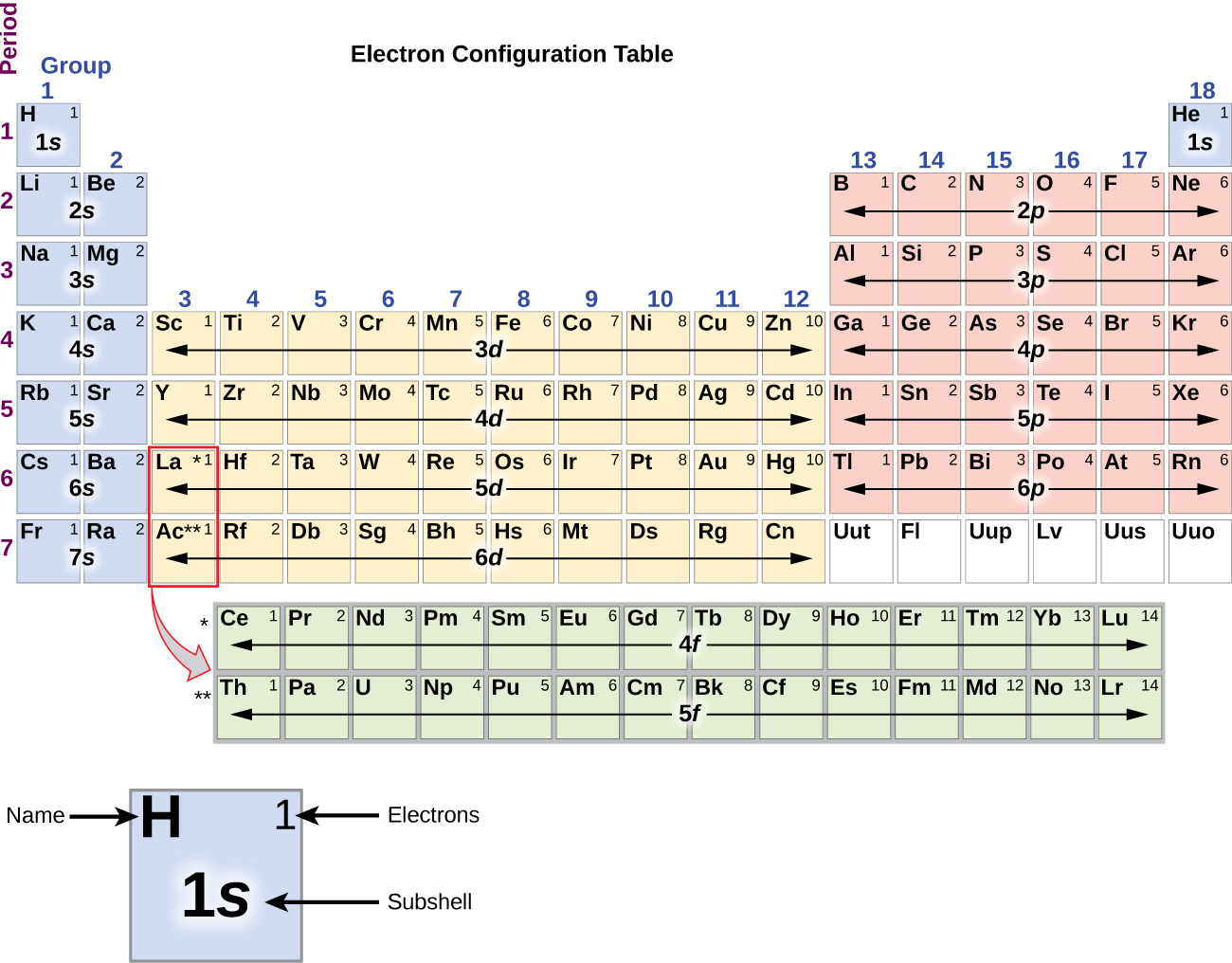
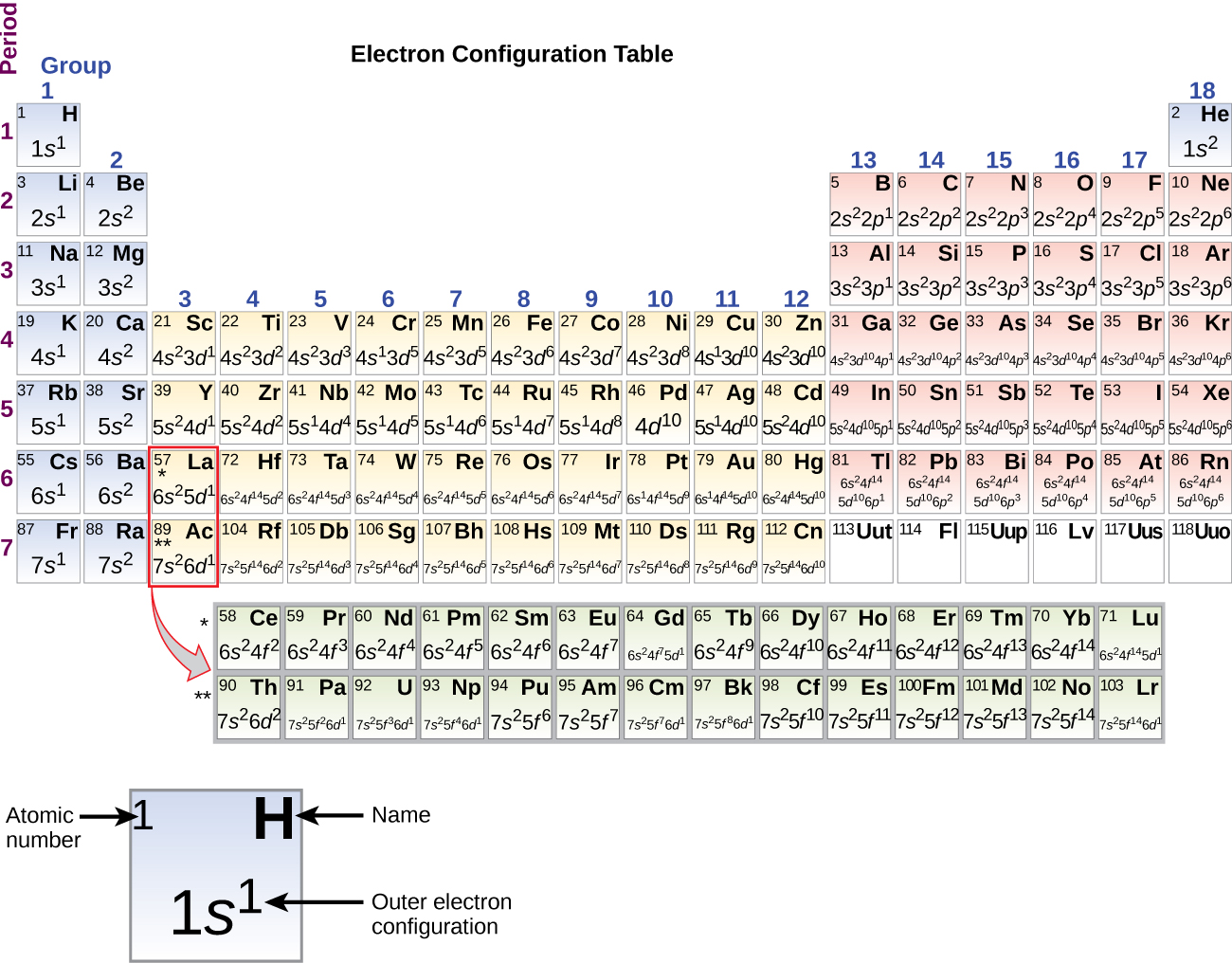
Omdat de ordening van het periodiek systeem is gebaseerd op de elektronenconfiguraties, biedt figuur PageIndex{4} een alternatieve methode om de elektronenconfiguratie te bepalen. De vulvolgorde begint eenvoudig bij waterstof en omvat elke subschil naarmate je verder gaat in toenemende Z-volgorde. Bijvoorbeeld, na het vullen van het 3p blok tot Ar, zien we dat de orbitaal 4s zal zijn (K, Ca), gevolgd door de 3d orbitalen.
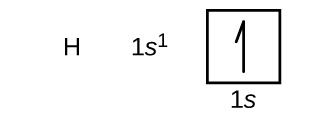
We zullen nu de elektronenconfiguratie en het orbitaaldiagram van de grondtoestand construeren voor een selectie van atomen in de eerste en tweede periode van het periodiek systeem. Banendiagrammen zijn afbeeldingen van de elektronenconfiguratie, die de individuele banen en de paarsgewijze rangschikking van elektronen laten zien. We beginnen met een enkel waterstofatoom (atoomnummer 1), dat bestaat uit één proton en één elektron. Als we naar de figuur (m) of de figuur (m) kijken, zouden we verwachten dat het elektron zich in de 1s-baan bevindt. Bij conventie wordt de waarde m_s=++draad{1}{2}} meestal als eerste ingevuld. De elektronenconfiguratie en het banendiagram zijn:
Na waterstof komt het edelgas helium, dat een atoomnummer heeft van 2. Het heliumatoom bevat twee protonen en twee elektronen. Het eerste elektron heeft dezelfde vier kwantumgetallen als het elektron van het waterstofatoom (n = 1, l = 0, ml = 0, m_s=+dfrac{1}{2})). Het tweede elektron gaat ook in de 1s orbitaal en vult die orbitaal. Het tweede elektron heeft dezelfde n, l, en ml kwantumgetallen, maar moet het tegengestelde spin kwantumgetal hebben, \(m_s=-\dfrac{1}{2}\). Dit is in overeenstemming met het Pauli-uitsluitingsprincipe: geen twee elektronen in hetzelfde atoom kunnen dezelfde set van vier kwantumgetallen hebben. Voor de orbitaaldiagrammen betekent dit dat er twee pijlen in elk vakje moeten (die twee elektronen in elke orbitaal voorstellen) en dat de pijlen in tegengestelde richtingen moeten wijzen (die gepaarde spins voorstellen). De elektronenconfiguratie en het banendiagram van helium zijn:
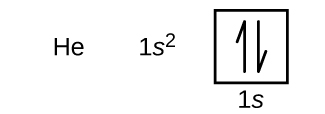
De n = 1 schil is volledig gevuld in een heliumatoom.
Het volgende atoom is het alkalimetaal lithium met een atoomnummer van 3. De eerste twee elektronen in lithium vullen de 1s-baan en hebben dezelfde sets van vier kwantumgetallen als de twee elektronen in helium. Het overblijvende elektron moet de baan met de op één na laagste energie, de 2s-baan, bezetten (figuur blz. 3 of blz. 4). De elektronenconfiguratie en het banendiagram van lithium zijn dus:
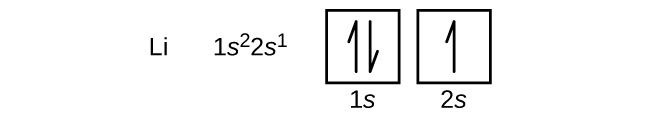
Een atoom van het aardalkalimetaal beryllium, met een atoomnummer van 4, bevat vier protonen in de kern en vier elektronen rond de kern. Het vierde elektron vult de resterende ruimte in de 2s-baan.
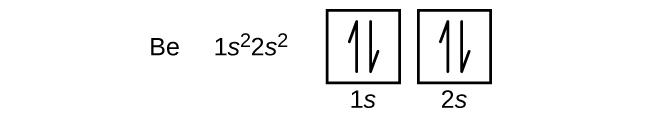
Een atoom van boor (atoomnummer 5) bevat vijf elektronen. De n = 1 schil is gevuld met twee elektronen en drie elektronen zullen de n = 2 schil bezetten. Omdat een s-subschil slechts twee elektronen kan bevatten, moet het vijfde elektron het volgende energieniveau bezetten, dat een 2p-schil zal zijn. Er zijn drie degenerate 2p-banen (ml = -1, 0, +1) en het elektron kan elk van deze p-banen bezetten. Bij het tekenen van orbitaaldiagrammen nemen we lege vakjes op om lege orbitalen in dezelfde subschil weer te geven die we vullen.
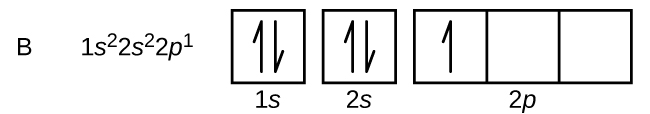
Koolstof (atoomnummer 6) heeft zes elektronen. Vier van hen bezetten de banen van 1s en 2s. De overige twee elektronen bezetten de 2p-subschil. We kunnen nu kiezen of we één van de 2p-banen vullen en de elektronen paren, of dat we de elektronen ongepaard laten in twee verschillende, maar ontaarde, p-banen. De orbitalen worden gevuld volgens de regel van Hund: de configuratie met de laagste energie voor een atoom met elektronen binnen een reeks van ontaarde orbitalen is die met het maximum aantal ongepaarde elektronen. De twee elektronen in de 2p-banen van koolstof hebben dus identieke n-, l- en ms-kwantumgetallen en verschillen in hun ml-kwantumgetal (in overeenstemming met het Pauli-uitsluitingsprincipe). De elektronenconfiguratie en het banendiagram voor koolstof zijn:
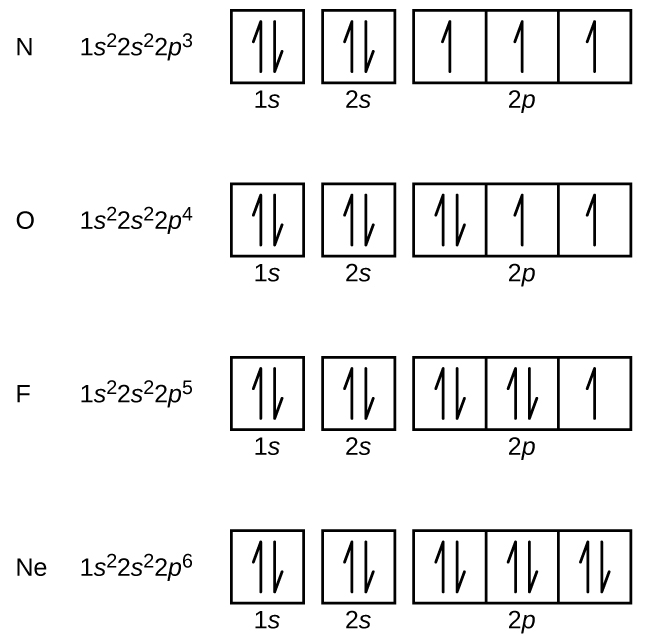
Stikstof (atoomnummer 7) vult de 1s- en 2s-subschillen en heeft één elektron in elk van de drie 2p-banen, in overeenstemming met de regel van Hund. Deze drie elektronen hebben ongepaarde spins. Zuurstof (atoomnummer 8) heeft een elektronenpaar in elk van de 2p-banen (de elektronen hebben tegengestelde spins) en een enkel elektron in elk van de andere twee. Fluor (atoomnummer 9) heeft slechts één 2p-baan die een ongepaard elektron bevat. Alle elektronen in het edelgas neon (atoomnummer 10) zijn gepaard, en alle orbitalen in de n = 1- en de n = 2-schil zijn gevuld. De elektronenconfiguraties en banaaldiagrammen van deze vier elementen zijn:
Het alkalimetaal natrium (atoomnummer 11) heeft één elektron meer dan het neonatoom. Dit elektron moet in de onderste beschikbare energiesubschil gaan, de 3s-baan, wat een 1s22s22p63s1-configuratie oplevert. De elektronen die de buitenste schilschil(len) bezetten (hoogste waarde van n) worden valentie-elektronen genoemd, en de elektronen die de binnenste schilschil(len) bezetten worden kernelektronen genoemd ( figuur blz. 5 blz. 5). Aangezien de kernelektronenschillen overeenkomen met edelgaselektronenconfiguraties, kunnen we elektronenconfiguraties afkorten door het edelgas te schrijven dat overeenkomt met de kernelektronenconfiguratie, samen met de valentie-elektronen in een verkorte vorm. In ons voorbeeld van natrium staat het symbool voor de kernelektronen (1s22s22p6) en onze afgekorte of verkorte configuratie is 3s1.

Op vergelijkbare wijze kan de verkorte configuratie van lithium worden weergegeven als 2s1, waarbij de configuratie van het heliumatoom wordt weergegeven, die identiek is aan die van de gevulde binnenste schil van lithium. Door de configuraties op deze manier te schrijven wordt de overeenkomst tussen de configuraties van lithium en natrium benadrukt. Beide atomen, die tot de familie van de alkalimetalen behoren, hebben slechts één elektron in een valentie-subschil buiten een gevulde set binnenste schillen.
Het alkalische aardmetaal magnesium (atoomnummer 12), met zijn 12 elektronen in een 3s2-configuratie, is analoog aan zijn familielid beryllium, 2s2. Beide atomen hebben een gevulde s-subschil buiten hun gevulde binnenste schillen. Aluminium (atoomnummer 13), met 13 elektronen en de elektronenconfiguratie 3s23p1, is analoog aan zijn familielid borium, 2s22p1.
De elektronenconfiguraties van silicium (14 elektronen), fosfor (15 elektronen), zwavel (16 elektronen), chloor (17 elektronen) en argon (18 elektronen) zijn in de elektronenconfiguraties van hun buitenste schillen analoog aan die van hun overeenkomstige familieleden koolstof, stikstof, zuurstof, fluor en neon, respectievelijk, behalve dat het hoofdkwantumgetal van de buitenste schil van de zwaardere elementen met één is toegenomen tot n = 3. In figuur 6 is de elektronenconfiguratie van de laagste energie, de grondtoestand, voor deze elementen weergegeven, evenals die voor atomen van elk van de bekende elementen.
Wanneer we bij het volgende element in het periodiek systeem komen, het alkalimetaal kalium (atoomnummer 19), zouden we verwachten dat we elektronen aan de 3d-deelschaal zouden beginnen toe te voegen. Alle beschikbare chemische en fysische gegevens wijzen er echter op dat kalium net als lithium en natrium is, en dat het volgende elektron niet aan het 3d niveau wordt toegevoegd, maar in plaats daarvan aan het 4s niveau (figuur figuur). Zoals eerder besproken, is de 3d orbitaal zonder radiale knopen hoger in energie omdat hij minder doordringt en meer afgeschermd is van de kern dan de 4s, die drie radiale knopen heeft. Kalium heeft dus een elektronenconfiguratie van 4s1. Kalium komt dus overeen met Li en Na in zijn valentie-schilconfiguratie. Het volgende elektron wordt toegevoegd om de 4s subschil te completeren en calcium heeft een elektronenconfiguratie van 4s2. Hierdoor heeft calcium een elektronenconfiguratie van de buitenste schil die overeenkomt met die van beryllium en magnesium.
Beginnend met het overgangsmetaal scandium (atoomnummer 21), worden achtereenvolgens extra elektronen toegevoegd aan de 3d subschil. Deze subschil is tot zijn volledige capaciteit gevuld met 10 elektronen (onthoud dat voor l = 2 , er 2l + 1 = 5 waarden van ml zijn, hetgeen betekent dat er vijf d-banen zijn die samen een capaciteit van 10 elektronen hebben). De 4p subschil vult zich daarna. Merk op dat voor drie series elementen, scandium (Sc) tot en met koper (Cu), yttrium (Y) tot en met zilver (Ag), en lutetium (Lu) tot en met goud (Au), achtereenvolgens in totaal 10 d-elektronen worden toegevoegd aan de (n – 1) schil naast de n-schil om die (n – 1) schil van 8 op 18 elektronen te brengen. Voor twee series, lanthaan (La) t/m lutetium (Lu) en actinium (Ac) t/m lawrencium (Lr), worden achtereenvolgens 14 f-elektronen (l = 3, 2l + 1 = 7 ml-waarden; dus zeven banen met een gezamenlijke capaciteit van 14 elektronen) toegevoegd aan de (n – 2) schil om die schil van 18 elektronen op een totaal van 32 elektronen te brengen.
Voorbeeld: Kwantumgetallen en elektronenconfiguraties
Wat is de elektronenconfiguratie en het orbitaaldiagram voor een fosforatoom? Wat zijn de vier quantumgetallen voor het laatste toegevoegde elektron?
Oplossing
Het atoomnummer van fosfor is 15. Een fosforatoom bevat dus 15 elektronen. De volgorde van vulling van de energieniveaus is 1s, 2s, 2p, 3s, 3p, 4s, . . . De 15 elektronen van het fosforatoom zullen zich vullen tot de 3p-baan, die drie elektronen zal bevatten:
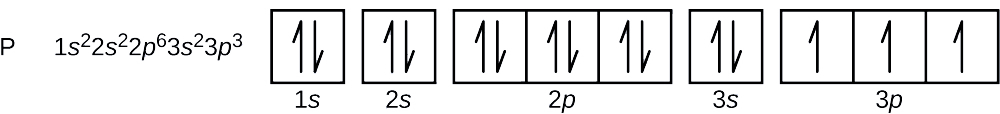
Het laatste toegevoegde elektron is een 3p-elektron. Daarom is n = 3 en, voor een p-type orbitaal, l = 1. De ml-waarde kan -1, 0, of +1 zijn. De drie p-banen zijn degeneraat, dus elk van deze ml-waarden is correct. Voor ongepaarde elektronen geeft de conventie de waarde +(m_s=++dfrac{1}{2}) voor het spin-kwantumgetal; dus +(m_s=+dfrac{1}{2}).
Oefening
Identificeer de atomen aan de hand van de gegeven elektronenconfiguraties:
- 4s23d5
- 5s24d105p6
Antwoord a
Mn
Antwoord b
Xe
Het periodiek systeem kan een krachtig hulpmiddel zijn bij het voorspellen van de elektronenconfiguratie van een element. Er zijn echter uitzonderingen op de volgorde van vulling van de orbitalen die in figuur (Pagina-index {3}) of figuur (Pagina-index {4}) zijn weergegeven. Zo zijn bijvoorbeeld de elektronenconfiguraties van de overgangsmetalen chroom (Cr; atoomnummer 24) en koper (Cu; atoomnummer 29) niet die welke we zouden verwachten. In het algemeen gaat het bij dergelijke uitzonderingen om subschillen met zeer vergelijkbare energie, en kleine effecten kunnen leiden tot veranderingen in de volgorde van vulling.
In het geval van Cr en Cu vinden we dat halfgevulde en volledig gevulde subschillen blijkbaar condities van preferente stabiliteit vertegenwoordigen. Deze stabiliteit is zodanig dat een elektron van de 4s naar de 3d-schil verschuift om de extra stabiliteit van een halfgevulde 3d-schil (in Cr) of een gevulde 3d-schil (in Cu) te verkrijgen. Andere uitzonderingen komen ook voor. Van niobium (Nb, atoomnummer 41) bijvoorbeeld wordt voorspeld dat het de elektronenconfiguratie 5s24d3 heeft. Experimenteel stellen we vast dat de elektronenconfiguratie in de grondtoestand eigenlijk 5s14d4 is. We kunnen deze waarneming rationaliseren door te zeggen dat de elektron-elektron afstotingen die worden ondervonden bij het paren van de elektronen in de 5s orbitaal groter zijn dan het energieverschil tussen de 5s en 4d orbitalen. Er is geen eenvoudige methode om de uitzonderingen te voorspellen voor atomen waar de grootte van de afstotingen tussen elektronen groter is dan de kleine verschillen in energie tussen de subschalen.