Leerdoelen
- Uitbreiden van eerder geïntroduceerde evenwichtsconcepten naar zuren en basen die meer dan één proton kunnen afstaan of accepteren
We kunnen ook de relatieve sterktes van geconjugeerde zuur-base paren gebruiken om de zuur-base eigenschappen van oplossingen van zouten te begrijpen. Een neutralisatiereactie kan worden gedefinieerd als de reactie van een zuur en een base om een zout en water te produceren. Dat wil zeggen dat een ander kation, zoals Na^+, het proton van het zuur vervangt. Een voorbeeld is de reactie van een zwak zuur met een sterk basisch kation (NaOH):
Afhankelijk van de zuur-base-eigenschappen van de samenstellende ionen kan een zout echter in water oplossen tot een neutrale oplossing, een basische oplossing of een zure oplossing.
Wanneer een zout als NaCl in water oplost, ontstaan er Na^+ en Cl^- ionen. Met behulp van een Lewis-benadering kan het ion Na^+ worden beschouwd als een zuur omdat het een elektronenpaar-acceptor is, hoewel het door zijn lage lading en relatief grote radius een zeer zwak zuur is. Het Cl-ion is de geconjugeerde base van het sterke zuur HCl, dus het heeft in wezen geen basisch karakter. Bijgevolg heeft het oplossen van NaCl in water geen effect op de pH van een oplossing en blijft de oplossing neutraal. Laten we dit gedrag nu eens vergelijken met het gedrag van waterige oplossingen van kaliumcyanide en natriumacetaat. Ook hier hebben de kationen (K^+ en Na^+) in wezen geen zuur karakter, maar de anionen (CN^ en CH3CO2) zijn zwakke basen die met water kunnen reageren omdat zij de geconjugeerde basen zijn van respectievelijk de zwakke zuren HCN en azijnzuur.
Geen van beide reacties verloopt erg ver naar rechts zoals geschreven, omdat de vorming van het zwakkere zuur-base paar wordt begunstigd. Zowel (HCN) als azijnzuur zijn sterkere zuren dan water, en hydroxide is een sterkere base dan acetaat of cyanide, dus in beide gevallen ligt het evenwicht naar links. Niettemin genereert elk van deze reacties voldoende hydroxide-ionen om een basische oplossing te produceren. Zo is bijvoorbeeld de pH van een 0,1 M oplossing van natriumacetaat of kaliumcyanide bij 25°C respectievelijk 8,8 of 11,1. Uit de tabellen E1 en E2 blijkt dat CN^- een sterkere base is (pK_b = 4,79) dan acetaat (pK_b = 9,24), wat in overeenstemming is met het feit dat KCN bij dezelfde concentratie een meer basische oplossing oplevert dan natriumacetaat.
Het geconjugeerde zuur van een zwakke base moet daarentegen een zwak zuur zijn. Zo zijn ammoniumchloride en pyridiniumchloride zouten die ontstaan door de reactie van respectievelijk ammoniak en pyridine met (HCl). Zoals je al weet, is het chloride-ion zo’n zwakke base dat het niet reageert met water. De kationen van de twee zouten zijn daarentegen zwakke zuren die als volgt met water reageren:
Figuur (Pagina-index{2}) laat zien dat H3O^+ een sterker zuur is dan NH4^+ of C5H5NH^+, en omgekeerd zijn ammoniak en pyridine beide sterkere basen dan water. Het evenwicht zal daarom in beide gevallen ver naar links liggen, ten gunste van het zwakkere zuur-base paar. De door de reacties geproduceerde concentratie H3O^+ is echter groot genoeg om de pH van de oplossing aanzienlijk te verlagen: de pH van een 0,10 M oplossing van ammoniumchloride of pyridiniumchloride bij 25°C is respectievelijk 5,13 of 3,12.
Wat gebeurt er met waterige oplossingen van een zout als ammoniumacetaat, waarbij zowel het kation als het anion afzonderlijk met water kunnen reageren tot respectievelijk een zuur en een base? Volgens figuur 16.10 zal het ammoniumion de pH verlagen, terwijl volgens figuur 16.9 het acetaation de pH zal verhogen. Dit specifieke geval is ongebruikelijk, omdat het kation een even sterk zuur is als het anion een base is (pKa ≈ pKb). Bijgevolg heffen de twee effecten op en blijft de oplossing neutraal. Bij zouten waarin het kation een sterker zuur is dan het anion een base is, heeft de uiteindelijke oplossing een pH < 7,00. Omgekeerd, als het kation een zwakker zuur is dan het anion een base is, heeft de uiteindelijke oplossing een (pH) > 7,00.
Zure metaalionen
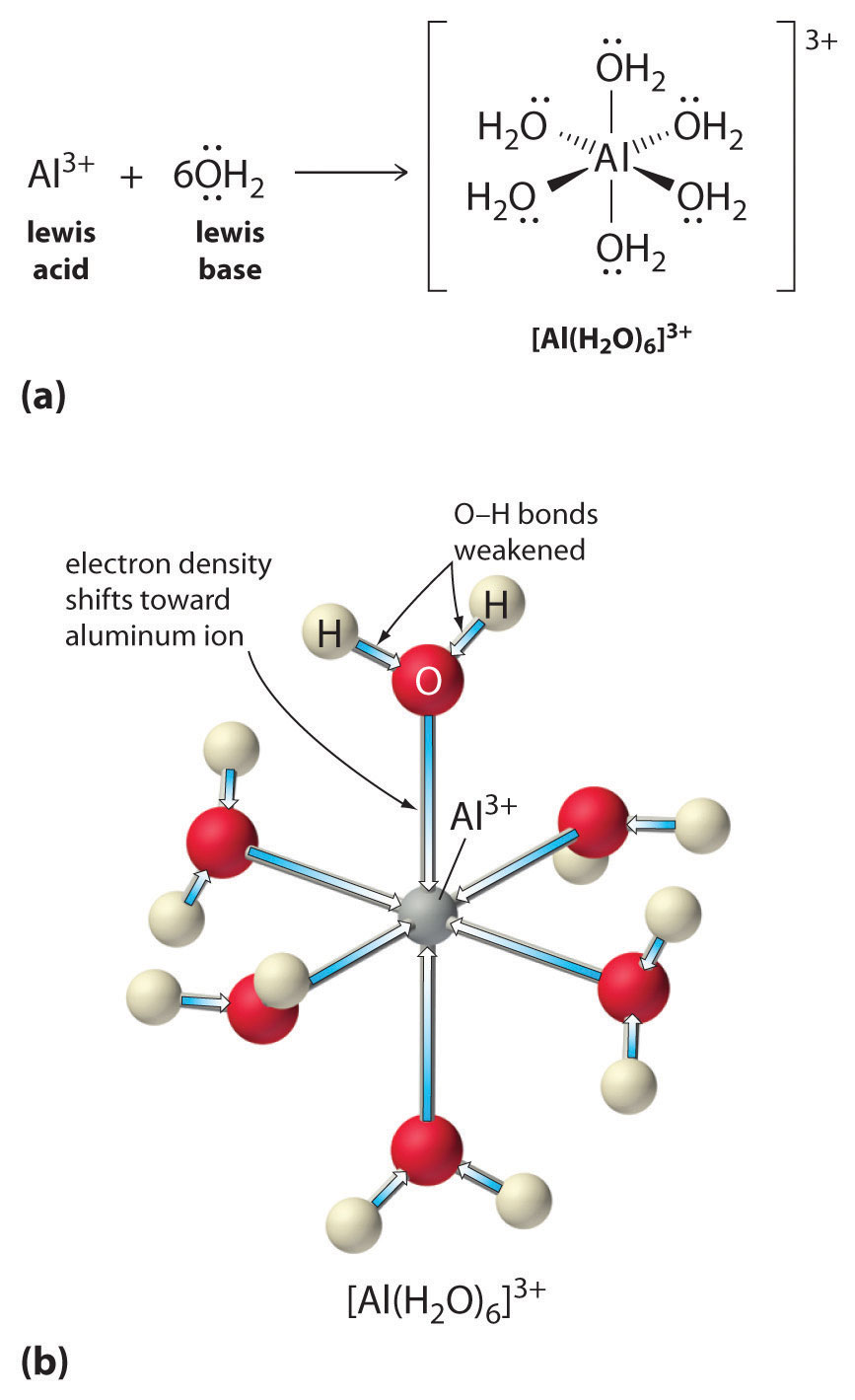
Oplossingen van eenvoudige zouten van metaalionen kunnen ook zuur zijn, hoewel een metaalion niet rechtstreeks een proton aan water kan afstaan om (H_3O^+) te produceren. In plaats daarvan kan een metaalion fungeren als een Lewiszuur en een wisselwerking aangaan met water, een Lewisbasisch, door een coördinatie met een alleenstaand elektronenpaar op het zuurstofatoom om een gehydrateerd metaalion te vormen (figuur). Een watermolecuul gecoördineerd met een metaalion is zuurder dan een vrij watermolecuul om twee redenen. Ten eerste maken de afstotende elektrostatische interacties tussen het positief geladen metaalion en de gedeeltelijk positief geladen waterstofatomen van het gecoördineerde watermolecuul het gemakkelijker voor het gecoördineerde water om een proton te verliezen.
Ten tweede trekt de positieve lading van het \(Al^{3+})-ion elektronendichtheid aan van de zuurstofatomen van de watermoleculen, waardoor de elektronendichtheid in de \(\ce{O-H})-bindingen afneemt, zoals te zien is in figuur \(\PageIndex{1b}). Met minder elektronendichtheid tussen de O-atomen en de H-atomen zijn de H-molecuulbindingen zwakker dan in een vrij H-molecuul, waardoor het gemakkelijker is om een H-ion te verliezen.
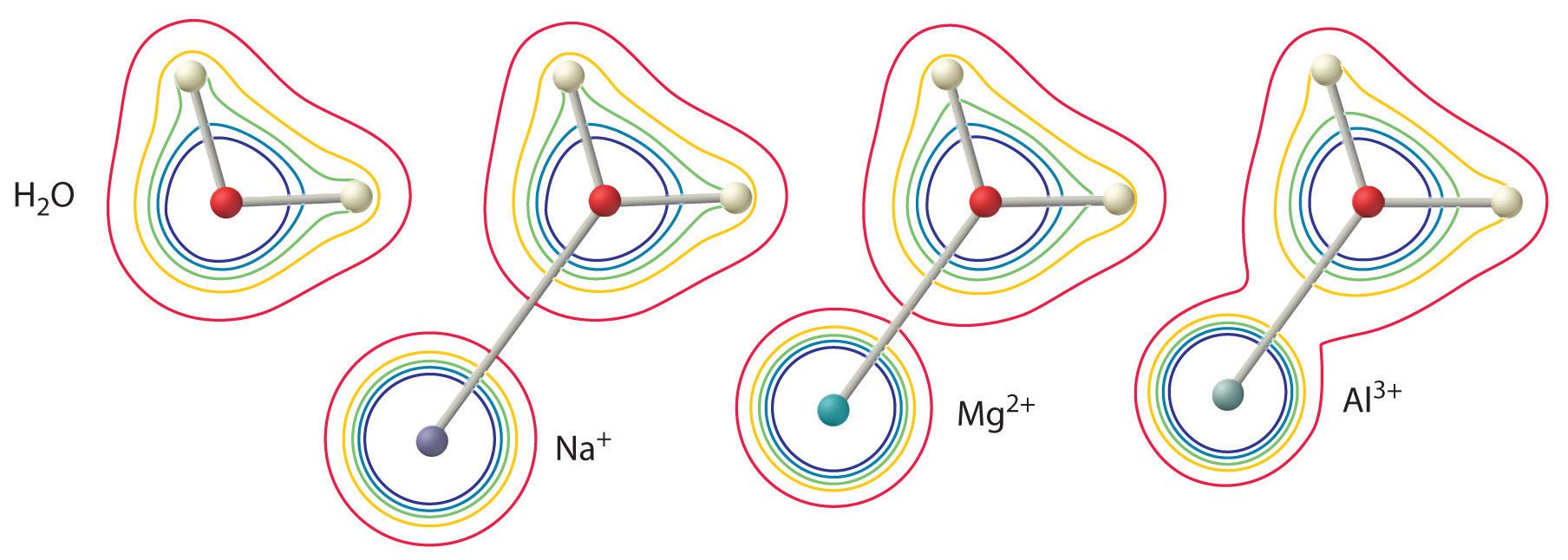
De grootte van dit effect hangt af van de volgende twee factoren (figuur \(\PageIndex{3}})):
- De lading van het metaalion. Een tweewaardig ion (M^{2+})) heeft ongeveer twee keer zo’n sterk effect op de elektronendichtheid in een gecoördineerd watermolecuul als een monovalent ion (M^+) met dezelfde straal.
- De straal van het metaalion. Voor metaalionen met dezelfde lading geldt: hoe kleiner het ion, hoe korter de interne-ucleaire afstand tot het zuurstofatoom van het watermolecuul en hoe groter het effect van het metaal op de verdeling van de elektronendichtheid in het watermolecuul.
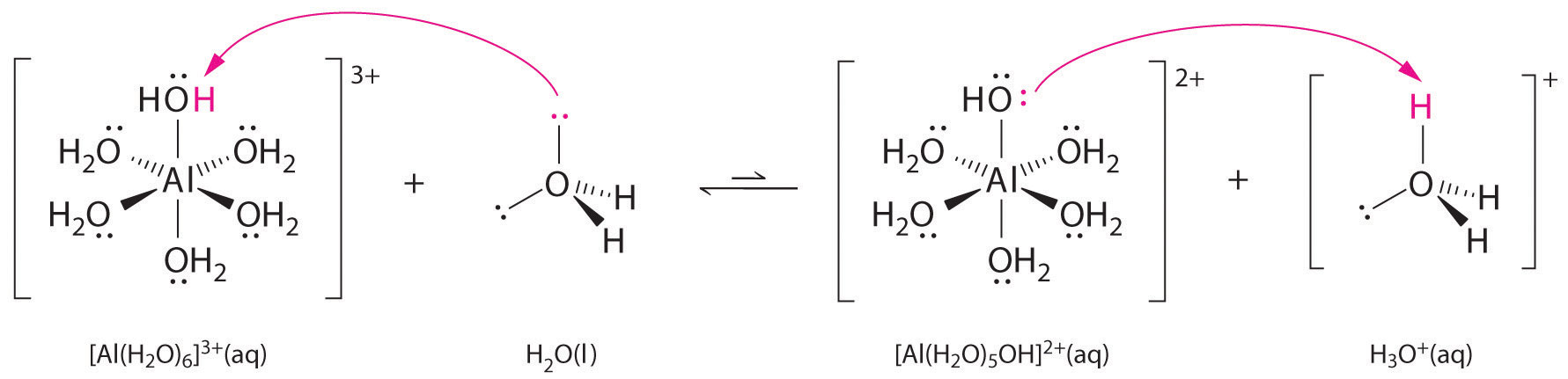
Zo zijn waterige oplossingen van kleine, sterk geladen metaalionen, zoals ^(Al^{3+}) en ^(Fe^{3+}), zuur:
^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)}
Het ion heeft een pK(pK_a) van 5,0 en is daarmee bijna even sterk als azijnzuur. Vanwege de twee eerder beschreven factoren is de belangrijkste parameter voor het voorspellen van het effect van een metaalion op de zuurgraad van gecoördineerde watermoleculen de verhouding lading/radius van het metaalion. Een aantal paren van metaalionen die op een diagonale lijn in het periodiek systeem liggen, zoals Li en Mg, of Ca en Y, hebben verschillende groottes en ladingen, maar vergelijkbare lading/radius verhoudingen. Dientengevolge, hebben deze paren van metaalionen gelijkaardige effecten op de zuurheid van gecoördineerde watermolecules, en zij vertonen vaak andere significante gelijkenissen in chemie ook.
Acidische Metaalionen
Oplossingen van kleine, hoogst geladen metaalionen in water zijn zuur.
Reacties zoals die besproken in deze sectie, waarin een zout met water reageert om een zure of basische oplossing te geven, worden vaak hydrolysereacties genoemd. Het gebruik van een aparte naam voor dit soort reacties is ongelukkig, omdat het suggereert dat ze op de een of andere manier verschillend zijn. In feite zijn hydrolysereacties gewoon zuur-basereacties waarbij het zuur een kation is of de base een anion; zij gehoorzamen dezelfde principes en regels als alle andere zuur-basereacties.
Hydrolyse
Een hydrolysereactie is een zuur-base reactie.
Voorbeeld
Voorspel of waterige oplossingen van deze verbindingen zuur, basisch, of neutraal zijn.
- (KNO_3)
- (CrBr_3 \dot H_2O)
- (Na_2SO_4)
Gegeven: verbinding
Gevraagd wordt naar: zuurgraad of basischgraad van waterige oplossing
Strategie:
- Bepaal de zuur-base eigenschappen van het kation en het anion. Als het kation een zwak Lewiszuur is, zal het de pH-waarde van de oplossing niet beïnvloeden. Als het kation echter het conjugaatzuur van een zwakke base of een relatief sterk geladen metaalkation is, zal het met water reageren tot een zure oplossing.
- Als het anion de conjugaatbase van een sterk zuur is, zal het de pH-waarde van de oplossing niet beïnvloeden. Als het anion echter de geconjugeerde base van een zwak zuur is, zal de oplossing basisch zijn.
Oplossing:
a
- Het kation K^+ heeft een kleine positieve lading (+1) en een relatief grote straal (omdat het in de vierde rij van het periodiek systeem staat), dus het is een zeer zwak Lewiszuur.
- Het anion (NO_3-) is de geconjugeerde base van een sterk zuur, dus het heeft in wezen geen basisch karakter (tabel 16.1). Daarom zal noch het kation noch het anion met water reageren tot de vorming van een H+ of OH^- en zal de oplossing neutraal zijn.
b.
- Het Cr3+ ion is een relatief sterk geladen metaalkation dat zich op dezelfde manier zou moeten gedragen als het Al3+ ion en het 3+ complex zou moeten vormen, dat zich als een zwak zuur zal gedragen: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}]
- Het anion (Br^-) is een zeer zwakke base (het is de geconjugeerde base van het sterke zuur (HBr)), dus het heeft geen invloed op de pH van de oplossing. Daarom zal de oplossing zuur zijn.
c.
- Het ion Na^+ is, net als het ion K^+, een zeer zwak zuur, zodat het geen invloed heeft op de zuurgraad van de oplossing.
- In tegenstelling daarmee is het ion SO4 de geconjugeerde base van HSO4^-, dat een zwak zuur is. Daarom zal het ion SO4 met water reageren zoals in figuur 16.6, zodat een licht basische oplossing ontstaat.
Oefening
Versel of waterige oplossingen van de volgende stoffen zuur, basisch of neutraal zijn.
- (KI)
- (Mg(ClO_4)_2)
- (NaHS)
Antwoord a
neutraal
Antwoord b
zuur
Antwoord c
basisch (als gevolg van de reactie van HS^- met water tot H2S en OH^-)
Samenvatting
Een zout kan in water oplossen tot een neutrale, basische of zure oplossing, afhankelijk van de vraag of het de geconjugeerde base van een zwak zuur als anion (A^-), het geconjugeerde zuur van een zwakke base als kation (BH^+), of beide bevat. Zouten die kleine, sterk geladen metaalionen bevatten, produceren zure oplossingen in water. De reactie van een zout met water om een zure of basische oplossing te produceren wordt een hydrolysereactie genoemd.