![]()
El agua tiene importantes efectos en todos los sistemas biológicos. Lo que hace que el agua sea única son dos propiedades muy importantes.
El agua es una molécula polar
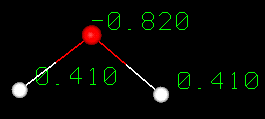 Una molécula de agua se forma cuando dos átomos de hidrógeno se unen covalentemente con un átomo de oxígeno. En un enlace covalente los electrones se comparten entre los átomos. En el agua el reparto no es igual. El átomo de oxígeno atrae los electrones con más fuerza que el de hidrógeno, lo que da al agua una distribución asimétrica de la carga. Las moléculas que tienen extremos con cargas parciales negativas y positivas se conocen como moléculas polares. Esta propiedad polar es la que permite al agua separar las moléculas polares de los solutos y explica por qué el agua puede disolver tantas sustancias.
Una molécula de agua se forma cuando dos átomos de hidrógeno se unen covalentemente con un átomo de oxígeno. En un enlace covalente los electrones se comparten entre los átomos. En el agua el reparto no es igual. El átomo de oxígeno atrae los electrones con más fuerza que el de hidrógeno, lo que da al agua una distribución asimétrica de la carga. Las moléculas que tienen extremos con cargas parciales negativas y positivas se conocen como moléculas polares. Esta propiedad polar es la que permite al agua separar las moléculas polares de los solutos y explica por qué el agua puede disolver tantas sustancias.
El agua es altamente cohesiva .
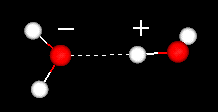 Las regiones positivas de un agua atraerán las regiones cargadas negativamente de otras aguas. Los guiones muestran el enlace de hidrógeno. En un enlace de hidrógeno un átomo de hidrógeno es compartido por otros dos átomos. El donante es el átomo al que el hidrógeno está más unido. El aceptor (que tiene una carga negativa parcial) es el átomo que atrae al átomo de hidrógeno. Haga clic aquí o en la imagen de la izquierda para ver una película de dos moléculas de agua.
Las regiones positivas de un agua atraerán las regiones cargadas negativamente de otras aguas. Los guiones muestran el enlace de hidrógeno. En un enlace de hidrógeno un átomo de hidrógeno es compartido por otros dos átomos. El donante es el átomo al que el hidrógeno está más unido. El aceptor (que tiene una carga negativa parcial) es el átomo que atrae al átomo de hidrógeno. Haga clic aquí o en la imagen de la izquierda para ver una película de dos moléculas de agua.
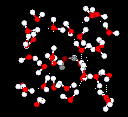 Los enlaces de hidrógeno son mucho más débiles que los enlaces covalentes. Sin embargo, cuando un gran número de enlaces de hidrógeno actúan al unísono, tendrán un fuerte efecto contributivo. Este es el caso del agua.
Los enlaces de hidrógeno son mucho más débiles que los enlaces covalentes. Sin embargo, cuando un gran número de enlaces de hidrógeno actúan al unísono, tendrán un fuerte efecto contributivo. Este es el caso del agua.
Ver: enlaces de hidrógeno en el agua y el hielo — Water and Ice hydrogen bonds using Jsmol
El agua líquida tiene una estructura parcialmente ordenada en la que los enlaces de hidrógeno se forman y rompen constantemente.
Vea una película flash de las moléculas de agua en acción.
Por otro lado, el hielo tiene una estructura reticular rígida.
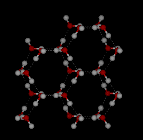
En el agua líquida cada molécula está unida por hidrógeno a aproximadamente 3,4 otras moléculas de agua. En el hielo cada molécula está unida por hidrógeno a otras 4 moléculas.
Compare las dos estructuras de abajo. Observa los espacios vacíos dentro de la estructura del hielo.
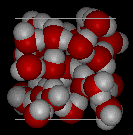
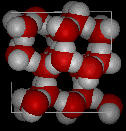
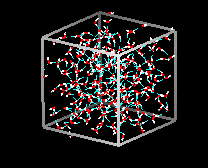
En el hielo Ih, cada agua forma cuatro enlaces de hidrógeno con distancias O—O de 2,76 Angstroms al vecino de oxígeno más cercano. Los ángulos O-O-O son de 109 grados, típicos de una estructura reticular tetraédrica coordinada. La densidad del hielo Ih es de 0,931 gm/cm cúbico. Esto se compara con una densidad de 1,00 gm/cubic cm. para el agua.
Se conocen once formas diferentes de hielo cristalino. La forma hexaganol conocida como hielo Ih es la única que se encuentra de forma natural. Aquí se muestra la estructura reticular del hielo 1h.
 Imagen
Imagen