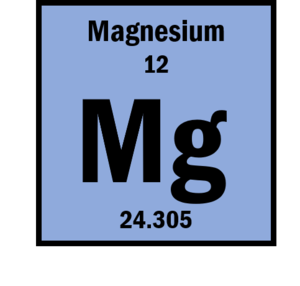
El magnesio es el duodécimo elemento de la tabla periódica de los elementos y es el octavo más abundante en la corteza terrestre. Algunas de sus propiedades son las siguientes:
| Peso atómico | 24,305 |
| Densidad (a 0oC) | 1.74 g/cm3 |
| Punto de ebullición | 1363 K |
| Punto de fusión | 923 K |
El magnesio es un metal alcalino de la Tierra y se encuentra de forma natural en rocas y minerales.
El magnesio es un elemento importante para los seres humanos, los animales y las plantas. Los seres humanos y los animales lo necesitan para que muchas de sus enzimas funcionen correctamente y para mantener los huesos sanos. Las plantas contienen magnesio como molécula central de la clorofila, el compuesto que hace que las plantas sean verdes.
Usos del magnesio

El magnesio se utiliza como agente de aleación con otros metales. Es fuerte y ligero, por lo que mejora las características mecánicas de las aleaciones sin aumentar drásticamente el peso. No se utiliza solo o en grandes cantidades en compuestos porque tiene tendencia a corroerse y a arder. Las aleaciones de magnesio se utilizan en aviones, automóviles y muchos productos electrónicos, como teléfonos móviles y ordenadores.
El magnesio puro inflamado arde muy brillantemente y con facilidad, por lo que se utiliza en fuegos artificiales y bengalas (Figura 2). En cambio, los óxidos e hidróxidos de magnesio se utilizan para aumentar la resistencia al calor y al fuego de los plásticos y los materiales de construcción.
Isótopos
El magnesio tiene tres isótopos que se encuentran en la naturaleza:
| Símbolo | Abundancia natural |
|---|---|
| 24Mg | 78,99% |
| 25Mg | 10% |
| 26Mg | 11.01% |
Vídeo
El vídeo de abajo es del proyecto de vídeos periódicos de la Universidad de Nottingham. Han creado un conjunto completo de vídeos cortos sobre cada elemento de la tabla periódica de los elementos.
Para más información
- Tabla periódica de los elementos
- Metal
- Aleación
- Combustión
- O explora una página al azar
- Hecho internamente por un miembro del equipo de Educación Energética, con información de periodictable.com, Disponible: http://periodictable.com/Elements/001/index.html
- 2.0 2.1 2.2 2.3 Tabla periódica de la Royal Society of Chemistry, Magnesio , Disponible: http://www.rsc.org/periodic-table/element/12/magnesium
- 3.0 3.1 3.2 John Emsley, «Nature’s Building Blocks: An A-Z Guide to the Elements», Oxford University Press, Nueva York, 2ª edición, 2011.
- Chemistry World, «Podcasts: Óxidos de magnesio», Consultado el 8 de octubre de 2018, Disponible: https://www.chemistryworld.com/podcasts/magnesium-oxide/7645.article
- Vea más vídeos de la Universidad de Nottingham sobre diferentes elementos aquí: http://www.periodicvideos.com/