一般名:アシクロビル
剤形:クリーム
医薬品のレビュー Drugs.com でご覧いただけます。 最終更新日:2020年12月1日
- 概要
- 副作用
- 用法用量
- その他
- ゾビラックスクリーム
- ゾビラックスクリームの用法・用量
- 剤形および強さ
- 4禁忌
- 警告と注意
- 一般
- 接触感作性
- 副作用
- 臨床試験の経験
- 市販後調査
- 薬物相互作用
- 特定集団における使用
- リスク概要
- 妊娠
- 授乳
- Pediatric Use
- 老人用
- Overdosage
- ゾビラックスクリームの概要
- Zovirax Cream – Clinical Pharmacology
- Mechanism of Action
- Pharmacokinetics
- Microbiology
- 非臨床毒性学
- 発がん性、変異原性、生殖能力障害
- 臨床試験
- 成人被験者
- 小児
- 使用方法・保管方法・取り扱い方法
- 患者相談情報
- 患者情報ZOVIRAX (zho-vahy-rex)(acyclovir)Cream
- PRINCIPAL DISPLAY PANEL – 5g Tube Carton
- ゾビラックスクリーム(アシクロビル外用)の詳細
- 消費者リソース
- 専門家リソース
- その他の製剤
- 関連治療ガイド
ゾビラックスクリーム
ゾビラックスの適応と用法 クリームは、単純ヘルペスウイルス(HSV)デオキシヌクレオシドアナログDNAポリメラーゼ阻害剤で、免疫力のない成人および12歳以上の青年における再発性口唇ヘルペスの治療に適応されています。
ゾビラックスクリームの用法・用量
ゾビラックスクリームは、1日5回、4日間塗布してください。
12歳以上の青少年には、成人と同じ用法・用量で使用します。
剤形および強さ
ゾビラックスクリーム1g中にアシクロビルとして50mg(5w/wに相当)含まれています。
4禁忌
ゾビラックスクリームは、アシクロビル、バラシクロビル、または製剤のいずれかの成分に対して過敏症が知られている患者には禁忌です。
警告と注意
一般
ゾビラックスクリームは口唇ヘルペスの患者の患側と顔面にのみ適用することです。 データがないため、ヒトの粘膜への塗布は推奨されません。
接触感作性
ゾビラックスクリームは刺激性と接触感作性の可能性があります .
免疫不全患者におけるゾビラックスクリームの効果は確立されていません。
副作用
臨床試験の経験
臨床試験は大きく異なる条件の下で実施されるため、ある薬剤の臨床試験で認められた副作用率は、他の薬剤の臨床試験での率とは直接比較できず、臨床現場で観察される率を反映していないかもしれません。
5件のプラセボ対照二重盲検試験では、1124人がZoviraxクリーム、1161人がプラセボ(車)クリームで治療されました。 局所適用部位反応は、ゾビラックスクリーム投与患者の5%、プラセボ投与患者の4%から報告されました。 最も一般的な局所適用部位の副作用は、唇の乾燥、落屑、皮膚の乾燥、唇の亀裂、皮膚の熱感、皮膚の痒み、皮膚のかさつきおよび皮膚の刺痛で、各副作用はZovirax Creamおよびプラセボ投与患者の1%未満に発生しました。 4211>
健康成人22名を対象とした追加試験では、単包装パッチテスト及び半包装パッチテストの方法を用いて、ゾビラックスクリームの皮膚耐性をビヒクルと比較して検討しました。 その結果、ゾビラックスクリームとプラセボは共に高い累積的な刺激性を示しました。 また、健康成人251名を対象に、反復侮辱パッチテスト法を用いてゾビラックスクリームの接触感作性を評価しました。 評価可能な被験者202名のうち、ゾビラックスクリームとプラセボの両方で同じ4名(2%)に皮膚感作性の可能性が認められ、ゾビラックスクリームとプラセボの両方に対するこれらの反応は再チャレンジにより3名で確認されました。 4211>
市販後調査
臨床試験で報告された有害事象に加えて、アシクロビルクリームの承認後の使用において、以下の事象が確認されています。 これらは、規模が不明な集団から自発的に報告されたものであるため、頻度の推定はできません。 これらの事象は、その重大性、報告頻度、またはアシクロビル・クリームとの因果関係の可能性の組み合わせにより、対象として選択されました。 血管浮腫、アナフィラキシー
皮膚。
薬物相互作用
臨床経験では、ゾビラックスクリームと併用する他の薬剤の局所的または全身的な投与によって生じる相互作用は確認されていない。
特定集団における使用
リスク概要
アシクロビルは局所的な投与経路では全身への吸収が少なく、母親の使用によりゾビラックスクリームが胎児に曝露されることはないと考えられています。 観察研究を含む発表済みの文献に基づく、数十年にわたる妊婦へのアシクロビル外用使用の経験から、薬剤に関連する重大な先天性欠損症、流産、母体または胎児の有害事象のリスクは確認されていません。 アシクロビルの全身曝露による動物生殖試験も実施されています。 詳細については、アシクロビル処方情報を参照してください。
適応となる集団の重大な出生異常および流産の推定バックグラウンドリスクは不明です。 すべての妊娠には、先天性欠損症、流産、またはその他の有害事象のバックグラウンドリスクがあります。
妊娠
リスク概要
アシクロビルは局所的な投与経路では全身への吸収が少なく、母親の使用によりゾビラックスクリームが胎児に曝露されることはないと考えられています。 数十年にわたる妊婦へのアシクロビル外用剤の使用経験は、観察研究を含む公表文献に基づくと、薬剤に関連する重大な先天性欠損症、流産、母体または胎児の有害事象のリスクは確認されていません。 アシクロビルの全身曝露による動物生殖試験も実施されています。 詳細については、アシクロビル処方情報を参照してください。
適応となる集団の重大な出生異常および流産の推定バックグラウンドリスクは不明です。 すべての妊娠には、先天性欠損症、流産、またはその他の有害事象のバックグラウンドリスクがあります。
授乳
リスクの概要
アシクロビルは局所投与では全身への吸収が少なく、授乳によって子どもがゾビラックスクリームにさらされることはないと考えられています。 ゾビラックスが母乳育児児に与える影響や乳汁分泌に関するデータはありません。 母乳育児の発達と健康上の利点は、母親のゾビラックスクリームの臨床的必要性、ゾビラックスクリームまたは母親の基礎疾患による母乳育児児への潜在的な有害作用とともに考慮されるべきです」
Pediatric Use
ゾビラックスクリームによるオープンラベル、非対照臨床試験が、113人の12歳から17歳の再発性口唇ヘルペスの患者さんで行われました。 本試験では,成人と同様の投与方法で治療を行い,有害事象の有無を追跡調査した。 安全性プロファイルは成人と同様であった。
老人用
アシクロビルクリームの臨床試験では、65歳以上の被験者の数が十分でなく、若年者と異なる反応があるかどうかを判断することができませんでした。 その他の報告された臨床経験では、高齢者と若年者の反応に違いは確認されていません。
Overdosage
Zovirax Creamの外用による過量投与は、全身への曝露が最小限であるため、考えにくいとされています。
ゾビラックスクリームの概要
ゾビラックスは、ヘルペスウイルスに有効な合成デオキシヌクレオシド類似体であるアシクロビルの商品名です。
アシクロビルの化学名は2-アミノ-1,9-ジヒドロ-9–6H-プリン-6-オンで、以下の構造式を持っています。 37℃における水への最大溶解度は2.5mg/mLである。 アシクロビルのpKaは2.27と9.25です。
ゾビラックスクリーム1gあたり50mg(5%w/w相当)のアシクロビルと、以下の不活性成分(セトステアリルアルコール、ミネラルオイル、ポロキサマー407、プロピレングリコール、ラウリル硫酸ナトリウム、水、ホワイトペトロタム)を含有しています。
Zovirax Cream – Clinical Pharmacology
Mechanism of Action
アシクロビルはα-ヘルペスウイルスに対して活性な抗ウイルス薬です。
Pharmacokinetics
アシクロビルの経皮吸収について、成人ボランティアでZovirax Creamを用いた臨床薬理試験が実施されました。 男性6名を対象とし,背部710cm2の範囲に2時間おきに1日5回,計4日間クリームを塗布した。 毎日,塗布したクリームの重量とアシクロビルの尿中排泄量を測定した. 最終塗布から1時間後にアシクロビルの血漿濃度を測定した。 1日の平均尿中排泄量は,塗布量の約0.04%であった。 血漿中アシクロビル濃度は,5名で検出限界以下(0.01 μM),1名でほとんど検出されなかった(0.014 μM)。 ゾビラックスクリームからのアシクロビルの全身吸収は、成人では最小限です。
クリームの局所適用後のアシクロビルの全身吸収は、<18 歳の患者では評価されていません。
Microbiology
Mechanism of Action(作用メカニズム)。 アシクロビルは、HSV 1型(HSV-1)および2型(HSV-2)のDNAポリメラーゼに対して細胞培養およびin vivo阻害活性を有する合成プリンデオキシヌクレオシドアナログである。 4211>
アシクロビルの阻害活性は、HSVがコードするチミジンキナーゼ(TK)酵素に対する親和性による選択的なものである。 このウイルス酵素はアシクロビルをデオキシヌクレオチドアナログであるアシクロビルモノフォスフェートに変換する。 この一リン酸は、さらに細胞内のグアニル酸キナーゼによって二リン酸に変換され、多くの細胞内酵素によって三リン酸に変換される。 生化学的アッセイでは、アシクロビル三リン酸はα-ヘルペスウイルスのDNAの複製を阻害する。 この阻害は、3つの方法で行われる。 1)ウイルスDNAポリメラーゼの競合阻害、2)成長するウイルスDNA鎖への取り込みと終結、3)ウイルスDNAポリメラーゼの不活性化。
抗ウイルス活性
細胞培養におけるヘルペスウイルスの抗ウイルス剤に対する感受性と治療に対する臨床反応性の間の定量的関係はヒトにおいて確立されておらず、ウイルス感受性試験の標準化もされていない。 細胞培養におけるウイルスの増殖を50%抑制するのに必要な薬剤の濃度(EC50値)で表される感受性試験の結果は、様々な要因によって大きく異なる。 Vero細胞を用いたプラーク減少試験において,単純ヘルペスウイルス分離株に対するアシクロビルのEC50値は,HSV-1では0.09〜59.9μM(0.02〜13.5μg/mL),HSV-2では0.09〜13.5μg/mLであった。
耐性
細胞培養
細胞培養でアシクロビル耐性HSV-1およびHSV-2を単離した. Acyclovir耐性HSVはウイルスのthymidine kinase(TK,pUL23)およびDNA polymerase(POL,pUL30)遺伝子に変異を有するものであった。 フレームシフトは,HSVのTK産物の早期切断を引き起こし,その結果,アシクロビルに対する感受性が低下することがよく知られている. ウイルスTK遺伝子の変異は,TK活性の完全な喪失(TK negative),TK活性の減少(TK partial),またはチミジンをリン酸化する能力を失うことなく薬剤をリン酸化するウイルスTKの能力の変化(TK altered)を引き起こす可能性がある. 細胞培養では,HSV-1およびHSV-2のTKにおいて,以下の耐性関連置換が観察された(表1).
|
HSV-1 |
TK |
P5A, H7Q、L50V、G56V、G59A、G61A、K62N、T63A、E83K、P84S、D116N、P131S、R163H、A167V、P173L, Q185R, R216S, R220H, T245M, R281stop, T287M, M322K |
|
HSV-2 |
TK |
L69P, C172R、T288M |
|
HSV-1 |
POL |
D368A, Y557S, E597D, V621S, L702H, N815S, V817M, G841C |
|
HSV-2 |
POL |
HSV感染者において
臨床のHSV-1とHSV-はα-ヘルペスウイルス感染症の治療に失敗した患者から得られた2株について,TKおよびPOL遺伝子の遺伝子型変化とアシクロビルに対する表現型耐性を評価した(表2). TKとPOLにフレームシフト変異と耐性に関連する置換を有するHSV分離株が同定された。 アシクロビルに対する感受性を低下させるHSVのTKおよびPOLの置換基のリストはすべてを網羅しているわけではなく,アシクロビルを含むレジメンが無効な患者から分離されたHSV亜種ではさらなる変化が確認されると思われる. 治療が奏功しない患者や治療中にウイルス排泄が再発する患者では,アシクロビルに対するウイルス耐性の可能性を考慮する必要がある。 治療患者において観察されたACV耐性関連アミノ酸置換のまとめ
HSV-1
TK
G6C, R32H, R41H, R51W, Y53C/D/H, Y53stop, D55N, G56D/S, P57H, H58/N/R/Y, G59R, G61A, K62N, T63I, Q67stop, S74stop, Y80N, E83K, P84L, Y87H, W88R, R89Q/W, E95stop, T103P, Q104H, Q104stop, H105P, D116N, M121L/R, S123R, Q125H, M128L, G129D, I143V, A156V, D162A/H/N, R163G/H, L170P, Y172C, P173L, A174P, A175V, R176Q/W, R176stop, L178R, S181N, V187M, A189V, V192A, G200C/D/S、T201P、V204G、A207P、L208F/H、R216C/H、R220C/H、R221H、R222C/H、L227F、T245M/P、L249P、Q250Stop, C251G、R256W、E257K、Q261R、T287M、L288Stop、L291P/R、L297S、L315S、L327R、C336Y、Q342Stop、T354P、L364P。 A365T
HSV-2
TK
R34C, G39E、R51W、Y53N、G59P、G61W、S66P、A72S、D78N、P85S、A94V、N100H、I101S、Q105P、T131P、D137stop, F140L, L158P, S169P, R177W, S182N, M183I, V192M, G201D, R217H、R221C/H、 Q222stop, R223H, Y239stop, R271V, P272S, D273R, T287M, C337Y
HSV-1
POL
K532T.K
HSV-2
POL
E250Q 、D307N、K533E、A606V, C625R、R628C、E678G、A724V、S725G、S729N、I731F、Q732R、M789K/T、V818A、N820S、Y823C、Q829R、T843A、M910T、D912N/V、A915V、F923L、T934A、R964H<4211><4616>
交差耐性
ペンシクロビル(PCV)、ファムシクロビル(FCV)、ホスカルネット(FOS)に対する感受性を低下させるフレームシフト変異および耐性関連置換を有するHSV分離株で交差耐性が観察される。
|
PCV/FCVに交差耐性 |
HSV-1 TK |
G6C.C. |
FOS> |
HSV-1 TK |
FCV/MK |
|
|
PCV/FCVに交差耐性 |
HSV-1 POL |
|||||
|
PCV/FCVに交差耐性 |
HSV-2 TK |
|||||
|
HSV-2 POL |
K533E, A606V, C625R, R628C, S729N, Q732R, M789K/T, V818A, N820S, F923L に対して交差抵抗性。 T934A |
|||||
|
FOSに交差耐性 |
HSV-1 POL |
D368A.に耐性を有する。 A605V、D672N、L702H、V715G、A719T/V、S724N、L778M、E798K、V813M、N815S、V817M、G841C/S、I890M, |
||||
|
FOSに交差耐性 |
HSV-2 POL |
K533E, A606V、C625R、R628C、A724V、S725G、S729N、I731F、Q732R、M789K/T、V818A、Y823C、D912V、F923L、T934A, R964H |
非臨床毒性学
発がん性、変異原性、生殖能力障害
アシクロビルの局所投与による全身への暴露は最小限である。 経皮発がん性試験は実施されていない。 発がん性、変異原性、生殖能力に関する試験結果は、アシクロビルの経皮投与による曝露が最小限であるため、Zoviraxクリームの全処方情報には記載されていません。 これらの試験に関する情報は、ZOVIRAX Capsules, Tablets, and SuspensionおよびZOVIRAX for Injectionの全処方情報に記載されています。
臨床試験
成人被験者
Zoviraxクリームは、再発口唇ヘルペスの治療に関して2つの二重盲検、無作為、プラセボ(車両)対照試験で評価されました。 平均的な患者は、過去12カ月間に5回の口唇ヘルペスのエピソードがあった。 最初の試験では、被験者の年齢中央値は37歳(範囲18~81歳)、74%が女性、94%が白人でした。 第2試験は、年齢中央値38歳(範囲18~87歳)、女性73%、白人94%で、第1試験は、年齢中央値38歳(範囲18~87歳)、女性73%、白人94%、第2試験は、年齢中央値38歳(範囲18~87歳)、女性73%、白人94%でした。 被験者は、兆候や症状に気づいてから1時間以内に治療を開始し、4日間治療を継続するよう指示され、試験薬は1日5回塗布された。 両試験において、口唇ヘルペス再発の平均期間は、Zovirax Cream(n=682)投与群では、プラセボ投与群(n=703)と比較してそれぞれ約4.5日対5日と約半日短縮されました。
小児
再発性口唇ヘルペスの12歳から17歳の患者さん113名を対象に、ゾビラックスクリームの非盲検非対照試験が実施されました。 本試験では,成人と同様の投与方法で治療を行い,有害事象の有無を追跡調査した。 4211>
使用方法・保管方法・取り扱い方法
ゾビラックスクリーム1g中にアシクロビル50mg(5%w/w相当)を水性クリームベースにて含有しています。
NDC 0187-0994-45:5gチューブ
25℃以下で保管し、15℃~30℃までなら可。
患者相談情報
患者にFDA承認の患者表示(患者情報)を読むように助言すること。
一般
患者には、ゾビラックスクリームは顔や唇にできる冷え症(口唇ヘルペスの再発)の治療のための処方外用クリームであることを知らせる必要があります。 ゾビラックスクリームは冷え症を治療するものではありません。 患者には、ゾビラックスクリームは口唇および口の周りの口唇ヘルペスのための皮膚使用のみを意図していることを指導する必要があります。 ゾビラックスクリームは目、口、鼻の中、生殖器には使用しないよう患者に指導してください。
ゾビラックスクリームまたはゾビラックスクリームの成分に対してアレルギーがある場合は使用しないでください。
使用上の注意
治療は、再発の徴候や症状が出た時点で開始する必要があります。 塗布する前に手を洗い、顔や唇が清潔で乾いた状態であることを確認するよう患者に指導してください。 ゾビラックスクリームを1日5回、4日間外用するよう患者に指導する。 外周部を含む患部を覆うのに十分な量のゾビラックスクリームを局所的に塗布するよう患者に指導してください。 感染を悪化させたり移したりしないために、患部を不必要にこすらないように患者に指導する。 ゾビラックスクリームの使用後は、石鹸と水で手を洗うように患者に指導してください。
起こりうる副作用
ゾビラックスクリームを塗布した際に発生した一般的な皮膚関連の副作用には、塗布部位反応があります。 ゾビラックスクリームは刺激性と接触感作の可能性があります。
販売元。 Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Manufactured by: ボシュヘルス・カンパニーズ・インク
Laval, Quebec H7L 4A8, Canada
Zoviraxはグラクソ・スミスクライン社の登録商標で、ボシュヘルス社のライセンスに基づき使用されています。
© 2020 Bausch Health Companies Inc.またはその関連会社
9462203
患者情報ZOVIRAX (zho-vahy-rex)(acyclovir)Cream
重要な情報です。 ゾビラックスクリームは、唇や口の周りの冷たいただれにのみ使用されます。 ゾビラックスクリームは、目、口、鼻、または生殖器には使用しないでください。
ゾビラックスクリームとは? – ゾビラックスクリームは、冷え症を治療するものではありません。
12歳未満の小児に対するゾビラックスクリームの安全性と有効性は不明です。
アシクロビル、バラシクロビル、またはゾビラックスクリームの成分に対してアレルギーがある場合は、ゾビラックスクリームを使用しないでください。
ゾビラックスクリームを使用する前に、医療関係者に伝えておくべきことはありますか?
ゾビラックスクリームを使用する前に、以下の場合を含め、すべての病状について医療関係者に伝えてください:
– 非常に病気になりやすい(免疫システムが弱い)。 – 妊娠している、または妊娠を計画している。 ゾビラックスクリームが胎児に害を及ぼすかどうかは分かっていません。 – 授乳中、または授乳を計画している。 ゾビラックスクリームが母乳に移行するかどうかは分かっていません。 ゾビラックスクリームを使用する場合、赤ちゃんに授乳する最適な方法について医療従事者に相談してください。
処方薬、市販薬、ビタミン、ハーブサプリメントなど、服用する全ての薬について医療提供者に伝えてください。
ゾビラックスクリームはどのように使用すれば良いですか?
– 医療提供者が使用するように指示した通りにゾビラックスクリームを使用してください。 – ゾビラックスクリームは、かゆみ、赤み、熱感、ヒリヒリ感などの冷え症の最初の症状が出たら、または冷え症が現れたら、すぐに使用してください。 – ゾビラックスクリームを塗る前と後に、石鹸と水で手を洗ってください。 – ゾビラックスクリームを塗る前に、患部は清潔で乾燥している必要があります。 – ゾビラックスクリームを患部に毎日5回、4日間、外縁も含めて塗布してください。 – ゾビラックスクリームの治療中は、患部に他の皮膚用品を塗ってはいけません。 – 冷え症を不必要にこすることは、冷え症が口の周りの他の部位に広がったり、冷え症を悪化させたりする可能性があるので、避けてください。
ゾビラックスクリームの副作用にはどのようなものがありますか?
最も一般的な副作用は、治療部位の皮膚反応で、唇の乾燥や亀裂、皮膚の剥離や乾燥、熱感やしみる感じ、かゆみなどが考えられます。 副作用については、医師に電話で相談してください。
ゾビラックスクリームの保管方法
– ゾビラックスクリームは、20°から25°Cの室温で保管してください。
ゾビラックスクリームやすべての医薬品は、子供の手の届かないところに保管してください。
ゾビラックスクリームの安全で有効な使用に関する一般的な情報
医薬品は時に、患者情報リーフレットに記載されている目的以外のために処方されることがあります。 処方されていない症状には、ゾビラックスクリームを使用しないでください。 あなたと同じ症状であっても、他の人にゾビラックスクリームを与えないでください。 害を及ぼす可能性があります。 ゾビラックスクリームに関する情報は、医療従事者向けに書かれていますので、薬剤師や医療従事者にお尋ねください。
ゾビラックスクリームの成分は?
有効成分:アシクロビル
無効成分:セトステアリルアルコール、ミネラルオイル、ポロキサマー407、プロピレングリコール、ラウリル硫酸ナトリウム、水、ホワイトペトロラタム
販売元は、以下の通り。 Bausch Health US, LLC
Bridgewater, NJ 08807 USA
製造元:Bausch Health US, LLC
Manufactured by: Bausch Health Companies Inc.
Laval, Quebec H7L 4A8, Canada
Zovirax is a registered trademark of the GlaxoSmithKline group used under license by Bausch Health.
© 2020 Bausch Health Companies Inc. or its affiliates
For more information, call 1-800-321-4576.
This Patient Information has been approved by the U.S. Food and Drug Administration.A. (米国).
Revised: 12/2020
9462203
PRINCIPAL DISPLAY PANEL – 5g Tube Carton
ZOVIRAX®
(ACYCLOVIR) CREAM 5%
NDC 0187-0994-45
正味重量:5g。 5g
内容:
アシクロビル50mg、セトステアリルアルコール、ミネラルオイル、ポロキサマー407、プロピレングリコール、ラウリル硫酸ナトリウム、水、白色ワセリン
風邪の傷にのみ使用
傷にのみ使用
傷にのみ使用
傷にのみ使用。
Ortho Dermatologics
Rx only
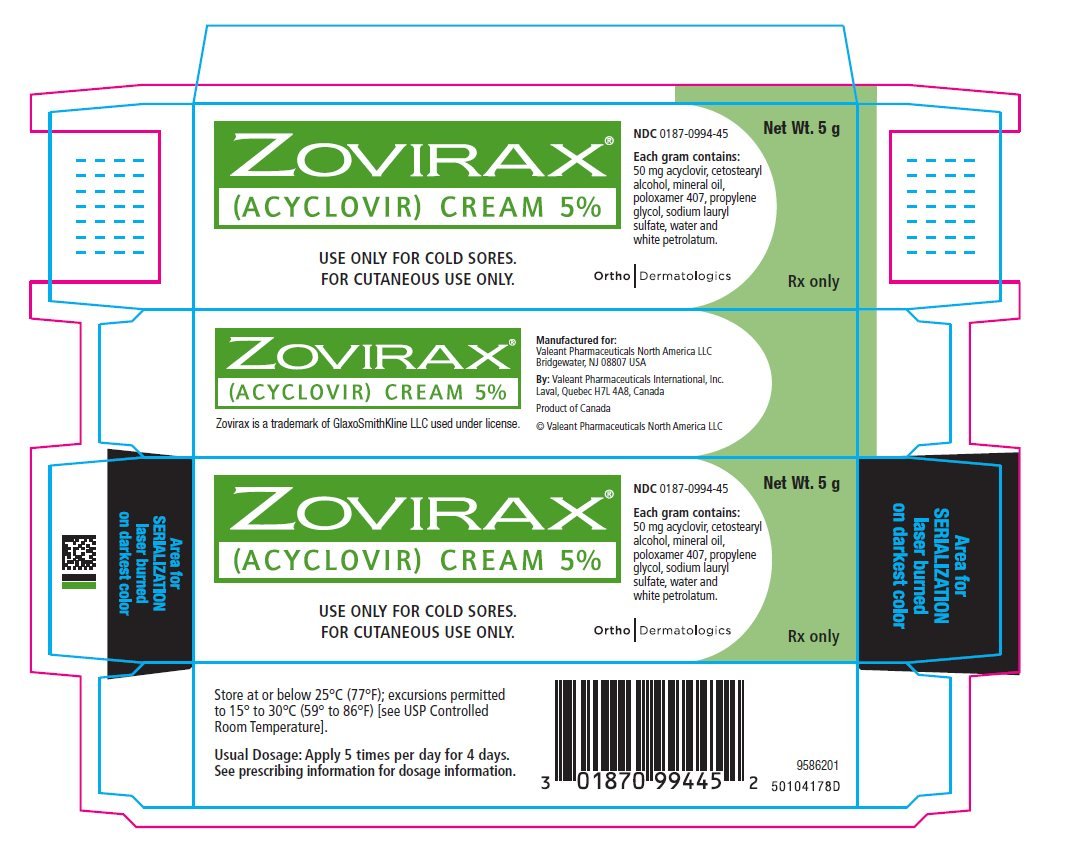
| ZOVIRAX acyclovir cream |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ラベル付け – (注)1.表示されるラベルの種類は、各表示の種類によって異なります。 バウシュヘルスUS, LLC (831922468)
Bausch Health US, LLC
ゾビラックスクリーム(アシクロビル外用)の詳細
39件 消費者リソース
専門家リソース
その他の製剤
関連治療ガイド
医療上の免責 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||