細胞のDNAへのダメージなどの細胞内の合図は、主に真性経路を通じてアポトーシスを駆動します。 保存されたシグナル伝達タンパク質が関与する内在性アポトーシス経路は、ミトコンドリアと物理的に関連しており、脊椎動物ではミトコンドリアの酸化ストレスに敏感である。 この経路は、ミトコンドリア膜に結合しているBclファミリーのメンバー(BaxとBcl-2遺伝子を含み、それぞれ親または抗アポトーシス制御タンパク質として働く)の影響を受ける。
内在性アポトーシス経路の概要
内在性アポトーシス経路は、例えば化学療法や放射線療法により開始される。 また、DNA損傷、虚血、酸化ストレスなど様々な外因性・内因性刺激によって活性化される。
内在性経路では、アポトーシス促進シグナルの機能的結果として、ミトコンドリア膜の障害と細胞質へのチトクロムcの放出が起こり、アポトーシスプロテアーゼ活性化因子1(APAF1)とカスパーゼ9の活性型との複合体またはアポプトソームを形成する。 この複合体は、アデノシン三リン酸を加水分解し、カスパーゼ9を切断し活性化する。 そして、イニシエーターであるカスパーゼ9は、エグゼキューターであるカスパーゼ3/6/7を切断・活性化し、細胞のアポトーシスをもたらす。 これは、通常、免疫系の細胞障害性細胞によって生成され、主に外来経路を介してアポトーシスを誘発する細胞外シグナルとは全く異なる。
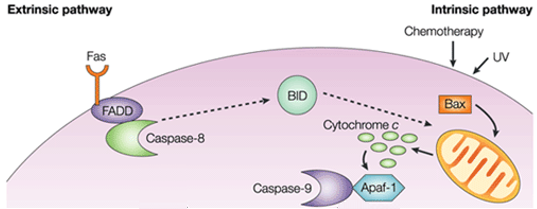
図1.外来経路の特徴。 外因性経路と内在性経路の違い
内在性アポトーシス経路のプロセスと制御
内在性アポトーシス経路は、カスパーゼ3を直接活性化するかbid(BH3相互作用ドメイン死アゴニスト)の切断により、ミトコンドリア機能障害とその後のチトクロームc放出およびカスパーゼ9とカスパーゼ3の活性化を引き起こしアポトー シスを誘発させる。 カスパーゼ-3は、いくつかの組織でDNAの断片化や細胞死などの典型的なアポトーシスの特徴を促進する。
B-cell lymphoma 2 (Bcl-2) protein familyは、内在性経路の活性化を厳密に制御している。 濾胞性リンパ腫で発見され、プロアポトーシスを活性化するか、アンチアポトーシスアポトーシスを阻害することによって細胞死に関与する遺伝子の一つとして最初に同定された。 Bid、Bad、Bim、Bmf、Puma、Noxaなどの1つのサブグループに属するタンパク質は、単一のBcl-2相同性3ドメインを含み(BH3 onlyタンパク質)、プロアポトーシス活性を持っている。 他の2つのタンパク質サブセットは複数のBHドメインを持つ。 Bcl-2 associated X protein (Bax), Bcl-2 homologous antagonist/killer (Bak) and Bcl-2 family apoptosis regulator (Bok) を含む最初のサブセットはプロアポトーシスであり、Bcl-2、Bcl-XL、Mcl-1を含む他のサブセットは抗アポトーシスである。 ミトコンドリア経路は,ミトコンドリア膜に結合したBclファミリーメンバー(親アポトーシス制御タンパク質Baxと抗アポトーシス制御タンパク質Bcl-2の両方を含む)の影響を一部受ける。
親アポトーシス分子によってミトコンドリア外膜が透過し,シトクロムcの流出をもたらし,細胞質でアダプターApaf-1と開始因子カスパーゼ9が結合してアポプトソーム複合体を形成する。 これがカスパーゼ9を刺激し、エフェクターカスパーゼを活性化させる。 また、ミトコンドリアはSmac/DIABLOと呼ばれるタンパク質を細胞質内に放出する。 Smac/DIABLOは、inhibitor of apoptosis proteins (IAPs) と呼ばれる抗アポトーシス蛋白質のグループの効果を阻害することによって間接的にアポトーシスを促進する。
抗アポトーシス蛋白質のBcl-2とBcl-XLはチトクロームcの放出を阻害するが、Bax、BakおよびBidはすべてのプロアポトーシス蛋白質がミトコンドリアからのその放出が促進される。 シトクロムcとデオキシアデノシン三リン酸(dATP)はAPAF-1と結合して多量体を形成し、アポトーシス誘導実行蛋白であるプロカスパース9をリクルートして活性化し、さらにカスパーゼカスケードを活性化して細胞のアポトーシスを引き起こす。 この過程で、カスパーゼ-2、カスパーゼ-8、カスパーゼ-9およびカスパーゼ-10がアポトーシスの開始に関与している。 カスパーゼ-3、カスパーゼ-6、カスパーゼ-7はアポトーシスに関与している。 カスパーゼ-3とカスパーゼ-7は、DNA修復の阻害を制御し、DNAの分解を開始させる。 さらに、カスパーゼ-6はラミナと細胞骨格の崩壊を調節する。
病態生理学における内在性アポトーシス経路
ほとんどの化学療法および標的癌治療は、プログラム細胞死の内在性アポトーシス経路を開始するプロ死シグナルの生成を通じて腫瘍細胞を死滅させている。 アポトーシスのカスケードにおける帰着点は、ミトコンドリア外膜の透過(MOMP)である。いったんそれが起こると、ミトコンドリアの透過はアポトーソームの形成につながり、カスパーゼの活性化を促進し、続いてアポトーシス細胞死の他の特徴を誘発する。 MOMPを開始する細胞の決定は、BCL-2ファミリーのプロおよびアンチアポトーシス分子の間の微妙なバランスによって制御されている。
化学療法耐性の理由の1つは、内在性アポトーシス経路の欠陥(例えば、p53の変化)による腫瘍細胞のアポトーシスへの移行不全である。 治療法が大幅に改善されたにもかかわらず、多くの癌の治癒率は依然として最適とは言えない。 細胞毒性化学療法の台頭により、一部のがんは治癒するようになったが、内在性治療抵抗性を個々の患者について予測することは困難である。 分子標的治療の波は、薬物ゲーブル活性化変異に焦点を当てているため、特定の患者群に限定されている。 アポトーシスの内在性ミトコンドリア経路は、新しい治療法の有望な標的の一つであり、この経路をうまく標的とすることで、様々な癌の治療の状況を変える可能性を秘めている
。