Manuscript accepted on :29 Aug 19
Published online on: 18-09-2019 Plagiarism Check: はい
査読済み。 ファルーク・シャー
さんのレビュー Grigorios Kyriakopoulos
Final Approval by: Ayush Dogra
How to Citeclose|出版履歴close
Vijitra Luang-In1* , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 and Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 and Kedsukon Maneewan1
1 Natural Antioxidant Innovation Research Unit.を設立。 マハサラカム大学技術学部バイオテクノロジー学科 〒44150 タイ王国マハサラカム市カムリアン、カンタラウィチャイ地区
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thailand.
Corresponding Author E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
この研究はタイ、Mahasarakham県、Kantarawichai地区Nasinuan未踏森からアミラーゼ酵素を生成できるバクテリアを単離して特定する目的で行われました。 1%デンプン寒天培地上でアミラーゼ産生能を有する13の細菌を16S rRNA配列決定法を用いて同定した。 12菌はグラム陽性、桿状でBacillus属、1菌はグラム陰性、桿状でEnterobacter cloacaeであると同定された。 これらの近縁種はインド、中国、韓国、インドネシア、アルゼンチン、イタリア、イスラエル、アメリカ、アルゼンチン、南アフリカで発見された。 これらの細菌について、1%デンプンを用いて37℃で1〜3日間の酵素誘導を行った後、特異的アミラーゼ活性を調べた。 その結果、2日目の培養で最も高い比活性を示したのは、次の順であった。 Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3 の順で2日目の酵素誘導が最も高いことを示し、さらなる解析のために2日目の酵素誘導が選択された。 Bacillus sp. 3.5AL2は、0.05 M PBSバッファー中1%のデンプンと30分間インキュベートした後、60℃、pH 7.0の最適条件で1.97 ± 0.41 U/mgタンパク質という最高の比アミラーゼ酵素活性を示すことが見いだされた。 このアミラーゼ生産細菌株は、タイの食品および農業産業への応用に大きな可能性を秘めている。
キーワード
アミラーゼ;バクテリア;ナシヌアン森林;土壌
この論文をダウンロードする。![]()
この記事を引用するために以下をコピーしてください:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand.(タイ、ナシヌアンの森林の土壌からのアミラーゼ産生細菌の分離と同定).Luang-In M, W, Sengha L, Udomwong P, Deeseenthum S, Maneewan K. Biomed Pharmacol J 2019;12(3).
このURLを引用するために以下をコピーしてください:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K.Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand.を引用してください:Manny K. Biomed Pharmacol J 2019;12(3). Available from: http://biomedpharmajournal.org/?p=28497
Introduction
デンプン加水分解アミラーゼ(α-アミラーゼ、β-アミラーゼ、グルコアミラーゼ)は現在のバイオテクノロジーにおいて最も広く使用されている酵素の1つである。 グルコアミラーゼ(1,4-α-D-グルカン グルカノヒドロラーゼ;EC 3.2.1.3)またはアミログルコシダーゼは、デンプンおよび対応するオリゴ糖の非還元末からグルコースを生成する外作用型アミラーゼである。 グルコアミラーゼは、マルトオリゴ糖をグルコースに変換するために商業的に実施されている1。 アミラーゼは様々な供給源(微生物、植物、動物)から生産されるが、微生物由来のアミラーゼは、微生物の短い増殖期間、低コストで効果的な生産、環境に優しい行動、作業者の取り扱いに関する問題が少ない、生産性2、細菌の遺伝子操作が容易なことから工業生産に最も適しているとされている3。 細菌や菌類は、細胞外にアミラーゼを分泌し、デンプンを糖に分解する細胞外消化を行う傾向がある。
食品、デンプン液化、糖化、醸造、洗剤、製紙、繊維、蒸留などの産業でアミラーゼが広く利用されていることから、α-アミラーゼの自家生産の拡大が注目されている4。 バチルスは、工業的なアミラーゼ生産のための一般的な細菌源である。 しかし、菌株によって最適な増殖条件や酵素生産プロファイルが異なる。 これまでに、B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8, B. circulans9など、α-アミラーゼ生産に広く利用されているBacillus属の菌株が報告されています。
現在までに多くのアミラーゼ産生菌が記録されているが、タイ国マハサラカム県カンタラウィチャイ郡ナシヌアン コミュニティフォレストの土壌からアミラーゼ産生菌の研究は報告されていない。 この森林は、アミラーゼを含む工業用酵素の生産に有用な微生物の生物多様性に富んでいると思われる。 本報告は、ナシヌアン森林から分離されたアミラーゼ産生細菌を同定した最初の報告である。 これらの細菌性アミラーゼは、将来的にタイのパルプ・紙、繊維、バイオエタノール、醸造、食品加工、動物飼料、農業など様々な産業に現地で応用することが可能です。
材料と方法
土壌サンプル
土壌サンプルは、タイ国マハサラカム県カンタラウィチャイ郡ナシヌアン コミュニティフォレスト(面積9.6 hectare; coordinate of 16.340941, 103.210799)。
アミラーゼ産生菌の分離
土壌サンプル(10 g)を90 mLの無菌0.85% NaCl溶液に懸濁させた。 連続希釈した懸濁液(100 µL)を澱粉寒天(g/L); 3.0 beef extract, 10.0 soluble starch, 15.0 agar pH 7.0 に広げ、37℃で7日間静置培養を行った。 次に、プレートをグラムヨードで浸漬した。 コロニーの周囲に透明な帯が形成されているものは、液体ブロスで再培養し、少なくとも5回ストリークして、グラム染色と1000倍の光学顕微鏡観察で確認された純粋な分離株を入手した。 この純菌株をデンプン寒天培地に点接種し,37℃,7日間培養した。 コロニーの直径に対する透明帯の直径を定規で測定し,Halo : Colony ratioとした.
16SrRNA遺伝子配列決定と系統解析
上記の方法で得られたゲノムDNAとユニバーサルプライマー:フォワードプライマー27F 5′-GAGAGTTTGATYCTGCTCAG-3′ とリバースプライマー1492R 5’AAGGAGGTGATCCARCCGCA -3′ を用いて純粋細菌分離株を同定した。 25 µL PCR混合液には、ゲノムDNA 0.5 ng、100 mM Tris-HCl (pH 9.1), 0.1% TritonTMX-100, 200 mM dNTP, 1.5 mM MgCl2, 0.005 U Taq DNA Polymerase, 0.2 μM forward and reverse primerからなる2X Master Mix (One PCR) を無核水で容量調整しながら混合した。 PCRサーモサイクラー(Thermo Scientific Hybaid Px2)は、以下のようにプログラムした。 (1) 94 ºC で2分間の初期変性、1サイクル; (2) 94 ºC で45秒間の変性、54 ºC で45秒間のアニーリング、72 ºC で1分間の伸長を32サイクル; (3) 72 ºC で7分間の最終伸長。 サンプルは次の分析まで4 ºC で保存した。 16S rRNA の PCR 産物 (~ 1,500 bp) は 0.8% アガロースゲルで検出し、PCR 産物精製キット (Vivantis, Malaysia) で精製後、First Base Co. Ltd.に送った。 (マレーシア)に送付し、DNA塩基配列を決定した。 16S rRNA遺伝子の配列は、BLASTNプログラム(Basic Local Alignment Search Tools)10を用いてGenBankで公開されている他の遺伝子と比較した。 系統樹は、Muscle法による配列アライメントとMEGA Xによる最尤法を用いて、ブートストラップ値を1,000回繰り返しながら構築した11。 アミラーゼ産生株の16S rRNA部分配列はすべてNCBIデータベースに登録した。
アミラーゼ酵素活性の測定
方法はBhaskara et al. アミラーゼ酵素活性の測定には、ハロ:コロニー比が最も高い3つの細菌を選択した。 各単離菌はデンプン液体ブロス(g/L): 10.0 soluble starch, 10.0 peptone, 20.0 yeast extract, 0.05 KH2PO4, 0.015 MnCl2.4H2O, 0.25 MgSO4.7H2O, 0.05 CaCl2.2H2O, 0.01 FeSO4.7H2O で前培養し37℃、150 rpmで1、2、3日間インキュベートされた。 10,000g、4ºCで15分間遠心分離した後、透明な上清(粗細胞外アミラーゼ酵素)を得た。 この粗抽出液をMWCO10kDa超遠心機タンパク質濃縮機(Vivaspin, Sartorius, UK)を用いて濃縮した。
DNS法13を用いて、各酵素誘導日における各菌株のアミラーゼ活性を測定した。 粗酵素1mLを1mLの0.05Mリン酸ナトリウム緩衝液pH7.0に溶解した1%デンプン溶液と混合し、1mLとした。 37℃で30分間インキュベートした。 インキュベーション後、各サンプルに0.5 mLのDNS溶液を加えて反応を停止させ、水浴中で100℃、5分間煮沸した。 分光光度計を用いて575 nmで光学濃度(OD)を測定し、溶液の色の強さを観察した。 読み取り値は、調製したブランク溶液(粗酵素を含まない)と比較した。 T0minのサンプルには、1、2、3日の酵素誘導処理後もグルコースが残存しているため、T30minのサンプルのOD値をT0minのサンプルのOD値から差し引いた。 本処理は3連で行った。 各溶液の生成グルコース濃度は、グルコース標準曲線から求めた。 アミラーゼの活性を算出した。 アミラーゼ活性の1単位は、アッセイ条件下で1分間に1μmolのグルコースに等しい還元糖の形成を触媒するのに必要なアミラーゼの量と定義した14。
最高の活性を有する細菌分離株の粗酵素をさらなる作業のために選んだ。
選んだ分離株の比酵素活性を求めるために、Folin-Lowry法による総蛋白質推定法を使用した15。 比酵素活性は、以下の式を用いて測定した。
比活性(U/mg)=酵素活性(U/ml)/細胞外タンパク質濃度(mg/ml)
アミラーゼ酵素活性の最適pHおよび温度
3から10までの異なるpHの水溶性デンプンの溶液(1%)について試験を行った。 異なる1%基質溶液1mLをそれぞれの緩衝液1mLとともに加えた;0.05Mクエン酸緩衝液(pH3から5)、0.05Mリン酸ナトリウム緩衝液(pH6と7)、0.05Mトリス-塩酸(pH8と9)、0.05Mグリシンナオハ(pH10)。 これらの緩衝液にも粗酵素を1mL添加した。 37℃で30分間インキュベートした。 比アミラーゼ活性を算出した。 最も高い活性が観察されたpHを記録した。 同様に、1%の可溶性デンプンをpH7.0の溶液に溶かし、異なる基質溶液を作った 1mLの1%可溶性デンプンを1mLの0.05Mリン酸ナトリウム緩衝液(pH7)と共に添加した。 粗酵素1mLを同様に緩衝液に添加した。 20, 30, 40, 50, 60, 70, 80°Cで30分間インキュベートした。 比アミラーゼ活性を算出した。 最も高い活性が観察された温度を記した。 7583>
統計解析
一元配置分散分析(One-Way Analysis Of Variance)は、SPSS Statistics Ver.17.0でDuncan Multiple Rangeの検定とともに使用された。 結果は平均値±SDで表し、統計的差異はp< 0.05とした。
結果
アミラーゼ生産菌の分離
本研究では、アミラーゼ陽性の13株が、異なるHalo : Colony比の1%スターチアガーでクリアゾーンを見せた。 ヨウ素溶液で明瞭なゾーンを示したコロニーをデンプン分解菌陽性コロニーとした。 いずれの菌株もコロニーの形態は類似しており,グラム陽性で棒状の細菌であった(Table 1)。 その結果、ハロ:コロニー比は1.18から1.71の範囲であった(表1)。 次に、分離した細菌を用いて最適なアミラーゼ酵素誘導期間を決定し、最も比活性の高い3株のみを3.4に示した。
アミラーゼ生産菌の菌株識別
アミラーゼ陽性細菌13株について、16S rRNA遺伝子配列決定による菌株識別を実施した。 BLASTの結果、アミラーゼ陽性菌はEnterobacter属に属する1株を除き、すべてBacillus属に属することが示された(表2)。 その近縁種はインド,中国,韓国,インドネシア,アルゼンチン,イタリア,イスラエル,アメリカ,アルゼンチン,南アフリカに存在し,同一性は96-100%であった。
系統解析
MEGA 7.0を用いてアミラーゼ陽性菌13株とアミラーゼ酵素を推定する参照株2株の系統樹を作成し,E. cloacae 2.1AL2 が他の Bacillus 属とは進化的に異なることがわかった(図 1). B. thuringiensis serovar konkukian (NCBI accession no. AB617494.1) 参照株は、我々のBacillus属細菌と異なる進化を遂げた。 しかし、紅花の葉、Eqyptから分離した別の参照株B. cereus ATCC 14579 (NCBI accession no. MG708176.1) は、我々の細菌と同様の進化を示した(Fig.1)。
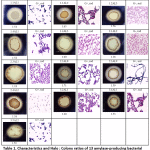 |
Table 1: Characteristics and Halo .Colony(表1):アミラーゼ生産細菌13株の特徴とHalo : Colony ratios(表1):アミラーゼ生産細菌13株の特徴とHalo : Colony ratios(表1)。 アミラーゼ生産菌13株のコロニー比
Click to View table |
最適なアミラーゼ酵素誘導期間
最も比活性の高いアミラーゼ生産を誘導する培養期間は3株とも統計的差異なく2~3日であることが示された。 Bacillus sp.3.5AL2は37℃で2日目に0.91±0.12 U/mgと最も高い比活性を示した(表3)。 アミラーゼ酵素活性の最適なpHと温度
Bacillus属3.5AL2は37℃固定ではpH7.0で、60℃固定ではpH7.0で最高の比活性を示した(Fig. 2). したがって、両方の最適条件を用いて比アミラーゼ活性を測定したところ、1.97 ± 0.41 U/mg(表4)が得られた。
表2:16S rRNA分析により同定された13種類のアミラーゼ陽性菌
| 単離菌 | Accession
no. a |
最も近い親戚b | アクセッション番号c | % Identityd | Origine | |||
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, China | |||
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.K | KM349197.K | KM349197.K | 99% | Biofilms, Argentina | |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.S | MG706137.S | Bacillus SAK4 | MG706138.1 | 100% | 韓国、土壌 |
| 1.4AL1 | MK578209 | Bacillus sp.CNJ732 PL04 | DQ448749.S | MK578209 Bacillus s. col.1 | 99% | Marine sediment, USA | ||
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.BMK229038.1 | 99% | Wheat grain, Isarael | |||
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.A KX431213.1 | 98% | Avian embryo, China | |||
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.A | HF584771.1 | 99% | Grapevine root system, Italy | ||
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.K | KY750685.1 | 98% | インドネシア、工業地帯の海水 | ||
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Papaya mealybug gut, India | |||
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | India | |||
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Wheat rhizospere, India | |||
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.K | MK088302.K | MK078217.K | 99% | Tea rhizosphere soil, India | |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.S | 99% | Marine sponge, South Africa |
aGenBankアクセッションNo. (http://www.ncbi.nlm.nih.gov/pubmed)
bBLAST検索で最も高い同一性%とMaxスコアを持つ近縁種
cGenBank Accession No.のNCBIサイト
d BLAST検索結果に基づいて、
近縁種と比べた株の同一性(%)。
eBLAST検索結果より、近縁種の由来を記載。
 |
図1: アミラーゼ陽性菌13株とBacillus属参照株2株の系統樹
Click to View figure |
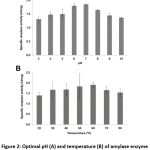 |
図2:Bacillus sp.3のアミラーゼ酵素活性の最適なpH(A)と温度(B)。5AL2
Click here to View figure |
Table 3.アミラーゼ酵素活性の最適pH(A)と温度(B)。 最適なアミラーゼ酵素誘導期間
|
分離菌 |
比例アミラーゼ 活性
(U/mg protein) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0.21 ± 0.04Ab | 0.40 ± 0.04Ca | 0.41 ± 0.04Ba |
| B.B. cereus 2.3AL8 | 0.45 ± 0.06Ab | 0.62 ± 0.04Ba | 0.65 ± 0.06Aa |
| Bacillus sp. 3.3AL80.05 ± 0.05Ab5AL2 | 0.32 ± 0.11Ab | 0.91 ± 0.12Aa | 0.86 ± 0.11Aa |
値は3連での平均±SDです。
大文字と小文字はそれぞれ列と行の統計的差異(p < 0.05)を示す。
表4:最適pHと温度における比アミラーゼ酵素活性
| 菌株 | 活性 (U/mg) | Optimal Temp. (℃) | 至適pH |
| Bacillus sp. 3.5AL2 | 1.97 ± 0.41 | 60 | 7.0 |
| 至適pH | 3.5AL2 |
Discussion
タイの税関(2017)のデータでは、タイは2016年に26億2500万バーツで他国から工業用酵素を輸入し、輸入率は年間9.40%増加した。 タイで最も広く使用されている酵素の1つであるアミラーゼは、衣料品、繊維、食品産業で応用されている。 しかし、商業的なアミラーゼの地元での生産が不足しているため、本研究では、地元の森林から工業用アミラーゼを生産する能力を持つ土壌細菌を分離することを目的とした。
デンプンに富む残滓は、アミラーゼ陽性細菌が分離できるより良い潜在的供給源となり得る16。 さらに、これらはキャッサバ農場、土壌、加工小麦粉工場などの場所から分離される可能性がある17。 本研究では13のアミラーゼ生産菌が分離され、Bacillus属とEnterobacter属と同定された。これは、Bacillus属がアミラーゼ生産菌として多く発見されている過去の報告18、19、20と同様である。
その結果、13株中最も比活性が高いBacillus sp. 3.5AL2 は37℃で2日間の培養で 0.91 ± 0.12 U/mg という最高の比活性を示すことが判明した。 アミラーゼ活性の至適pHと至適温度はそれぞれ7.0と60℃であった。 両最適条件とも、Bacillus sp. 3.5AL2由来の比アミラーゼ活性は1.97 ± 0.41 U/mgであった。 澱粉の液化などの工業的なプロセスでは、高温で働くことができる酵素が有利であると考えられていることが知られている21。 このように、Bacillus sp.3.5AL2由来のアミラーゼは、そのような産業での利用が期待されている。
同様に、Bacillus sp.GM890は60℃でアミラーゼの最適温度を示し20、Bacillus licheniformis AI20は60〜80℃の範囲で最高の活性を示し22、Bacillus sp.AL2も60℃でアミラーゼの最適温度は60℃であり、Bacillus licheniformis AI20は、60℃の範囲の中で最も高い活性を示すことが知られている。 WA21はアミラーゼの至適温度が55℃と低かった19。
ほとんどのデンプン分解菌は、正常な増殖と酵素活性のために6.0から7.0の間のpH範囲を明らかにした4。 同様に、Bacillus sp. 3.5AL2の至適pHは7.0であり、酸やアルカリの添加を必要としないことがわかった。 この結果は、ダール産業廃棄物から分離したBacillus sp.の至適温度60℃23や、B. amyloliquefaciensの至適pH7.024と同様であった。 しかし、Bacillus sp. WA21はアミラーゼの至適pHを6.0に示し、本研究で見出された値よりも低い19。
このような研究は、タイにおける商業的なアミラーゼ生産の出発点として非常に重要である。 しかし、アミラーゼ生産を費用対効果の高いものにするためには、さらなる研究調査が不可欠である。 酵素の特性評価、耐熱性、pH安定性、各種金属イオンの影響、各種基質、特にタイの農業廃棄物、その濃度などのさらなる決定が必要である。
上記のように必要なデータをすべて取得した後、タイの酵素産業における商業的アミラーゼの生産は、あらゆる地域で増加し普及すると考えられ、ひいてはアミラーゼ酵素を生産する自国の資源に依存することで国の経済に利益をもたらすと考えられる。
結論
これは、Nasinuan Community Forest, Maha Sarakhamの土壌から13種のアミラーゼ生産細菌分離を特定した最初の報告書である。 エンテロバクター属の1菌を除き、すべての菌がバチルス属と同定された。 これらの細菌はアミラーゼ生産に利用でき、将来的には農業、食品加工、繊維産業において地域的・全国的に応用が可能である。 したがって、他国からの工業用酵素の輸入コストを削減し、地元での酵素生産の持続性を提供し、国家の経済を向上させることができる。
謝辞
著者らは、SDに授与されたマハサラカム大学(助成年度2018)、およびVLに授与されたマハサラカム大学技術学部(助成年度2017)に感謝したい。
利益相反
著者は利益相反を宣言しない
- Pandey A. Glucoamylase Research: An overview. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A., and Osman G. Enzymatic properties of a novel thermmostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus isolate ANT-6. プロセスバイオケム. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., and Rai, V.A. Broader view.日本学術振興会特別研究員(PD)。 微生物酵素とその産業、医学、そしてそれ以外における関連性。 Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., and Chauhan B. Microbial α-amylases: a biotechnological perspective.「微生物酵素と産業・医療との関連性」. プロセスバイオケム。 38:1599-1616 (2003).
- Takasaki Y. circulans由来のマルトテトロースとマルトペントースから産生するアミラーゼ. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases.日本農芸化学会誌(1991).3(1991).12(1991).12(1993). Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol.5. Pp. 2197>
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable α-amylase producing strain. Appl Microbiol Biotechnol. このような背景のもと、日本農芸化学会は、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞、日本農芸化学会賞を受賞しました。 第一部:精製&加水分解特性. Starch. 43:319-323 (1991).
- Takasaki Y. 枯草菌由来のマルトトリオース生産アミラーゼ. アグリバイオ. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J., and Randall R.J. Protein measurement with the folin phenol reagents.「フォリンフェノール試薬によるタンパク質測定」. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W., and Lipman D.J. Basic local alignment search tool.
- Bhaskara R.K.V., Ashwini K., Gaurav K., and Karthik L. Optimization, production and partial purification of extracellular α-amylase from Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. セルラーゼ活性の測定. 純粋応用化学(Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., and Qadeer M.A. Bacillus licheniformis by an economical medium using α-amylase production of a Bacillus licheniformis. Biores Technol. 87:57-61 (2003).
- Mishra S., and Behera N. Amylase activity of starch degrading bacteria is isolated from soil receiving kitchen wastes.厨房廃棄物を受け入れた土壌から分離された澱粉分解菌のアミラーゼ活性. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., and Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from starchy soils.日本における澱粉質土壌からの澱粉質酵母の生産とその特性評価. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp.Brazil J Microbiol. 33:57-61 (2002).
- Asad W. 土着好熱菌による細胞外酵素の生産: Bacillus sp. WA21によるα-アミラーゼの部分精製と性状解析。 Pakistan J Botany. また、このような環境下での研究開発には、研究者、技術者、実務者、市民が一体となって取り組む必要があります。 Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., and Pandey A. Bacillus amyloliquefaciens for solid culturing of alpha amylase production. また、このような環境下において、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」を実現するためには、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」、「環境負荷の低減」を実現する必要があります。 J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., and Mulimani V.H. Isolation and identification of α-amylase producing Bacillus from Dhal
industry waste. インディアン・ジェイ・バイオケム・バイオフィジックス。 このような状況下において、「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」「震災を契機とした復興に向けた取り組み」の3つを柱とする「震災を契機とした復興に向けた取り組み」の3つを柱とする。 Ann Agri Sci. 60:193-202 (2015). - Tamura K., and Nei M. Estimation of Nucleotide substitutions in the control region of mitochondrial DNA in human and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(訪問回数 12,737 回、本日訪問 21 回)