はじめに
脳小血管障害(SVD)は血管性認知障害や認知症の最も多い原因である. 白質病変(WML)は、ラクナ梗塞、微小出血、脳萎縮とともに、脳画像上ではSVDの中核的なマーカーである。 これらの所見はすべて、臨床的および認知的転帰に影響を及ぼすことが示されています(Jokinenら、2011、2012;Mullerら、2011;Poelsら、2012)。 Leukoaraiosis and Disability (LADIS) 研究などでは、WMLが認知機能の低下、機能的能力の低下、うつ病、歩行・平衡障害と関連していることが示されている(LADIS Study Group, 2011)。
磁気共鳴画像(MRI)は、WML評価における標準法となっている。 近年,定量的な画像解析技術が大幅に向上したが,MRIの大きな障害の1つは,依然としてその有限な空間分解能であり,部分ボリューム効果につながる。 これはノイズや不均質性とともに、脳のセグメンテーション技術に困難をもたらす。 また、病変の範囲や重症度を判定するためには、健常組織と病変組織の境界を慎重に解析し、病変のセグメンテーションに暗黙の「判断閾値」を適用する必要があります。 さらに、MRIにおける高濃度画像は、疾患プロセスの最終段階を表すに過ぎないように思われる。 より広範囲な組織損傷が、ルーチンの MRI では見えない WML と関連している可能性がある(Schmidt et al.)
Most modern segmentation methods rely on prior information, such as average brain atlases (Smith et al., 2004; Ashburner and Friston, 2005; Goebel et al., 2006) or manual labeling (Wismüller et al., 2004; Lee et al., 2009; Cruz-Barbosa and Vellido, 2011)が挙げられる。 最近,自己教師付き機械学習アプローチにおいて,識別クラスタリング(DC)戦略に基づく,組織セグメンテーションのための新しいデータ駆動型手法が提案されている(Gonçalves et al.,2014)。 本手法は、事前情報の使用を最小限に抑え、マルチスペクトルMRIデータを利用する。 健康な組織(Pham and Prince, 1998; Van Leemput et al., 1999; Zhang et al., 2001; Manjón et al., 2010)や特定のタイプの病変(Van Leemput et al., 2001; Zijdenbos et al., 2002; Styner et al., 2008; Cruz-Barbosa and Vellido, 2011)のみを対象とする他の方法とは異なり、DCでは正常組織と異常組織を広く研究することが可能である。 提案手法のもう一つの大きな特徴は、WMLの進化を適切に特徴付けるために必要な、各ボクセルの組織確率を推定できることである。 ボクセルは、WMLの割合が小さい(まだはっきり見えないほど微弱)、中程度、高いに分類されます。
本研究の焦点は、軽度から中等度のWMLを持つ高齢者サンプルにおいて、病変の異なる段階が認知能力にどのように関連しているかを観察することである。 使用したデータは,3年間のフォローアップ期間中に収集したMRI測定と,その期間中に毎年実施した神経心理学的評価である。 特に、正常な脳組織に存在する初期の小さな部分的WML体積でさえ、従来評価されてきたWML負荷に加えて、将来の認知機能の低下を独自に予測することができるかどうかを明らかにすることに関心があった。
方法
被験者とデザイン
被験者は,機能的自立から障害への移行における加齢性WMLの影響を調べる欧州多施設研究であるLADIS研究の3施設(Amsterdam n = 21, Graz n = 18, Helsinki n = 39)からの参加者のサブグループ(n = 78)であった。 LADISのプロトコールと標本の特徴については、他で詳しく報告されている(Pantoni et al.) つまり、11施設で639人の被験者が以下の参加基準にしたがって登録された。 (a) 年齢65-84歳、(b) Fazekasスケール改訂版による軽度から重度のWML(Pantoni et al., 2005)、(c) Instrumental Activities of Daily Livingスケール(8項目中1項目以下の障害)(Lawton and Brody, 1969)がない、もしくは最小限の障害、(d) 定期的に連絡が取れる情報提供者の存在、である。 除外基準は以下の通りである。 (a) 追跡調査から脱落しやすい重篤な疾患(心不全,肝不全,腎不全,腫瘍性疾患,その他の関連する全身性疾患),(b) 重度の無関係な神経疾患または精神障害,(c) 血管以外の由来の白質脳症(免疫-脱髄,代謝,毒性,感染), (d) MRIスキャンができないか拒否している。
ベースライン評価では,脳MRIと徹底した医学的,機能的,神経心理学的評価が行われた。 被験者/施設間の有効な比較を可能にするため,各施設で得られたMRIシーケンスは同一でなければならず,各患者は大きなアーチファクトのない3つのシーケンスが利用可能であることが必要であった。 本研究に含まれる78名の被験者は,年齢,性別,ベースラインのMini-Mental State Examination(MMSE)スコア,WML体積においてLADISの全コホートと差がなかったが,学歴は有意に高かった(9.3年 vs 11.7年;t = -4.6, p < 0.001)<4396><9136>本研究はLADIS試験参加施設の倫理委員会によって承認されている(LADIS Study Group,2011)。 すべての被験者はインフォームド・コンセントを受け,署名した。 LADIS研究の協力者を付録IIに示す。
MRI Acquisition and Standard Volume Assessment
使用したすべての軸位MRIスキャンは,1.5mm厚で取得した。5T装置で、磁化移動画像(TE=10~14ms、TR=740~780ms)、T2強調高速スピンエコー画像(TE=100~120ms、TR=4000~6000ms)、流動的反転回復(FLAIR)画像(TE=100~140ms、TR=6000~10000ms、TI=2000~2400ms)など各センターで同一のプロトコルに従って行われた。 すべてのシーケンスは、ボクセルサイズ1×1×5-7.5 mm3、FOV=250、スライス間ギャップ0.5 mmであった。
Sparc5ワークステーション(SUN)を用いた半自動ボリューム解析(VFLAIR)により軸位FLAIR画像上の低中空領域を含む白質部位の高濃度範囲を評価した(van Straaten et al, 2006)。 病変はマークされ、局所閾値を用いて各スライスに境界が設定された(自作ソフト Show_Images、バージョン 3.6.1)。 皮質下と脳室周囲の高濃度の区別は行わなかった。 梗塞やラクーン周辺のT2強調画像の高輝度領域は無視された。 ラクーンの数は、血管周囲の腔や微小出血と区別するために、FLAIR、磁化準備高速取得勾配エコー、T2画像を組み合わせて、白質および灰白質深部に記録した(Gouwら、2008)。 さらに、脳萎縮は、皮質と皮質下の領域で別々にFLAIR画像上でテンプレートベースの評価尺度に従って評価された(Jokinen et al,
画像前処理
各ボクセルに含まれるマルチスペクトル情報が各被験者の全く同じ場所に由来することを保証するために、SPM5ツールボックス(Friston、2003)を使用して、利用できるすべてのシーケンスについて患者内レジストレーションを行い、テンプレートとして最低解像度画像(通常はFLAIR)を使用してアフィン変換を適用しました。 さらに、髄膜外組織ボクセルは、標準的な自動手法(BET2)(Smith et al.、2004)を用いてマスクアウトした。 特に、手作業によるセグメンテーションと比較すると、より頑健で、主観的でないことが特徴である。 本研究で使用された組織セグメンテーション手法は、DC戦略に根ざしたデータ駆動型の自己教師付き手法に基づく、そのような機械学習手法であった(Gonçalves et al.、2014)。 k-nearest neighborsなどの教師なしクラスタリングアルゴリズムと同様に、DCは多次元のグレーレベル分布情報に従って入力データをグループ化する。 本研究では、それらの分布は3次元であり、使用した配列の総数に相当する。 DCの大きな特徴は、クラスタリングの割り当てをサポートするために、少ないラベル付き情報のセットを使用することができることである。 この特徴により、従来のクラスタリング技術を超える、セグメンテーション結果の明確な改善がもたらされる(Gonçalves et al. より詳細な説明は付録Ⅰに、完全な数学的説明はGonçalves et al. 本研究では病変のあるボクセルに焦点を当てることを意図しているため,病変組織の存在割合が関連するもののみを解析した。
本研究では,3種類の病変カテゴリーが特定されたため,それに応じた体積推定が行われた。 VDC100とVDC66は、その中のボクセルの主要な組織が、それぞれ>66%と<66%の病変である確率を持つボリュームである。 ボリュームVDC100とVDC66は共に病変組織の大部分を含むので、VFLAIR1はその和で近似できる。 VFLAIR≈VDCARD2 ≥ VDC100 + VDC66。 したがって、DCを用いると、VDCHARDによって可視病変の体積を最もよく推定することができる。 最後のカテゴリーであるVDC33は、病変が2番目に可能性の高い組織タイプであるボクセルの体積に相当し、その確率は≧33%である。 この体積は、VFLAIRを推定するような通常のセグメンテーション法では病変とみなされないことに注意すべきである。 付録I)。 LADIS研究の認知テストバッテリーにはMMSE(Folsteinら、1975)、Vascular Dementia Assessment Scale-Cognitive Subscale(VADAS)(Ferris、2003)、Stroopテスト(MacLeod、1991)、Trail makingテスト(Reitan、1958)などが含まれていた。 本目的では、MMSEとVADASの総得点を認知機能のグローバル尺度として用いた。 また、特定の認知領域の評価のために、心理測定学的に頑健な3つの複合指標を、前述のように個々の下位テストの平均標準スコアを用いて構成した(Moleiro et al.、2013)。 (1) 速度と運動制御=zスコア(Trail making A+迷路+桁消し)/3、(2) 実行機能=zスコア/4、(3) 記憶=zスコア(即時単語再生+遅延再生+単語認識+桁ずれ)/4<4396><9136>神経心理テスト変数の欠損値の比率はベースラインで0〜6.4%、最終フォローアップ評価で24.4〜32.1%と変動している。 このデータ欠損は,被験者の死亡(n=2),フォローアップ神経心理学的評価(最終年訪問,n=17)からの脱落,またはテストバッテリー全体を完了できなかったこと(n=6)が原因である。
統計解析
経時的認知パフォーマンスの予測因子は,欠損値および複雑な共分散構造を扱える線形混合モデル(限定最尤推定)で解析を行った。 評価年(ベースライン,1年目,2年目,3年目)を被験者内変数とし,非構造化共分散構造を採用した。 従属変数として認知テスト得点を設定した。 部分病変体積(VDC33、VDC66、VDC100)は、1つずつ予測因子として検定された。 すべてのモデルで、年齢、性別、教育年数を共変量として用いた。 VFLAIRを共変量として追加してモデルを繰り返し、従来評価されていたWML容積に加え、部分的な容積測定による予測値を調べた。 同様に、研究施設も潜在的な交絡因子として加えたが、結果に本質的な影響を与えなかったため、最終的な解析からは除外した。 歪んだ分布は混合モデルの線形性の仮定を損なう可能性があるため、3つの部分容積測定とVFLAIRのすべてに対数変換が適用された。 結果はIBM SPSS Statistics 22 mixed moduleで解析した。 4396>
Results
Characteristics of the Subjects
The characteristics of the subjects at baseline are given in Table 1.は、すべての分析についてp < 0.05で統計的有意性を設定した。 改訂版Fazekasスケールでは,28名(35.9%)が軽度,26名(33.3%)が中等度,24名(30.8%)が重度のWMLであった。

Table 1.
Partial WML Volumes and other MRI Findings
Table 1に従来のセグメンテーション法で得られたボリューム、DCで推定した部分病変ボリューム、両セグメンテーション法のDice similarity coefficientの比較結果を示した。 図1は、オリジナルのFLAIR画像(1A)、従来推定された高濃度ボリュームであるVFLAIR(1B)、および部分WMLボリュームVDC100(1C)、VDC66(1D)、VDC33(1E)について得られた結果を比較したものである。 フレーム1F-1Jはフレーム1Aの白い矩形で示された拡大領域における対応する画像である。 中央の完全な吹き出しから、中間段階、端の病変の割合が少ない段階まで、病変の病巣の周りの進化をフレーム1H-Jで見ることができる。 なお、VDC33と分類されたボクセルはVFLAIRには含まれないが、将来病変が発生する可能性のある場所を示している。 図2は、より高次の半月状遠心における同様の所見である。 DCセグメンテーションの手順では、3つの異なるシーケンス(FLAIR、T2、T1)が使用されました。 ここでは、説明のためにFLAIRのみを示す。
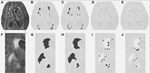
FIGURE 1. 中高層の白質病変(WML)。 (A)ある被験者のFLAIR画像。 (B)従来推定されたWML。 (C-E)提案するセグメンテーションアルゴリズムを用いて、病変の完全、中間、小さな割合で推定されたWML。 (F-J) (A)の白枠で示した拡大部分についての類似画像。 半月状中枢の白質病変(WML)。 (A)ある被験者のFLAIR画像。 (B)従来推定されたWML。 (C-E)提案するセグメンテーションアルゴリズムを用いて推定されたWML。 (F-J) (A)の白枠で示した拡大部分の類似画像。
使用したデータセット全体において、3つの部分WMLボリューム測定は互いに有意な相関があった。 VDC33*VDC66 r = 0.87; VDC33*VDC100 r = 0.47; VDC66*VDC100 r = 0.47 (p < 0.001). また、VFLAIRとも有意な相関があり、それぞれVDC33 r = 0.26 (p = 0.024), VDC66 r = 0.26 (p = 0.023), VDC100 r = 0.87 (p < 0.001) であった。 しかし、これらの指標は、ラクナ梗塞の有無(なし/少ない/多い)やグローバルな脳萎縮スコア(皮質および皮質下)とは有意に関連しなかった(p > 0.05)。
図3は、図1の被験者の従来のセグメンテーション(VFLAIR)とDC(VDCHARD)間で共有および不一致のセグメントを識別します。 緑色の画素が多いことから、2つのセグメンテーションは明らかに重なっていることがわかる。 その図の被写体では、VFLAIRとVDCHARDの差が小さい。
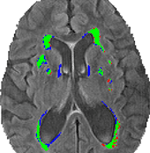
Figure 3.VFLAIRとVDCHARDの差の例 セグメンテーション手法の比較。 この画像は、図1の被験者に対して、半自動体積分析(VFLAIR)と識別クラスタリング(VDCHARD)を用いて得られたセグメンテーションを示すものである。 緑色で描かれた領域は、両手法で重複するセグメンテーションに相当する。 赤は従来手法で病変のみと判定された領域、青はDCで病変のみと判定されたボクセルに対応する。
1人の被験者の組織全体の分類を推定するには、インテル® Core™ i5-4590 CPU@ 3.30 GHzと16 GB RAM搭載のPCでDCを用いて約25分かかった。 また、ラベルの推定には、約70分かかりました。 4396>
Partial WML Volumes as Predictors of Cognitive Performance
部分WMLボリュームと縦断的認知能力の関係は表2にまとめられている。 年齢,性別,学歴で調整した線形混合モデルでは,VDC33と実行機能の複合スコアとの間に有意な負の相関が認められた。 まず、VDC33は実行機能の総合レベル(4つの時間的評価すべてにわたる平均のスコア)に対する有意な主効果と関連していた。 次に、VDC33と時間(評価年)の交互作用は、3年間の追跡調査における実行能力の変化に対するVDC33の有意な予測価値を示した。 具体的には、VDC33の負荷が高いほど、ベースライン時のパフォーマンスが低く、その後の各評価年における実行機能の低下が急であることと関連していた。 VFLAIRを追加調整した後も、これらの結果は変わらなかった。 さらに,VDC33とVADAS総スコアとの間にはベースラインで弱い関連があったが,この結果はVFLAIRを調整するともはや有意ではなかった。VDC33はMMSE,VADAS,処理速度,記憶機能において有意な主効果や時間との交互作用を示さなかった。 VADASと実行機能において,部分白質病変の体積と3年間の追跡調査における認知能力の関係
VDC66は,より全体的に低いレベルのパフォーマンスを示す有意な主効果に関連していた。 VDC66と時間の交互作用は,処理速度でのみ有意であった。 個々の時点における結果を検証すると,ベースライン(VADAS,実行機能)において有意な相関があり,フォローアップ1年目(VADAS,実行機能),2年目(MMSE,実行機能),3年目(実行機能)において経時的変化も認められた。 VFLAIRのコントロールはこれらの結果にほとんど影響を与えなかった(表2)。
最後に、VDC100はすべての神経心理学的スコアにおいて有意な主効果と関連していた。 VDC100*時間の相互作用は,5つの認知指標のうち4つにおいて,追跡調査中の変化と有意な関係を示した。 現段階では,病変はベースライン時の認知能力に系統的に関連していた。 さらに、初回から最終回までの追跡調査において、認知機能の急降下が明らかになったが、認知機能の指標によって多少のばらつきがあった。 VFLAIRはVDC100と高い相関を示したが,これらの結果の多くはVFLAIRを追加でコントロールした後でも残存した(表2)。
VDC33とVDC66にもかかわらず,VFLAIRはVADASと実行機能において追跡期間中の全体的なパフォーマンスの有意な予測因子として残存した。 しかし,VFLAIRはどの認知指標においてもVDC100を上回る独立した予測値を示さなかった。
考察
本研究では,正常と思われる白質における最も淡い変化から完全に進行した病変まで,部分的なWMLの縦断的認知影響について調べた。 調査はDCに基づく新しい自己教師付きマルチスペクトルMRI組織セグメンテーション法(Gonçalvesら,2014)を用い,毎年3年間のフォローアップで神経心理学的評価を繰り返した。 利用可能なすべてのMRIシーケンスを同時に利用して、異なる組織タイプを同定した。 WMLはその後、部分体積に従って小病変、中間病変、完全病変に分類された。
暗黙のグレーレベル閾値に基づいて判断する従来の手動組織分割とは異なり、提案方法は病変に関する「閾値以下」の情報へのアクセスを提供する。 これにより、サブボクセルボリューム(定量的情報)と同様に、病変の進行度(定性的情報)をより適切に評価することができる。 組織の割合に関する情報を提供する他の方法も存在する(Van Leemputら、2003;Manjónら、2010)。
本研究の主な知見は,最小の部分WML体積であるVDC33でも,ベースラインで既に実行能力の低下と有意に関連し,3年間のフォローアップで将来の実行機能の低下を予測することであった。 この効果は、人口統計学的因子や、特に、従来から評価されているFLAIR画像上の高輝度体積とは無関係であった。 さらに,被験者のサブグループにおいて,VDC33は正常な白質における最も初期の変化である可能性が高く,ベースライン時のその検出は,追跡調査後に完全に発達した病変の将来の位置を示していた(付録Ⅰ)。 さらに,本格的な病変であるVDC100は,ベースライン時とフォローアップ時の両方で,評価したすべての認知領域に広がる,より顕著な影響と関連していた。 VDC100が認知機能低下の強い予測因子であることは驚くにあたらない。 VDC100は,以前に認知変化との強い関連を示したVFLAIRと高い相関があったため(Jokinenら,2011;Kooistraら,2014),むしろ同様の予測力を保持すると考えられる。
本研究の新規かつ最も重要な成果は,判定閾値以下で検出された病変の体積が,特定の認知スコアをすでに予測できることである。 認知機能低下の最も早い兆候は、特に実行機能において見出された。実行機能は、本質的に白質の前頭前野-皮質下結合の完全性に依存していると想定される(O’sullivan et al. これらの機能は、日常生活における個人の機能的能力に極めて重要である(Tomaszewski Fariasら、2009)。
この論文で示された結果は、WML高濃度化は「氷山の一角」に過ぎず、実際にはSVDにおける白質障害は、脳のより広い領域に影響しながら徐々に進展するという仮説を支持している(Schmitら、2011;Maillardら、2013)。 拡散画像研究により、正常と思われる脳組織においても微細構造の微妙な変化が認知障害に関連し、追跡調査における認知および臨床転帰の不良を予測することが示されています(Schmidtら、2010; Jokinenら、2013)。 分数異方性で示されるように、微細構造の完全性はWMLの近傍で特に低下する(Maillardら、2011年)。 この「WMH penumbra」と呼ばれる現象は、本研究で観察された早期の部分WML量に関連している可能性がある。 しかし、初期の病変の発生は、付録Iに詳細に示されているように、完全に発達したWMLからある程度離れた場所でも発生する可能性がある。 このようなサブリミナルな局所変化と認知的転帰との関係は,我々の知る限り,これまで示されていない。
今回のサンプルは,軽度から重度までのすべてのWML重症度に等しく層別した高齢者の混合グループから構成されている。 参加者は、臨床現場で遭遇するWML患者の多様性を代表するように、様々な紹介理由に基づいて、異なる環境で募集された(LADIS Study Group, 2011)。 しかし、このような被験者の異質性により、画像所見と認知機能の低下との間の最も微妙な影響が不明瞭になる可能性がある。 加齢や脳血管疾患に関する縦断的な研究では、被験者がフォローアップから脱落したり、すべての評価を完了できなかったりするため、一部のデータが失われることが一般的である
制限として、LADIS画像プロトコルは当初、現在の定量的セグメンテーション法用に設計されていなかったため、オリジナルの画像データの一部しか利用することができなかった。 さらに、画像ノイズ、解像度、ムーブメントアーチファクトは、今回紹介したような多施設共同研究の結果に影響を与える可能性のあるすべての要因である。 これは、特にPartial Volume Effectを扱う場合に当てはまる。 これらの限界にもかかわらず、また前述の交絡因子のいくつかを補正した後、我々は、病変である確率が小さいボクセルに基づいて、病変進行の微妙な兆候を検出することができた
この原稿で示した結果の信頼性を高めるために、より大きなコホートが検討されたかもしれない。
本研究の強みは,従来のMRI評価が有用でない極めて早期の段階で,組織型の同定や脳の病理学的変化の定量化を可能にする,新規で頑健,自己教師付き,データ駆動型の画像解析手法であること,である。 本研究では,3年間のフォローアップで1年ごとに実施した詳細な神経心理学的評価も有益であった。
結論として,正常に見える白質における初期の変化は,すでに進行性の悪化と悪い認知予後の手がかりを与えている。 この段階では,主に実行機能が影響を受けるが,変化が徐々に本格的なWMLに発展し,最終的には従来のMRIの組織分割でも検出できるようになると,認知に対する有害な影響はよりグローバルになる。 これらの結果は、提案したマルチスペクトルMRI組織分割法が、SVDのリスクと臨床的に重要な進行性認知機能低下の認識において付加的な価値を持つ有望なツールであることを確認した。 それに加えて、本研究における各著者の最も中心的な仕事は以下の通りである。 HJ;研究責任者、corresponding author、研究のデザインと概念化、神経心理学的および臨床的データの取得、統計解析、解釈、原稿の起草と仕上げ。 研究責任者、研究計画、MRI セグメンテーション法の開発、MRI データ解析、原稿作成、仕上 げ。 RV:MRIセグメンテーション法の開発、MRIデータ解析、研究のデザイン、コンセプト立案。 JL:統計解析と解釈の専門家。 FF;LADIS試験のデザイン、MRI法の責任者。 RS:LADIS 試験のデザイン、MRI 法の担当。 FB:LADIS試験のデザイン、MRI法の責任者。 SM:神経心理学的テストバッテリーの構築、神経心理学的および臨床的データの取得。 AV:神経心理学的・臨床的データ取得。 DI:研究コーディネーター、LADIS運営委員会メンバー、LADIS研究のデザイン。 LP;LADIS試験のコーディネートとデザイン。 TE;LADIS運営委員会メンバー、LADIS試験のデザイン、試験のコンセプト立案、デザイン。
利益相反声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で行われたことを宣言する。
謝辞
Leukoaraiosisと障害研究は欧州連合(QLRT-2000-00446助成)の支援を受けて実施されました。 HJの研究は,ヘルシンキ大学中央病院の臨床研究所と医学研究基金,Ella and Georg Ehrnrooth財団からの助成を受けた。 NGはFundação para a Ciência e Tecnologiaの助成金番号SFRH/BD/36178/2007の助成を受けた。
補足資料
この論文の補足資料はオンラインで見ることができる。 https://www.frontiersin.org/article/10.3389/fnins.2015.00455
略語
DC, discriminative clustering; FLAIR, fluid-attenuated inversion recovery; LADIS, Leukoaraiosis and Disability Study; MMSE, Mini-Mental State Examination; MRI, magnetic resonance imaging; SVD, small vessel disease; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale.詳細は以下をご参照ください。 VDC33:病変の小さな割合を含むボクセルの体積、VDC66:病変の中間の割合を含むボクセルの体積、VDC100:病変の完全な割合を含むボクセルの体積、VDCHARD=VDC100+VDC66;VFLAIR:FLAIR画像上で従来の半自動解析で測定したWML体積、WML:白質病変<4396> <8970>脚注<9081> <2771> <9034>1.病変がある場合。 VFLAIR、FLAIR画像の従来の半自動解析で測定したWMLの体積
2. ^VDCHARD、組織の大部分が病変であるボクセルに対応する体積.
Ashburner, J., and Friston, K. J. (2005). 統一セグメンテーション。 Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., and Vellido, A. (2011)(2011). マニホールド学習モデルを用いた、部分的にラベル付けされたMRS情報からのヒト脳腫瘍の半教師付き分析。 Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). 認知の一般的な測定法。 Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E. and McHugh, P. R. (1975). ミニ・メンタル・ステート:臨床家のための患者の認知状態を評定する実用的な方法。 J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K.(2003). 「統計的パラメータマッピング。実用的なガイド」、神経科学データベース、R. Kötter編(ニューヨーク、ニューヨーク:シュプリンガー)、237-250。 オンラインで利用可能。 http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., and Formisano, E. (2006). brainvoyager QXによる機能画像解析コンテストデータの解析:単一被験者から皮質配列グループ一般線形モデル解析と自己組織化グループ独立成分解析まで。 Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., and Vigário, R. (2014). Discriminative clusteringによる自己教師付きMRI組織セグメンテーション。 Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A.、他 (2008).All. 白質高濃度化の進行と3年間の新しいラクーンの発生率:Leukoaraiosis and Disability study. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A.A. , Madureira, S., Ylikoski, R., van Straaten, E. C. , van der Flier, W. M. , et al. ラクーンの発生は認知機能の低下に影響する:LADIS研究。 Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F. , Gouw, A.A. , van der Flier, W.M. , et al. (2012). 脳小血管疾患における脳萎縮は認知機能低下を加速する:LADIS研究。 Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F.、他 (2013).The Brain atrophy accelerated cognitive decline: LADIS study. 拡散の変化は、認知的および機能的転帰を予測する:LADIS研究。 Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract |Ref Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L.J., et al. (2014). 血管性脳病変、脳萎縮、認知機能低下.the second manifestations of arterial disease-magnetic resonance (SMART-MR) study. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS研究会 (2011). 2001-2011: LADIS (Leukoaraiosis And DISability) studyの10年:白質変化と小血管疾患について何がわかったか? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., and Brody, E. M. (1969). 高齢者の評価:日常生活の自己維持活動と手段的活動。 Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C.、他 (2009). パワー変換アプローチによるMR画像セグメンテーション。 IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M.(1991).P.E. M.. ストループ効果に関する半世紀にわたる研究:統合的レビュー。 Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D.他 (2013).ストループ効果の研究の半世紀。 FLAIRと拡散MRIの信号は、白質高濃度化の独立した予測因子である。 Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D. , Carmichael, O., Reed, B. , Mungas, D.、その他(2011).MAILLARD、P.、Fletcher、E. 白質高強度ペナンブラ。 Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., and Robles, M. (2010). 空間的文脈を用いたノイズの多い脳MRIからの部分体積係数の推定値の改善。 Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H.、他 (2013). LADIS研究の神経心理学的評価バッテリーの確証的因子分析:縦断的分析。 J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., and Geerlings, M.I. (2011). 脳萎縮と認知:脳血管病態との相互作用? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G. , Williams, S. C. , and Markus, H. S. (2001). 加齢に伴う認知機能低下のメカニズムとして、皮質の「断絶」を証明する。 Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H.他 (2005).Hope. 加齢に伴う脳白質変化が障害への移行に与える影響-LADIS研究:理論的根拠、デザイン、方法論。 Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., and Prince, J. L. (1998). このような場合、「曖昧模糊」(fuzzy C-means)アルゴリズムが有効である。 Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., and al (2012). 脳微小出血は認知機能の低下と関連する:ロッテルダム・スキャン研究。 Neurology 78, 326-333. doi: 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M.(1958). 脳の器質的損傷の指標としてのtrail making testの妥当性。 Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S. , Verdelho, A., Petrovic, K. , etc. (2010). Diffusion-weighted imaging and cognition in the leukoariosis and disability in the elderly study(高齢者の白内障と障害に関する研究における拡散強調画像と認知)。 Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M.他 (2011)。 加齢に伴う白質変化における不均一性。 Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H.、他 (2004). MRの機能・構造画像解析とFSLとしての実装の進歩. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M.S. , Commowick, O., Tran, H. , et al. “3D segmentation in the clinic: a grand challenge II: MS lesion segmentation,” MIDAS Journal, MICCAI 2008 Workshop. オンラインで利用可能です。 http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H.他 (2009). 高齢者における記憶と実行機能の縦断的変化は、手段的日常生活動作の縦断的変化と関連している。 Clin. Neuropsychol. 23, 446-461. doi: 10.1080/138540802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (1999). 脳のMR画像の自動的なモデルベースの組織分類。 IEEE Trans. Med. Doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A. and Suetens, P. (2001)(2011). モデル異常値検出による多発性硬化症病変の自動的セグメンテーション。 IEEE Trans. Med. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). このように、脳MR画像の部分ボリュームセグメンテーションのための統一的なフレームワーク。 IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L.、et al. (2006). 白質高濃度スコアリング法が臨床データとの相関に与える影響:LADIS研究。 Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., and Ritter, H. (2004). 自己組織化モデル適応による全自動バイオメディカル画像セグメンテーション. このような場合、「閾値」を設定することで、「閾値」を設定することができる。 IEEE Trans. Med. Doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002)(2012. 臨床試験のための3次元MRIデータの自動パイプライン解析:多発性硬化症への適用。 IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar