Introduction
神経変性疾患は、世界的にアンメットメディカルニーズが大きく、新しい疾患修飾治療の開発が必要とされています。 このような疾患は罹患しやすく、また多くの診断検査が高価であることから、神経変性過程の進行を薬剤開発に適した時間枠で追跡できる、広く入手可能で信頼性が高く、安価なバイオマーカーの必要性は大きい。 このような状況において、脳波は顕著な可能性を秘めていると考えられる。 脳波は既知の生活習慣や薬剤の影響を受けやすいが、多くの利点がある。 EEGはシナプス活動を反映し、これは神経変性過程の機能的影響の共通項である。 EEGは非侵襲的で、携帯可能で、安全かつ安価な技術であり、広く受け入れられており、比較的短い収集時間で済む。 定性的なEEGは、臨床の場でてんかんの診断に日常的に利用されている。 最近では、注意欠陥・多動性障害(ADHD)の評価のために、定量的EEGバイオマーカー(qEEG)と臨床医の評価の統合が提案され、ADHDの臨床評価をサポートするためにFDA(食品医薬品局)のクラスII指定を受けている(Lenartowicz and Loo, 2014; Snyder et al. しかし、近年のデータ解析、解釈、空間分解能の向上により、神経変性疾患進行の信頼性の高い正確なバイオマーカーとしてのEEGの可能性が高まっています。 多くの観察型安静時脳波解析が報告されており、アルツハイマー病で発生する神経変性の神経シグネチャーを検出するためのバイオマーカーとしての潜在的価値が裏付けられています(Babiloni et al, 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016)、パーキンソン病(Saranthein and Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waningerら、2015; Kroupiら、2017)および前頭側頭型認知症(Pijnenburgら、2008; Nishidaら、2011; Casoら、2012; Goossensら、2016)。
長年にわたり、EEGハードウェア技術も進化して、従来の煩雑なシステムよりもシンプルで便利かつ快適に設計されて高品質のEEGおよび生理信号を提供するいくつかの無線マルチチャンネル・システムが出てきた。 従来のEEGシステムは、長時間の組み立てと装着を必要とし、通常、患者の頭皮の擦過傷が必要であった。 このような装着時間の長さと不快感から、従来のシステムは、長時間の臨床手順への協力が困難なことが多い認知症患者への使用が困難であった。 しかし、現在販売されているいくつかの無線システムは、20分以内に装着でき、装着時の不快感もなく、快適な装着感で画像取得を行うことができます。 信号検出や定量分析技術の進歩と相まって、ワイヤレスシステムは、顕著な行動や性格の変化を特徴とする行動変容型前頭側頭型認知症など、潜在的に困難な認知症患者の臨床評価を比較的迅速かつ許容できる理想的な候補となる。 このようなシステムは、限られた範囲ではあるが、特定の臨床研究において使用される可能性も考えられる。 しかし、このような民生用システムの臨床試験研究への応用はあまり検討されておらず、これらのシステムの繰り返し測定の精度や信頼性は十分に確立されていない。 さらに、神経変性疾患に罹患した患者の神経シグネチャを評価するために、限られたチャンネルの取得が十分なデータと解剖学的範囲を提供できるかどうかは明らかではありません。
本研究は、民生用EEGシステムの臨床試験における可能性の初期評価を目的としており、2つの医療グレードのマルチチャンネル無線EEGシステム、B-Alert X24およびEnobio 20と、2つの民生用の限定チャンネルシステム、MuseおよびMindwaveの使いやすさ、精度および信頼性を比較した。
材料と方法
参加者
研究対象者には、研究への参加資格を満たした5人の健康な参加者が含まれている(表1)。 病歴、併用薬、生活習慣(アルコール、カフェイン摂取、喫煙状況)を確認した結果、健康でないと判断された被験者は除外された。 具体的には、てんかん、その他の睡眠障害、神経障害、精神障害の既往がある場合、薬を服用している場合、喫煙やかなりのアルコール・カフェイン摂取など、脳波信号に影響を与えることが知られている生活習慣がある場合、研究対象から除外した

Table 1. 研究集団の人口統計学とベースライン特性。
チェサピーク施設審査委員会が要求するヒトを対象とした実験的調査のガイドラインに従って、すべての研究参加者から書面によるインフォームドコンセントを取得した。
研究手順、EEGデータ収集、および分析
栄養摂取と概日リズムの変化に関連する潜在的なEEG信号の変動を避けるため、すべての訪問は、Advanced Brain Monitoring(ABM)研究所の研究施設において、標準の低炭水化物、高蛋白質の朝食(食後の眠気を最小限に抑えるため)後の午前に実施されました。 さらに、参加者は、研究訪問の前夜はアルコール飲料を避け、訪問の朝は絶食し、カフェインを避けるように要請された。
脳波データは、2つのマルチチャンネル(20チャンネル)医療用EEGシステム、B-Alert(Advanced Brain Monitoring、ABM)とEnobio(Neuroelectrics)(図1、表2)と2つの限定チャンネル消費者用システム、Muse(Interaxon、2チャンネル)とMindwave(Neurosky、1チャンネル)(図1、表2)から以下の順序で1週間の間を置いて、別々の訪問時に取得されました。 Muse、Mindwave、B-Alert、Enobioの順である。 B-Alert X24 EEG SystemとEnobioは、いずれもCE医療認証を受けた20チャンネルのワイヤレスシステムで、国際標準の10-20モンタージュに適用され、256HzのサンプリングレートでEEG信号を取得する。 さらに、B-Alertは医療機器としてFDAの認可を受けている。
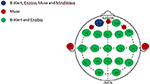
Figure 1. 多チャンネルおよび限定チャンネル脳波システムの解剖学的チャンネル分布。 評価した4つのEEGシステム間で共有されるチャンネルと固有のチャンネルを表す。 4つのEEGシステムに共通するチャンネル、Fp1(青);Museシステムに固有のチャンネル(赤);マルチチャンネルシステム、B-AlertおよびEnobioに共通するチャンネル(緑)

Table 2. EEGシステムの比較。
B-Alertは乳腺を参照チャンネルとして使用する。 Enobioは乳様突起、耳クリップ、または他の頭皮の場所を使用して参照することができます。 Mindwaveも耳介にリファレンスがあり、Museは額に3つのリファレンスチャンネルがある。 すべてのシステムには信号品質チェックが含まれていますが、医療用EEGシステムとは対照的に、消費者向けシステムはいずれも乾燥電極を使用しており、インピーダンスチェックはありません。
4つのシステムすべてがFP1チャネルのみを共有しているため(図1)、本研究で評価した4つのEEGシステム間のEEGパターン(生および汚染除去)、パワースペクトル密度(PSD)、テスト/レテスト信頼性の比較は、EOおよびEC条件の両方でFp1電極に焦点を当てて実施された。 休憩中や指示中に記録された脳波データは、解析前に破棄された。 各1秒間のエポックにおける脳波のパワースペクトル密度は、Welchの修正ピリオドグラム法を用いて、1秒長のハミング窓のテーパリングを用いて計算した。 PSDは、目を開けているときと閉じているときの安静時脳波で計算した。 単位(μV)が等しくなるように、1.25(Muse)、0.25(MindWave)、または1,000(Enobio 20)の補正係数が適用された。 すべてのFp1チャンネルPSDデータは、各訪問の5人の被験者について平均化された。 1005>
Results
Participants
参加者は全員平均年齢27歳の健康なボランティアで、全員右利きで非喫煙者、男性が多い(60%)。 1005>
Resting State EEG
EEG データは、テストした 4 つのシステムすべてから正常に収集されました。 予想通り、乾燥電極と限られたチャンネル数のため、消費者用EEGシステムではセットアップ時間がかなり短縮されました。
EO(図2)およびEC(図3)状態での生のEEGデータのパターンを各システムから収集し、評価した結果、4つのシステム間で被験者の耐性と受容性に差は認められませんでした。 MuseとMindwaveは、開眼に伴う目の瞬きや前頭部の筋肉の動きによるアーチファクトが起こりやすかった(図2)。
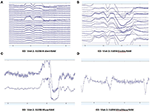
Figure 2. B-Alert(A)とEnobio(B)Muse(C)とMindWave(D)のEO生データの抽出は、同じ参加者の同じ訪問中に行われた。 1005>
Fp1チャンネルパワースペクトル密度(PSD)の比較
訪問1と訪問2の4つのEEGシステムすべてに共通するFp1チャンネルの平均PSDを計算し、EO(図4A、B)とEC(図4C、D)の両条件についてプロットした。 EO条件では、B-alertとEnobioのスペクトルはほぼ等しく、Mindwaveはわずかに増加したが、同様のカーブを描いていた。 Museシステムで取得したPSDでは、広帯域の出力増加が観察された。 同様に、EC条件(図4C、D)では、B-Alert、Enobio、MindwaveのPSDはほぼ同じだったが、Museのスペクトルでは広帯域のパワー増加が観察され、他のシステムよりも変動が大きいようであった。 B-Alert、Enobio、Mindwaveの各システムで取得したスペクトルでは、8-12 Hzのピーク(アルファ帯)が確認されました。 1005>
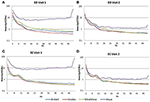
Figure 4.アルファ帯のピークは、Museのパワースペクトルで訪問2日に明確に見られたが、訪問1のスペクトルでは観察されなかった。 1005>
Fp1 Channel Resting EEG Test/Retest Comparison
EC条件では、B-Alert、Enobio、Mindwaveでパワースペクトル比は0.975から1.025の間であった(図5A)。 MuseのPSD比は1.125~1.225と他の3システムよりばらつきが大きい。 EO条件では、Enobioは遅い波のDelta(1-3Hz)、Theta(3-7Hz)、Slow Alpha(8-10)、B-AlertとMindwaveは速い波のBeta(13-30Hz)とGamma(25-40Hz)で若干変動があるように見えた。 しかし、比率は依然として0.975から1.05の間であった。 EC条件と同様に、Museのテスト/リテストも変動が大きく、比率は最大1.2であった(図5B)
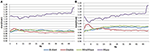
Figure 5. EC(A)とEO(B)条件でのテスト・リテスト比。
考察
本研究では、臨床研究および臨床試験への応用の可能性を評価するために、医療用および民生用EEGシステムの定量脳波信号とテスト・リテスト信頼性を比較検討した。 新たに普及した民生用EEGシステムを評価した理由は、低コスト、幅広いアクセス性、困難な集団におけるホームベースの研究への可能性であった。 消費者用EEGシステムの一般的な応用例としては、瞑想やリラクゼーション・トレーニング、不安や痛みへの対処などが挙げられる。 最近の研究では、ゲーム以外の用途も模索されている。 NeuroSkyは、ステージ1の睡眠の開始を検出できることが示され(Van Halら、2014)、ブレイン・コンピュータ・インターフェイス内で消費者脳波を評価することにも関心が寄せられている(Bialas and Milanowski, 2014; Kimら, 2015; Taherianら, 2017)。 また、よりシンプルなEEGシステム(例えば6チャンネル)の救急現場への応用も検討されている(Jakab et al.、2014)。 より複雑なヘッドセットを利用するものの、先行する評価では、Emotiv EPOC 16電極キャップのような市販のマルチリード消費者EEGシステムも臨床状態の評価において価値がある可能性が示された(Schiffら、2016)
この研究は、かなり質の高いEEGデータが消費者EEGからうまく収集できる証拠を提供した。 しかし、8-13 Hzで観察されるアルファピークのパワー増加、テスト再試行、形状に区別があった。 Mindwaveは、全体的に医療用システムと同様のFp1パワースペクトルを示し、B-AlertとEnobioよりもわずかに広帯域の増加を示した。 1005>
消費者向けEEGシステムは、より便利で迅速なセットアップを示し、娯楽や自己啓発の用途に最適であることがわかった。 しかし、そのデータ品質は、ドライ電極に関連するアーチファクト感受性の影響を全体的に受けていた。 特に、EO時のデータ品質が低下することが予想されました。 インピーダンス検査ができないことと、前頭部という特にまばたきや開眼に伴う筋肉の動きが起こりやすい部位に適用したことも、この相対的なアーチファクトにつながったと思われます。 さらに、民生用EEGシステムによる評価は、その性質上、少数のチャンネルがカバーする解剖学的脳領域のみに限定されるため、マルチネットワーク評価を行うことができないのである。
乾燥した電極は、時間とともに不快感をもたらしやすく、額への取り付けミスのリスクが高いため、不正確な信号の取得やテスト/再試験につながる可能性もあります。 医療グレードの機器と比較すると、民生用EEGシステムではテスト/リテストの信頼性が低いことがわかりました。 信頼性は、すべてのシステムでテスト・リトライの取得で測定された(図5)。 B-Alert、Enobio、Mindwaveはそれなりの結果を示したが、Museは比較的低い信頼性であった。 さらに、MuseではVisit 2で明確なαピークが示されたが(図4)、Visit 1でαピークがなかったことから、アーチファクトによる一貫性の欠如が示唆された。 臨床試験において、疾患進行のモニタリングや実験的治療法の有効性を評価する際には、一貫した信頼性の高い脳活動の測定が不可欠である。 1005>
最終的に、実験条件下での医療用と消費者用のEEGシステムの比較は、性能における差異、特に、研究および臨床試験の設定における消費者システムのアプリケーションの妨げとなりうる特定の使用制限を浮き彫りにした。 一方、医療用マルチリードシステムは、最小限の電極数で迅速なセットアップとデータ処理を必要とする娯楽目的には不向きであることがわかった。 この研究の主な限界は、研究集団の規模が小さいことと、収集に使用するシステムの順番をランダム化していないことにある。 データは、サーカディアンリズムによって脳波に影響を与えうる取得時刻の影響を避けるために、同じ順番で取得された。 しかし、脳波パワーメトリクスは、標準的な脳波システムを使用した場合、個人に対して非常に信頼性が高く、再現性があることが証明されている。 このため、選択したサンプルサイズは有益であると考えられた。
結論として、脳波データは、臨床試験の設定を含む最適なアプリケーションの指針となるユーザビリティ、データ品質、信頼性に関するさまざまな制限を持ちながらも、民生用EEGシステムを含む試験した4つのシステムすべてからうまく収集することが可能であった。
Author Contributions
ER and AV: Conception and the design of the project, the analysis, and interpretation of data and manuscript preparationに参加した。 SW、CB、GR:プロジェクトの着想と設計、実行、データの解析と解釈、原稿作成に参加した。 1005>
Funding
本研究は、Biogen社の支援により実施されました。 SWとCB:Advanced Brain Monitoring, Incの従業員。 1005>
Acknowledgements
本研究に時間を割いて貢献してくれた研究参加者に謝意を表します。 バイオジェンチームは、研究デザイン、分析、データの解釈、報告書の執筆、論文の投稿の決定に参加しました。
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B.、他(2011). パーキンソン病関連認知症とアルツハイマー病における安静時脳波リズムの皮質源。 Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). “Development of EEG biomarkers for Alzheimer’s disease,” in GTC Biomarkers Summit (San Diego, CA).
Bialas, P., and Milanowski, P. (2014). A high frequency steady-state visually evoked potential based brain computer interface using consumer-grade EEG headset. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G.他 (2012).The Internet of the World. 定量的脳波とLORETA:FTDとADの鑑別に有用なツールか? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C.C., Hsu, C.Y., Chiu, H.W., Hu, C.J., and ChiehLee, T.(2015年). 脳波の周波数パワーとコヒーレンスはアルツハイマー病の重症度と相関する:台湾の多施設解析。 J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al(2015年).によると。 定量的な脳波マーカーは、前向き認知症登録オーストリア(PRODEM)におけるアルツハイマー病の重症度に関連している。 Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S.ら (2016). 脳波の優位周波数ピークがアルツハイマー病と前頭側頭葉変性症を鑑別する。 J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H.、その他 (2014). 緊急時や病院前のケアで使用するための準備時間を最小限に抑えた新しいワイヤレス脳波計システム。 Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., and Jo, S. (2015). EEGと眼球運動に基づく低コスト非侵襲性ハイブリッドインターフェースの定量的評価. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R.ほか (2017). “Deep networks using auto-encoders for PD prodromal analysis,” in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). ADHDを診断するための脳波の使用。 Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011).脳波を用いたADHDの診断。 認知機能障害とアルツハイマー病の被験者では、解剖学的基質と頭皮脳波マーカーが相関している。 Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T, Kitaura, Y., Saito, A.et al. (2011). LORETで明らかにした前頭側頭型認知症とアルツハイマー型認知症の定量的脳波の違い。 Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P. and Stam, C.J. (2008). 前頭側頭葉変性症における安静時脳波機能連関の検討。 Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., and Soria-Frisch, A. (2016). “EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients,” in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). パーキンソン病患者における視床皮質シータコヒーレンスの高さ。 J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | Cross Ref Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al(2016).の項参照。 肝性脳症の評価のための低コストで使いやすい脳波記録システム。 Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S.K., Berka, C., Tan, V., and Johnson, R. (2015). “A novel portable neurocognitive biomarker assessment for Parkinson’s Disease,” in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). 脳波バイオマーカーと臨床医のADHD評価との統合。 Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., and al. (2014). “Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG,” in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017年). Are we there yet? 脳性麻痺者によるコンピュータアプリケーションの制御のための商用グレードのブレイン・コンピュータ・インターフェイスの評価。 Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., and Bossemeyer, R. (2014). 低コストなEEGベースの睡眠検出。 Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., and Verma, A. (2016). “Identification of neurophysiological biomarkers of MCI using resting state, EEG,” in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar
.