はじめに
ß アミロイドとリン酸化タウタンパク質は、アルツハイマー病(AD)の病理的特徴で、分布する神経ネットワークに蓄積して予測可能に広がり、進行性の代謝異常、神経細胞の損傷、細胞死などを引き起こします。 神経画像は、認知機能低下の検査を受けている患者において、これらの病理学的変化を詳細に評価することを容易にする。 従来、ADの確定診断は、死後の観察およびこれらのタンパク質凝集体の神経解剖学的ステージングによってのみ可能であった。 しかし、近年の分子イメージング技術の進歩により、生きたヒトの脳におけるアミロイドやタウの沈着を可視化できるようになり、ADの生体内での確定診断に近づいている。
構造的イメージング
米国神経学会(AAN)の認知機能愁訴の診断に関するガイドライン1では、臨床歴が陽性で客観的に認知機能変化を認めるすべての患者に対して非造影CTやMRIによる脳構造イメージングを推奨している。 この中で、脳画像診断の主な役割は、非再生性の構造的病変の除外であり、そのうちの5%は臨床歴や身体検査から明らかでなく2、治療可能である可能性がある。 また、血管性認知症(VaD)、レビー小体型認知症(DLB)、前頭側頭型認知症(FTD)を臨床的に除外することも推奨されています。 2
構造的な萎縮を評価するのに適した画像診断法はCTとMRIであり、構造的な画像診断により診断の確実性が増し、19%から28%の臨床診断と15%の臨床例の管理が変わる。 疾患特異的な萎縮のパターンは、これらの画像診断法を用いて十分に説明され、検証されている。 CTでも萎縮は観察可能であるが、空間分解能が低く、灰白質/白質コントラストが劣るため、神経変性変化に関する有用な観察ができない可能性がある。 したがって、臨床医は、構造的変化のパターンと重症度を評価し、認知機能低下の非神経変性原因を除外し、以下に詳しく述べるように白質変化の重症度と範囲を評価するために、しばしばMRIに頼る。 萎縮が進むと,脈絡膜裂隙と側脳室側角が拡張してくる。 これらの構造に基づいてよく用いられる視覚的評価尺度である内側側頭葉萎縮(MTA)尺度(図1)は、臨床的3および神経病理学的4で有効性が確認されている。 また、内側側頭葉の萎縮は、健忘性軽度認知障害(MCI)からアルツハイマー型認知症への移行を予測することができます3
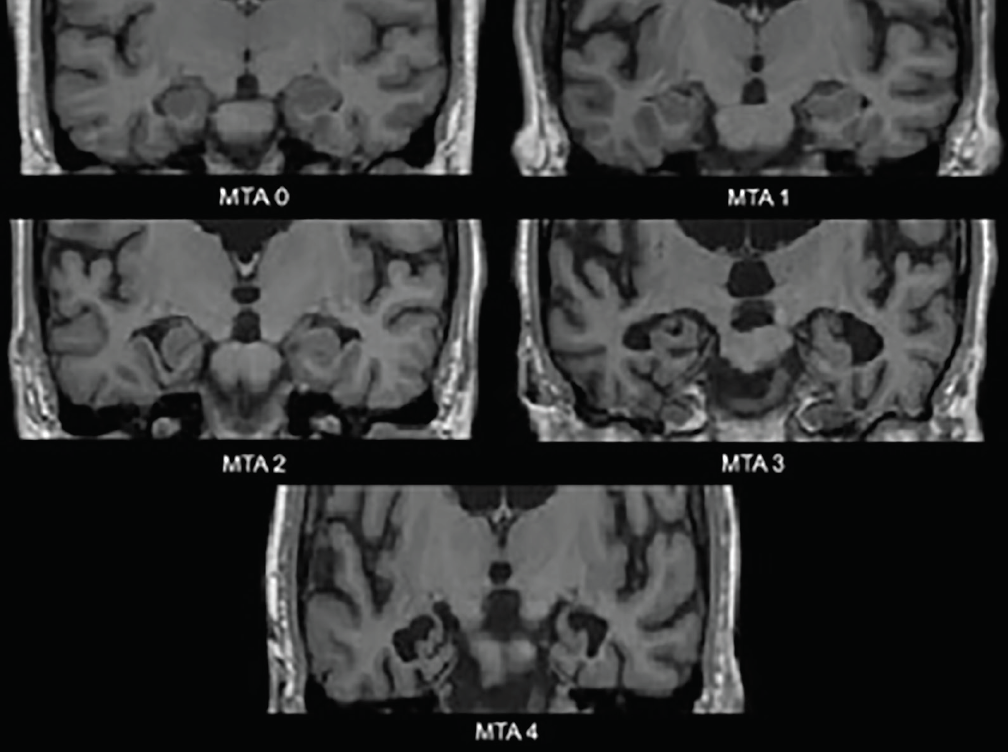
クリックで拡大表示
図1. 内側側頭葉萎縮(MTA)スケール評価。 MTA 0-脈絡膜裂孔の隙間はないか最小、MTA 1-脈絡膜裂孔のわずかな拡大、MTA 2-側脳室側角と合流する脈絡膜裂孔のさらなる拡大、海馬形成の高さの軽度な減少。 MTA 3-海馬形成の高さの中等度の減少、側脳室側角の顕著な拡大;MTA 4-海馬形成の高さの重度の減少、側脳室側角の顕著な拡大。
認知症症候群は、認知・行動症状に対応した典型的な萎縮パターン6を示すが、関係する構造が重複していることもある。 例えば、ADとDLBはともに側頭葉内側の病変を示すが、いくつかの画像および神経病理学的研究により、ADと比較してDLBでは側頭葉内側の構造への偏向が著しく少ないことが示されている4,5 (図2)。 アルツハイマー病(AD)(A)、レビー小体型認知症(DLB)(B)、前頭側頭型認知症(FTD)(C)、血管性認知症(VaD)(D)における構造的萎縮のパターン。 冠状動脈T1強調MRIでは、AD(A)とDLB(B)では、全身の皮質の萎縮が認められるが、海馬の萎縮の程度は異なる。 軸位T1強調MRIでは、内側および外側前頭前野に限局したbvFTDの萎縮が認められる(C)。 軸方向T2強調MRIは、放線冠を含み外側前頭葉新皮質に広がる脳室周囲キャップとハロー白質低点密度(WMH)、軽度散在WMH、VaDの独立脳室下裏打ちと透明体中隔のWMHを示す(D)。
クリックで拡大表示
図2. アルツハイマー病(AD)(A)、レビー小体型認知症(DLB)(B)、前頭側頭型認知症(FTD)(C)、血管性認知症(VaD)(D)にわたる構造的萎縮のパターン。 冠状動脈T1強調MRIでは、AD(A)とDLB(B)では、全身の皮質の萎縮が認められるが、海馬の萎縮の程度は異なる。 軸位T1強調MRIでは、内側および外側前頭前野に限局したbvFTDの萎縮が認められる(C)。 軸方向T2強調MRIは、放線冠を含み外側前頭葉新皮質に広がる脳室周囲キャップとハロー白質低点密度(WMH)、軽度散在WMH、VaDの独立脳室下裏打ちと透明体中隔のWMHを示す(D)。
ADと前頭側頭葉変性症(FTLD)はともに前頭前野、眼窩前頭、前島皮質、前側頭葉、内側側頭葉などの萎縮領域が重複している6)。 しかし、ADでは側頭葉と後頭葉の萎縮が有意に多く、FTLDでは前頭葉の萎縮が多い(図2)6
画像診断を最大限に活用するためには、構造的萎縮と解剖学的温存の両方の領域に注目し、すべての脳領域を系統的に評価することが重要である。 最近行われた大規模な多施設共同研究において,AD,DLB,FTLDの病理学的に確認された186症例を6つの視覚評価尺度で正しく分類することが評価された。 虚血性変化は通常の加齢でよく見られ,一般的な併存疾患(例えば,高血圧,糖尿病,高コレステロール血症)により加速される。 T2強調画像やFLAIR画像で、有意な白質増多(WMH)、皮質脳卒中、戦略的に配置されたラクーンが検出されると、認知障害への血管の関与がしばしば推測される。 基底核のラクナストローク、半月状遠心と放線状冠のWMHは、慢性小血管虚血障害の指標となる(図2)。 一方、脳室周囲の被膜は、しばしば非虚血性であり、脳室下のグリオーシスを反映している7。臨床現場で使用できるWMH重症度スケール(例:Fazekasスケール)7がいくつか存在する。 7
Diffusion tensor imaging(DTI)は、軸索の構造により水の流れが制限されるため、組織内の水の拡散に感度を持つ新しいMRIシーケンスであり、白質の完全性を評価することができる。 DTIでは、平均拡散係数と分数異方性の測定が、神経変性変化の特徴づけによく用いられる。 前者は拡散の大きさを測定し、後者は健康な軸索で予想されるように、水が一方向に優先的に流れているかどうかを測定する。 平均拡散係数の低下と分画異方性の減少は、MCIと認知症ADの両方の集団で一貫して報告されています8。いくつかの研究では、AD発症リスクのある無症状者におけるDTI変化も確認されており9、これらの変化は疾患経過の初期に生じることが示唆されています。 白質インテグリティの評価に加え、DTIは、トラクトグラフィ・アルゴリズムを用いて皮質領域間の粗い構造的結合をモデル化するために用いることができる。 10 DTIは白質健全性の指標として可能性を示しているが、動きに対する感度やその他の技術的制約から、少なくとも当面の間は臨床応用が制限されている。 神経細胞の機能は血液中の酸素とグルコースに依存しており,その供給は局所的な血管拡張によって促進される。 18F-フルオロデオキシグルコースポジトロン断層撮影(FDG-PET)は皮質活動の程度を間接的に反映し,このグルコースへの代謝依存性を利用して神経変性変化を容易に可視化することが可能である。 ADとは異なり、FTDの代謝的特徴は、前頭葉、前側頭葉、基底核および視床の代謝低下を示し、後部連合皮質は比較的温存されています13。 同様に、DLBの新皮質代謝シグネチャーはADの代謝シグネチャーと重複することがありますが、DLBでは後頭部の代謝低下も認められます14。
メディケアサービスセンターは、ADとFTDの両方の基準を満たし、AANガイドライン1に従って診断検査を実施しても病因が確定しない場合にのみ、FDG-PETを「妥当かつ必要」とみなしています15
Functional MRI(fMRI)は、脳活動による酸素化/脱酸素化ヘモグロビンの時間変化を感知するシーケンスを使用して、脳活動を測定することも可能です。 このように、fMRIは脳活動に必要なグルコース代謝によってヘモグロビンが変化するため、FDG-PETと関係がある。 領域間の時間依存性から、機能的結合性(どの領域が活発に情報伝達を行っているか)を推測することができる。 FDG-PETと比較して、fMRIは空間分解能が向上しており、より正確に結合性をマッピングすることが可能である。 fMRIのもう一つの利点は、タスク実行中または安静時に画像を取得できることである。 前者は、特定の活動状態によって駆動される結合パターンを識別し、後者は、デフォルトモードネットワーク(DMN)として知られる安静時に存在する結合パターンを識別する。 DMNは、機能的ハブであるPCCと楔前部によって定義され、それらは背内側サブシステムと内側側頭サブシステムに接続している16。 現在、fMRI技術は研究用途に限定されているが、臨床的に応用可能なアルゴリズムを開発する道が積極的に模索されている。 しかし、経験豊富な認知症専門医の手によっても、ADの臨床診断は感度70.9%〜87.3%、特異度44.3%〜70.8%という不安なレベルにとどまっているのが現状である。18 ADの臨床診断精度の向上に最も適切なのは、ADに関連するβアミロイドおよびリン酸化タウ凝集体に特異的な親和性を有する放射性標識PETイメージングトレーサー(図3)の開発であり、これによってかつては死後でしか不可能だった基礎的な神経病理(表)をin vivoで証明することが可能となった
Amyloid Positron Emission Tomography
Amyloid, そして最近では、タウイメージングは、発症前の段階でもAD病理を可視化する我々の能力を革新している19)。 アミロイドPETイメージングトレーサーは、さまざまな病期のAD病理を生体内で検出するために有効かつ信頼性の高いものです。 20
タウと比較して、アミロイド病理は、前頭葉、側頭葉、後頭葉の基底部から背側新皮質連合領域に広がる、より拡散した領域パターンで始まり、一次感覚野と運動野の後期関与のみが認められる21。 21 トレーサーの取り込みが最も顕著な領域は、前頭葉、頭頂葉、側頭葉であり(図3)、AD患者は対照群22または他の認知症の患者に比べて1.5~2倍取り込みが大きい23
Amyloid PET画像は、ADアミロイド分布の特徴的領域における皮質トレーサー取り込みを評価するものである。 陽性スキャンでは、トレーサー取り込みが新皮質に広がるにつれて、灰白質/白質の区別が失われる。 24 アミロイドPET画像パターンは、健常者とMCI患者の両方において、認知機能の低下を確実に予測することができる20。
費用、リスク、利益の関係が不明であることから、アミロイドイメージングの適正使用基準が作成され、原因不明のMCI、非定型AD症状、早期発症の認知症を持つ人にアミロイドPET評価の必要があるとされるに至った26。 専門家は、アミロイドイメージングの不適切な適応として、臨床、認知、検査、構造的神経画像検査 を十分に行う前の認知機能に関する単独評価、客観的認知機能障害がない場合、ADの可能性が高い場合 (すなわち、臨床的に同等でない場合、認知症の重症度分類のため)などを挙げています。
Center for Medicare and Medicaid Servicesが実施しているIDEAS(Imaging dementia-evidence for amyloid scanning)研究では、現在、適切な使用基準を検証し、MCIまたは非定型症状のMedicare受益者に対する疾患管理および長期転帰に対するPETによるアミロイド状態の判断の影響を評価中である。 中間解析では、アミロイドPETを臨床検査に組み込むことにより、MCI患者の60.2%および認知症患者の63.5%で疾患管理が変更されたことが明らかにされた。 タウPETイメージングトレーサーは現在開発中であり、すでに有望視されている。 アミロイドPETと同様に、タウPETトレーサーはリン酸化タウの特定のコンフォメーションモチーフを標的とする。 タウPETトレーサーの特異性は死後も検証されており28 、観察されるタウPETシグナルは、現在ADの神経病理学的診断に用いられている神経原線維変化の解剖学的分布とほぼ一致している29 。タウPETイメージングで可視化できるタウ病変の初期段階では、内嗅皮質と海馬における神経原線維変化の沈着が認められる。 次に、下側頭葉と外側側頭葉(図3)、頭頂葉と後頭葉、そして最後に前頭葉でタウ沈着が検出されるようになり、脳内のタウ沈着の病期分類が確立されたBraak and Braakに従う21。 しかし、ADの臨床経過全体を通じてタウ・トレーサー結合がダイナミックに変化することを考えると、このイメージング様式は、in vivoでの疾患の重症度のステージングに重要な役割を果たすと思われる30。
Future Directions
ADの病態は認知症と診断される20年前までに容易に発見でき19、予測可能な段階的分布を示すことから、現在、バイオマーカーの利用による発症前の早期発見と診断精度の向上に研究が集中している(表)。31 脳内の3つのバイオマーカー変化を検出することに着目し提案されているアミロイド-タウ-神経変性(ATN)研究フレームワークは、マルチモダル画像処理の臨床との関連性を予期している31。 ATN分類システムは、臨床症候群にとらわれず、ADバイオマーカーのレンズを通して神経変性疾患の全領域を把握します。 ATNは、さらなる開発と改良により、客観的なin vivoバイオマーカー分類を通じて、臨床診断の精度を劇的に向上させ、医療の質を高めることが期待される。 すべての神経変性疾患は臨床的に大きな異質性を示し,最新の分子イメージングが進歩する以前は,生前に確定診断できるものはなかった。 現代の画像診断技術は、根底にある神経病理学を反映する多数のエピフェノメアを検出することができ、その中には病源にかなり近接したものもある。 現在、最も信頼できる臨床診断は、病歴、医師の観察、身体診察、医学的検査、神経心理学的検査、そして情報に基づいた診断用神経画像の解釈の統合に基づいている。 ATNバイオマーカーがさらに改良されれば、生きている患者において臨床診断がより早く、より明確に行われるようになり、症状の分類に頼ることが少なくなり、神経変性疾患の経過を変えるかもしれない早期治療介入の機会を提供することになるであろう。 Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review)(実践パラメータ:認知症の診断(証拠に基づくレビュー))。 米国神経学会の品質基準小委員会の報告書。 Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the American Academy of Neurology’s practice parameters.認知症の評価:米国神経学会の診療パラメータの有用性についての系統的研究。 Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. MCIにおける低、中、高度海馬萎縮の3D比較. Hum Brain Mapp. このような状況下において、「認知症」の診断には、MRIによる視覚的評価尺度が有効である。 Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. MRI上の内側側頭葉の萎縮がアルツハイマー病とレビー小体型認知症や血管性認知障害を鑑別する:診断の病理的検証を伴う前向き研究. Brain. また、”atrophy “は、”atrophy “が “atrophy “であることを意味し、”atrophy “が “atrophy “であることを意味する。 J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. incidental MRI white matter signal hyperintensitiesのPathologic correlates(病理学的相関). Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP.(ホァン J、フリードランド RP、オーカス AP)。 このような場合、「己の信念を貫く」ことが重要である。 AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al.自覚症状と軽度認知障害における白質画像変化. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al.アミロイド陽性高齢者における構造路の変化は、下流のタウ蓄積を予測する。 Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly.認知的に正常な高齢者と軽度障害のある高齢者における脳代謝変化の表面特徴マッピング。 また,”Mol Imaging Biol.2010;12(2):218-224.4756>
12.Mol Imaging Biol. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PETは前頭側頭型認知症とアルツハイマー病の鑑別精度を向上させた。 Brain. 2007;130(Pt 10):2616-2635.
13. 前頭側頭型認知症患者における脳内糖代謝. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. 軽度認知障害、アルツハイマー病、その他の認知症の多施設共同標準的18F-FDG PET 診断。 J Nucl Med. 2008;49(3):390-398.
15 . メディケア&メディケイド・サーヴィス向けセンター。 Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. 2019年5月4日にアクセスしました。
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease.バックナーRL、セパルクルJ、タルクダーT、他。 J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. 神経変性疾患は大規模なヒトの脳内ネットワークを標的とする。 Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. National Institute on Aging Alzheimer Disease Centersにおけるアルツハイマー病の臨床診断の正確さ、2005-2010年。 J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease(ヤグストW.アルツハイマー病の進化と病態のイメージング). Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. The diagnostic value of FDG and amyloid PET in Alzheimer’s disease-a systematic review(アルツハイマー病におけるFDGおよびアミロイドPETの診断価値). Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Pittsburgh Compound-Bを用いたアルツハイマー病における脳アミロイドの画像化. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. 認知症症候群におけるアミロイドPET陽性の有病率:メタアナリシス(Meta-analysis)。 JAMA. 2015;313(19):1939-1949.
24. 簑島 聡、Drzezga AE、Barthel H、他. SNMMI手順基準/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0.日本経済新聞社. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. 追跡期間の異なる軽度認知障害からアルツハイマー病への進行に対するアミロイドイメージングの予測精度:メタアナリシス. . 医学(ボルチモア). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. アミロイドPETの適切な使用基準:Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Associationの報告書. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. アミロイドポジトロンCTと軽度認知障害または認知症のメディケア受給者のその後の臨床管理変更との関連性。 JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiography validation of novel tau PET tracer -MK-6240 on human postmortem brain tissue(ヒト死後脳組織における新規タウPETトレーサー-MK-6240のオートラジオグラフィーによる検証). Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. 新規PHF-tauラジオリガンド-T807による初期臨床PETイメージング結果。 J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Alzheimer diseaseのステージングとβ-アミロイドとタウオパシーの相互作用の解明におけるタウイメージングの評価. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA研究フレームワーク: アルツハイマー病の生物学的定義に向けて。 Alzheimers Dement. 2018;14(4):535-562.
MRA と DS は開示事項を報告しない。
LGAはEli Lillyのアドバイザリーボードメンバーを務めたことがある。