水素がフッ素、塩素、酸素、窒素などの電気陰性度の高い原子に共有結合している場合、H原子はHδ+と書いて部分的に正の電荷を持つことになります。
Hδ+ は物理的に非常に小さいので、その電荷密度は異常に高くなります。
別の分子上の負または電気陰性原子が Hδ+ に接近すると想像してください。相互引力が生じ、特に強い双極子-双極子引力が生じます。この引力を水素結合と呼びます。
一般に水素結合はイオン結合や共有結合よりは弱いですが、ファンデルワールス力よりは強いです。

Hydrogen Bonding in Water
水素結合の最も有名な例は水です:
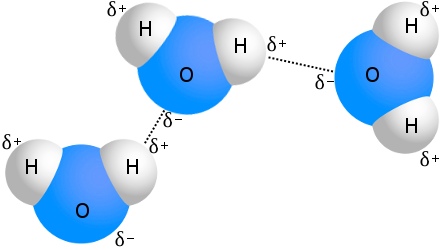
どの水分子にも4つもの他の水分子と水素結合できることがあります。室温の水では、水分子あたりの水素結合の平均数は 3.6 である。
分子のランダムな熱運動により、水中の個々の水素結合の寿命は短く、平均で 10 ピコ秒しかない。しかし、新しい結合を形成する時間はさらに短い。
水中で単一の水素結合を永久に切断するには、21 kJ mol-1 と大きなエネルギーが必要である。その結果、水の融点と沸点は、このような低分子量分子に対して予想されるよりもはるかに高くなる。
水とメタンを考えてみましょう。水の分子は水素結合で強く引き合うのに対し、メタンではファンデルワールス力が働くので、分子量は水が18、メタンが16と同じですが、物理的性質が大きく異なります。例えば、水は0.00℃で溶けて99.98℃で沸騰し、メタンは-182.5℃で溶けて-161.5℃で沸騰します。
水の水素結合と硫化水素
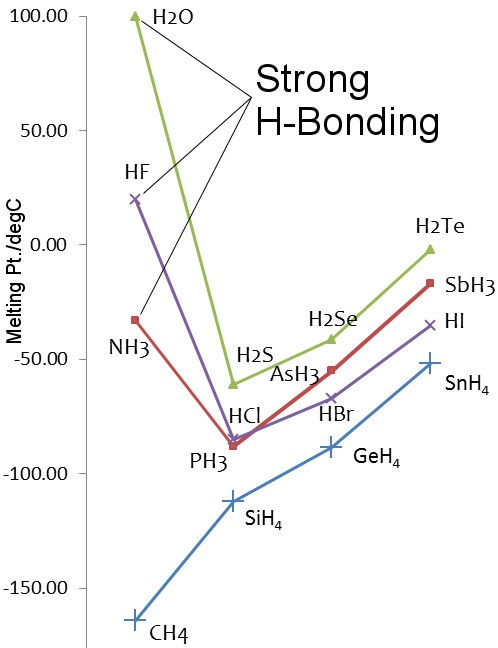
イオンは周期表で酸素と同じ16族に属しています。 硫黄は酸素より重いので、H2SはH2Oより融点や沸点が高いはずですが、硫黄は酸素より電気陰性度が低く、H2Sでの水素結合は弱いので、そうではありません。 質量 16
融点: 0.00 ℃
沸点: 99.98 ℃
酸素の電気陰性度(ポーリング): 3.44
水素結合エンタルピー : 21 kJ mol-1

Mol.O
融点:-82℃
沸点:-60℃
Sの電気陰性度(ポーリング):2.58
水素結合エンタルピー:≅ 3 kJ mol-1
アンモニアとフッ化水素の水素結合
フッ素と窒素は周期表グループの中で最も電気陰性な元素で、水素結合は、フッ化水素とアンモニアで観察されています。
水の場合と同様に、フッ化水素とアンモニアの融点と沸点は、そのグループの重元素の水素化物より高い。
14~17族元素の水素化物の融点
DNAにおける水素結合
DNAは2本のらせんを塩基対でつなぎ、塩基対がDNAの遺伝情報を担っています。
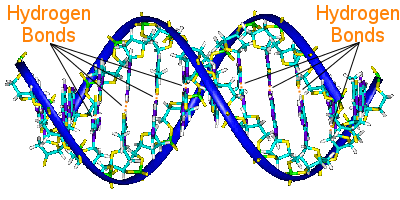
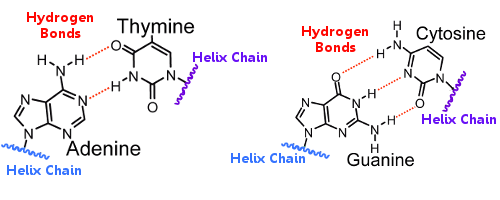
一方のらせん上の塩基対は、もう一方のらせん上の塩基対と水素結合で結ばれており、水素結合がらせんをつなぎ合わせ、有名な二重らせんを形成します。
ウールにおける水素結合
他のタンパク質繊維と同様に、ウールにも水素結合があります。下の画像は、ウールのα-ヘリックス鎖(緑)のコイルを水素結合(オレンジ色の点)が結びつけている様子を示しています。
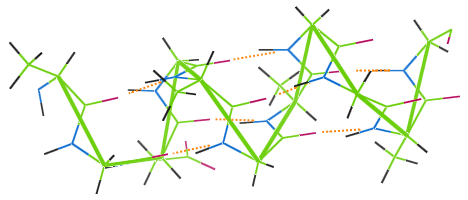
ウールの衣服を高温で洗濯すると、水素結合が破壊され、コイルは弾性を失い、衣服はくたくたになる。